铁、铜的获取及应用[上学期]
图片预览








文档简介
课件20张PPT。铁、铜的获取和利用江 苏 溧 阳 周 雪 峰想 一 想铁、铜是人类使用最早、应用最广泛的两种金属
列举你所熟悉的铁、铜两种金属的应用实例铁、铜的应用与物理性质1银白色,有金属光泽、具有良好
的延展性、是电和热的良导体、
密度是7.86g/cm3、
熔点15350C,沸点是27500C
特性:能被磁体吸引,具铁磁性建材;炊具;铸件;作催化剂;制具有特性的铁合金;制磁铁等。纯铜呈紫红色、熔点1083.4℃,沸点2567℃、密度8.92g/cm3;质软; 具有良好的延展性、
具有良好的导热、导电性广泛用于电气工业;制铜合金;作各种仪表的零件 我们已经学过哪些方法可以得到铁和铜?
试写出化学反应方程式,完成P70表格
并思考:主要利用什么类型的反应?复 习 回 忆阅读课文P71到73页内容,完成下列问题
1、自然界中铁和铜以什么形式存在?
2、工业上炼铁的设备?主要原料?
3、炼铁中,铁矿石是如何变成铁的?
CO是怎样形成的?石灰石的作用是什么?
并写出相关反应方程式阅 读 思 考1.铁以化合态形式存在于自然界:
磁铁矿 赤铁矿存 在 形 式游离态的铁
:陨石2.自然界中铜主要以化合态形式存在
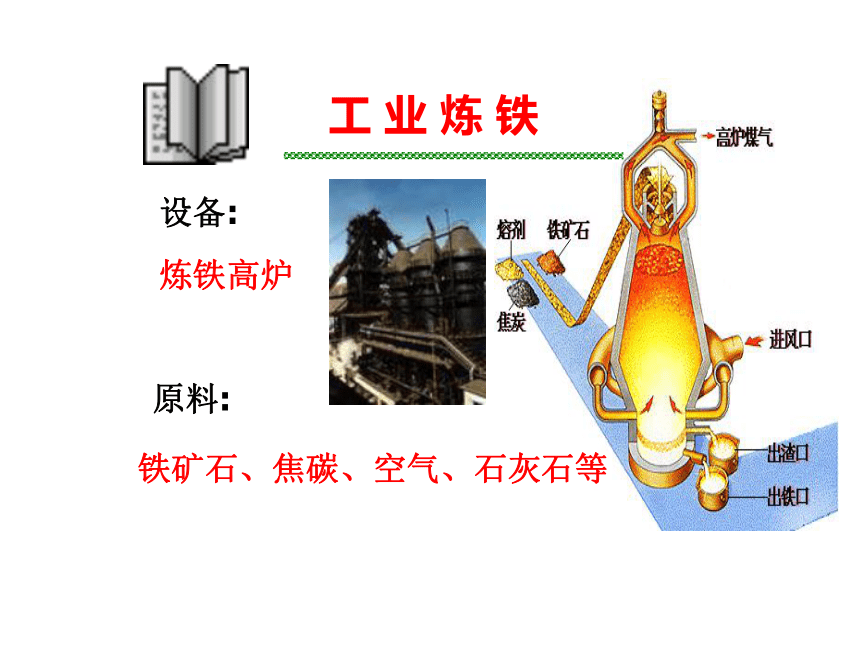
黄铜矿 孔雀石存 在 形 式工 业 炼 铁设备:炼铁高炉原料:铁矿石、焦碳、空气、石灰石等工 业 炼 铁冶炼原理:1、提供CaO除SiO2成炉渣
2、提供CO2制备还原剂CO加入石灰石作用:CO的制备:产物:生铁除碳钢2%~4.5%0.03 %~ 2 %铜 的 冶 炼现代工业: 高温炼铜原料: 黄铜矿(CuFeS2)电解精铜(99.95%-99.98%)粗铜高温
冶炼古代:湿法炼铜Fe+Cu2+=Fe2++Cu现代工业: 生物炼铜铁 的 化 性 完成P72页问题与讨论补充铁与S和I2 、水的反应铁与硫反应: 铁与I2反应:与水反应常温下遇浓硝酸、浓硫酸发生钝化铜 的 化 性 补充铜与Cl2及S的反应Cl2具强氧化性,把金属氧化至高价态S具弱氧化性,把金属氧化至低价态Fe3+ 的 性 质 1、溶液颜色浅黄色溶液开动思维:分析铁的化合价,你认为Fe3+具
什么样的性质?为什么?铜片上滴加FeCl3溶液
观察与思考:有什么现象?生成了什么物质?2、Fe3+具氧化性2Fe3++ Cu = 2Fe2++ Cu 2+2Fe3++ Fe = 3Fe2+Fe3+ 的 性 质 FeCl3溶液中滴加KSCN溶液
FeCl2溶液中滴加KSCN溶液
观察与思考:有什么现象?生成了什么物质?3、Fe3+的特性Fe3++ 3SCN- = Fe(SCN)3用途: 检验Fe3+Fe2+ 的 性 质 1、溶液颜色浅绿色溶液开动思维:分析铁的化合价,你认为Fe3+具
什么样的性质?为什么?2、氧化性:可被活泼金属还原出单质铁Fe2++ Zn = Fe+ Zn2+Fe2+ 的 性 质 观察与思考: FeCl2溶液中分别滴加氯水
和H2O2溶液,再加KSCN溶液有什么现象?
生成了什么物质?3、强还原性: Fe2+可被氧化剂氧化成Fe3+ 2Fe2++ Cl2 = 2Fe3++ 2Cl-2Fe2++ H2O2 + 2H+ = 2Fe3+ + 2H2O思考:如何保存Fe2+的盐溶液? 4Fe(OH)2+O2+ 2H2O == 4Fe(OH)3完成课本P73页活动与探究
并思考:如何鉴别溶液中是否含Fe2+、Fe3+ ?开 动 思 维1、物理方法:看颜色2、化学方法:
⑴加KSCN溶液,看溶液是否变成血红色
⑵先加氯水或H2O2溶液,再加KSCN溶液,
看溶液是否变成血红色钢 铁 的 腐 蚀思考:钢铁在哪些场所容易被腐蚀?
你知道钢铁腐蚀的条件吗?钢 铁 的 腐 蚀思考:钢铁在哪些场所容易被腐蚀?
你知道钢铁腐蚀的条件吗?钢铁若和潮湿的空气、酸、盐溶液等物质接触,
铁都会失去电子,发生腐蚀现象(生锈)FeFe2+Fe(OH)2Fe3+Fe(OH)3Fe2O3·xH2O解 决 问 题思考:钢铁容易被腐蚀,你知道怎样防止吗?1、表面覆盖保护层喷油漆、包裹塑料、镀上起保护作用的金属等2、添加一定的铬、镍等元素,改变钢铁的内部
结构,使它抗腐蚀性增强,制不锈钢3、在钢铁表面镀比铁更活泼的金属船壳镀锌谁强(还原性强)谁先反应(被氧化而腐蚀)4、外加电流(钢铁水闸的防腐)
列举你所熟悉的铁、铜两种金属的应用实例铁、铜的应用与物理性质1银白色,有金属光泽、具有良好
的延展性、是电和热的良导体、
密度是7.86g/cm3、
熔点15350C,沸点是27500C
特性:能被磁体吸引,具铁磁性建材;炊具;铸件;作催化剂;制具有特性的铁合金;制磁铁等。纯铜呈紫红色、熔点1083.4℃,沸点2567℃、密度8.92g/cm3;质软; 具有良好的延展性、
具有良好的导热、导电性广泛用于电气工业;制铜合金;作各种仪表的零件 我们已经学过哪些方法可以得到铁和铜?
试写出化学反应方程式,完成P70表格
并思考:主要利用什么类型的反应?复 习 回 忆阅读课文P71到73页内容,完成下列问题
1、自然界中铁和铜以什么形式存在?
2、工业上炼铁的设备?主要原料?
3、炼铁中,铁矿石是如何变成铁的?
CO是怎样形成的?石灰石的作用是什么?
并写出相关反应方程式阅 读 思 考1.铁以化合态形式存在于自然界:
磁铁矿 赤铁矿存 在 形 式游离态的铁
:陨石2.自然界中铜主要以化合态形式存在
黄铜矿 孔雀石存 在 形 式工 业 炼 铁设备:炼铁高炉原料:铁矿石、焦碳、空气、石灰石等工 业 炼 铁冶炼原理:1、提供CaO除SiO2成炉渣
2、提供CO2制备还原剂CO加入石灰石作用:CO的制备:产物:生铁除碳钢2%~4.5%0.03 %~ 2 %铜 的 冶 炼现代工业: 高温炼铜原料: 黄铜矿(CuFeS2)电解精铜(99.95%-99.98%)粗铜高温
冶炼古代:湿法炼铜Fe+Cu2+=Fe2++Cu现代工业: 生物炼铜铁 的 化 性 完成P72页问题与讨论补充铁与S和I2 、水的反应铁与硫反应: 铁与I2反应:与水反应常温下遇浓硝酸、浓硫酸发生钝化铜 的 化 性 补充铜与Cl2及S的反应Cl2具强氧化性,把金属氧化至高价态S具弱氧化性,把金属氧化至低价态Fe3+ 的 性 质 1、溶液颜色浅黄色溶液开动思维:分析铁的化合价,你认为Fe3+具
什么样的性质?为什么?铜片上滴加FeCl3溶液
观察与思考:有什么现象?生成了什么物质?2、Fe3+具氧化性2Fe3++ Cu = 2Fe2++ Cu 2+2Fe3++ Fe = 3Fe2+Fe3+ 的 性 质 FeCl3溶液中滴加KSCN溶液
FeCl2溶液中滴加KSCN溶液
观察与思考:有什么现象?生成了什么物质?3、Fe3+的特性Fe3++ 3SCN- = Fe(SCN)3用途: 检验Fe3+Fe2+ 的 性 质 1、溶液颜色浅绿色溶液开动思维:分析铁的化合价,你认为Fe3+具
什么样的性质?为什么?2、氧化性:可被活泼金属还原出单质铁Fe2++ Zn = Fe+ Zn2+Fe2+ 的 性 质 观察与思考: FeCl2溶液中分别滴加氯水
和H2O2溶液,再加KSCN溶液有什么现象?
生成了什么物质?3、强还原性: Fe2+可被氧化剂氧化成Fe3+ 2Fe2++ Cl2 = 2Fe3++ 2Cl-2Fe2++ H2O2 + 2H+ = 2Fe3+ + 2H2O思考:如何保存Fe2+的盐溶液? 4Fe(OH)2+O2+ 2H2O == 4Fe(OH)3完成课本P73页活动与探究
并思考:如何鉴别溶液中是否含Fe2+、Fe3+ ?开 动 思 维1、物理方法:看颜色2、化学方法:
⑴加KSCN溶液,看溶液是否变成血红色
⑵先加氯水或H2O2溶液,再加KSCN溶液,
看溶液是否变成血红色钢 铁 的 腐 蚀思考:钢铁在哪些场所容易被腐蚀?
你知道钢铁腐蚀的条件吗?钢 铁 的 腐 蚀思考:钢铁在哪些场所容易被腐蚀?
你知道钢铁腐蚀的条件吗?钢铁若和潮湿的空气、酸、盐溶液等物质接触,
铁都会失去电子,发生腐蚀现象(生锈)FeFe2+Fe(OH)2Fe3+Fe(OH)3Fe2O3·xH2O解 决 问 题思考:钢铁容易被腐蚀,你知道怎样防止吗?1、表面覆盖保护层喷油漆、包裹塑料、镀上起保护作用的金属等2、添加一定的铬、镍等元素,改变钢铁的内部
结构,使它抗腐蚀性增强,制不锈钢3、在钢铁表面镀比铁更活泼的金属船壳镀锌谁强(还原性强)谁先反应(被氧化而腐蚀)4、外加电流(钢铁水闸的防腐)
