专题一的复习[上学期]
图片预览









文档简介
课件38张PPT。专题一
化学家眼中的物质世界
(复习)第一单元
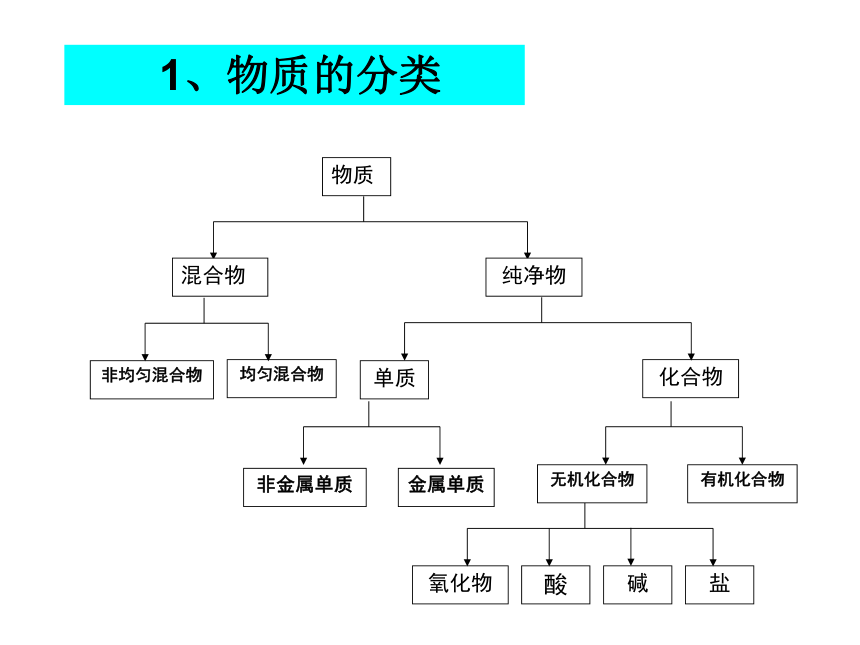
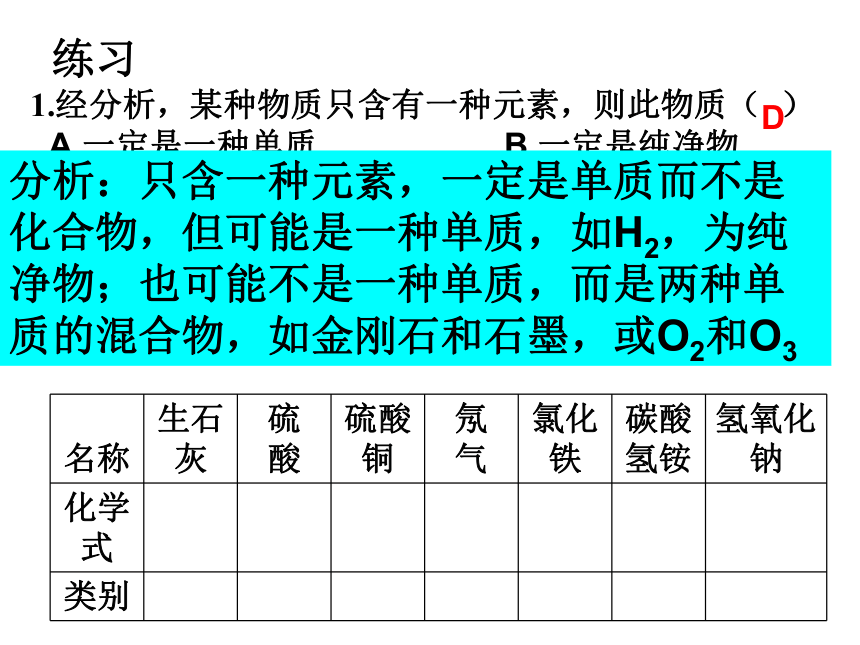
丰富多彩的化学物质物质分类及转化转化时的定量关系:物质的量聚集状态分散系物质 1、物质的分类1.经分析,某种物质只含有一种元素,则此物质( )
A.一定是一种单质 B.一定是纯净物
C.一定是混合物 D.可能是纯净物,也可能是混合物
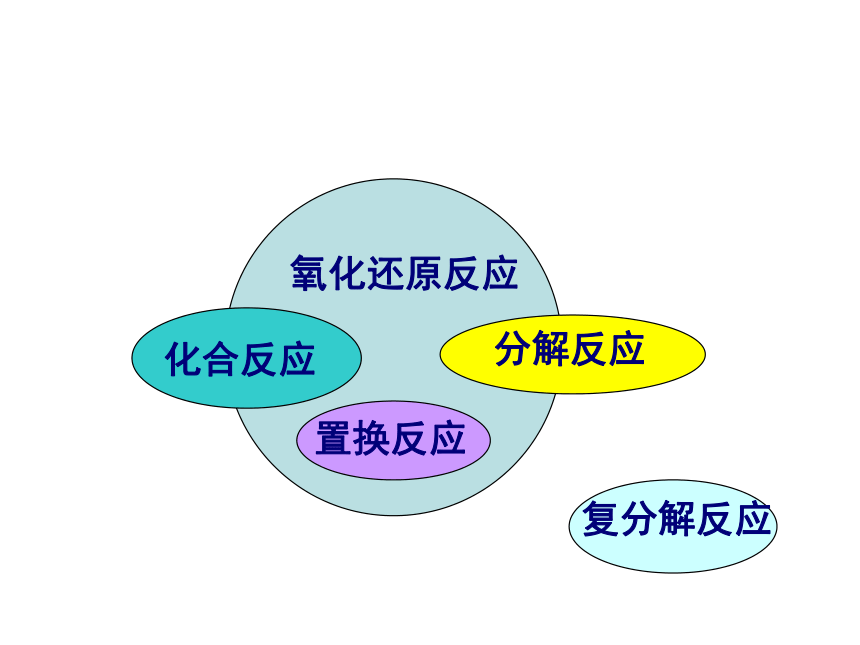
D2.填表分析:只含一种元素,一定是单质而不是化合物,但可能是一种单质,如H2,为纯净物;也可能不是一种单质,而是两种单质的混合物,如金刚石和石墨,或O2和O3练习 (1)置换反应的规律与条件2、转化 (2)复分解反应的规律与条件氧化还原反应化合反应置换反应分解反应复分解反应单位 摩尔 ,符号为mol 。 * * 是表示含有一定数目微粒的集合体。{分子、原子、原子团、离子、电子、质子、中子等3、物质的量 * 是国际单位制七个基本物理量之一,表示物质含微粒集合体多少的。* *是一专有名词,由四个字组成 ,是一个整体,不能分割,也不可加字、减字。符号为n 问某物质的物质的量是多少?答:几摩尔我们把0.012kg12C中所含有的
碳原子数规定为1摩尔。规定:阿伏加德常数符号:NA数值:约为6.02×1023 。使用摩尔时,必须指明粒子(分子、原子、离子、质子、电子等)的种类。
公式: n=
【练习】
1.0.5 mol水中含有 个水分子。
2.2 mol水中含有 个水分子, 个氢原子。
3.1 mol H2SO4中含有 个H2SO4分子, 个硫酸根离子。
4.1 mol HCl溶于水,水中存在的溶质粒子是什么?它们的物质的量各是多少?
5.1个水分子中有 个电子,1 mol H2O中呢?定义:符号:g·mol-1单位:M摩尔质量单位物质的量的物质所具有的质量。数值:相对原子质量或相对分子质量练习 0.01 mol某物质的质量为1.08g,此物质的摩尔质量为 。108g.mol-1 483 g Na2SO4·10H2O中所含的Na+和SO42-的物质的量各是多少?所含H2O分子的数目是多少?
定义 :
符号:
表达式:Vm=
单位:
1、物质的聚集状态:
2、气体摩尔体积四、物质的聚集状态气态、液态和固态单位物质的量的气体所占的体积Vm在标准状况下,1 mol任何气体的体积
都约是22.4 L。L·mol-1物质
质量物质
的量微粒
数÷M×M×NA÷NA×22.4L/mol÷22.4L/mol[关系](标准状况)体积气体NaOH + HNO3 == NaNO3 + H2O [例1]完全中 和 0 .5 mol NaOH 需多少摩的 HNO3?其质量是多 少克?解: 答:完全中和0.5molNaOH需0.5mol HNO3 其质量为31.5g设需HNO3的物质的量为n。 n= 0.5 mol 1mol1moln0.5 molHNO3的摩尔质量为63 g/molm(HNO3)=nM= 0.5mol×63g/mol=31.5g因为所以“n” 用于化学方程式的计算1.分散系:一种(或几种)物质的微粒分散到另一种物质里形成的混合物。
(分散质、分散剂)
分类:溶液、 浊液、 胶体
2.胶体:
(1)概念:分散质微粒直径大小在10-9~10-7m之间的分散系。
(2)性质:丁达尔现象
3.溶液:电解质溶液、非电解质溶液(<1nm 1 ~100nm >100nm)五、物质的分散系4.化合物
电解质:在水溶液中或熔融的状态下能导电的化合物(酸、碱、盐、金属氧化物、水等)
非电解质:在水溶液中或熔融的状态下都不能导电的化合物(有机物、非金属氧化物(除水)、NH3等
5.电离方程式
NaCl == Na+ + Cl-
H2SO4 == 2H+ + SO42-
NaOH == Na+ + OH- 【2】、下列物质(1)能导电的是( )
(2)属于电解质的是( )
(3)属于非电解质的是( )
A.NaOH溶液 B.Cu C.液态HCl
D.液态CH3COOH E.蔗糖溶液 F.液氨 G.氨水H.CuSO4 I.石墨 J.无水乙醇ABGICDHFJ【1】 如何用简便的方法鉴别胶体和溶液呢?【3】、下列物质属于电解质的是 ( )
A.金属铁 B.食盐水 C.酒精 D.纯碱用丁达尔现象加以区别 D 【练习】§2.2 物质的检验 第二单元
研究物质的实验方法§2.1 物质的分离与提纯§2.3 溶液的配制与分析1、物质的分离与提纯【练习】
1.下列仪器常用于物质分离的是( )
①漏斗 ②试管 ③蒸馏烧瓶 ④天平 ⑤分液漏斗 ⑥研钵
A.①③④ B.①②⑥
C.①③⑤ D.①③⑥ 4.为了除去粗盐中Ca2+、Mg2+、SO42-
及泥沙,可将粗盐溶于水,然后进行下列五项操作。其中正确的操作顺序是( )
①过滤 ②加过量的NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液
A.①④②⑤③ B.④①②⑤③
C.②⑤④①③ D.⑤②④①③CDC含有K+透过蓝色钴玻璃观察到紫色在酒精灯火焰上灼烧K+(钾盐)含有SO42-生成白色沉淀、不溶解。加BaCl2溶液,再加稀HClSO42- (硫酸盐)有Cl-生成白色沉淀、不溶解。滴加AgNO3,再加稀硝酸Cl- (盐酸盐)含有NH4+。试纸变蓝。加浓的氢氧化钠、加热,用湿润的红色石蕊试纸放在 试管口NH4+ (铵盐)结论现象检验方法待检物质二、常见物质的检验法1.溶液中可能有下列阴离子中的一种或几种:SO42-、CO32-、SO32-、CL-
(1)当溶液中有大量H+存在时,则不可能有______ 存在。
(2)当溶液中有大量Ba2+存在时,溶液中不可能有___ __ _存在。
(3)当溶液中有______和______的阳离子存在时,上述所有阴离子都不可能存在。CO32-、SO32-SO42-、CO32-、SO32Ba2+ Ag+3、在允许加热的条件下,只用一种试剂就可以鉴别硫酸铵、氯化钾、氯化镁和硫酸铁溶液,这种试剂是( ) A.NaOH? ????????? B.Na2CO3
C.AgNO3? ???????? D.BaCl2 A1.物质的量的浓度
定义 :单位物质的量的气体所占的体积
符号: C(B)
表达式:C(B)= n(B)/V(溶液)
单位:moL·L-1
其他公式:C=1000ρW/M
2.物质的量的浓度的配制:计算、称量(或量取)、溶解、转移、洗涤、定容、摇匀、装瓶贴签。
3 .稀释公式:C1V1=C2V23、 溶液的配制与分析1.1gNa2CO3练习
1.? 把49gH2SO4配成2L稀H2SO4,稀H2SO4物质的量浓度为多少?
2.? 在200mL稀盐酸中溶有0.73g氯化氢气体,求稀盐酸的物质的量浓度?
3.? 在标准状况下,11.2LNH3溶于水,配成400mL溶液,此氨水物质的量浓度为多少?
4.? 37%的盐酸,密度为1.19g/cm3,求其物质的量浓度?
5 .配制500mL0.2mol/L硝酸溶液,需要密度为1.4g/cm3的65%的硝酸多少毫升?
原子结构模型的演变第三单元
人类对原子结构的认识1、原子核外电子排布规律①?能量最低原理:先排K层,排满K层后再排L层.②每个电子层最多只能容纳2n2个电子。
③ 最外层最多只能容纳 8个电子(K层为最外层时不能超过2个)
次外层最多只能容纳18个电子(K层为次外层时不能超过2个
倒数第三层最多只能容纳32个电子注意:多条规律必须同时兼顾。 为了形象地表示原子的结构,人们就创造了“原子结构示意图”这种特殊的图形。+15第1层第2层第3层K层L层M层2852、原子结构示意图三、原子结构与元素性质的关系(结构决定性质) (1)稳定结构:即最外层为8电子的结构
(K层为2个)
特点:原子既不容易失去电子又不容易得到电子(如He、Ne、Ar等)(2)不稳定结构:(如,失去: Na、Mg、Al 得到:F、O、Cl)金属:最外层电子数﹤4时,容易失去电子非金属:最外层电子数≧4时,容易得到电子①金属最外层电子数﹤4时,易失去电子(化合价=+失去的电子数目)
= 最外层电子数)②非金属最外层电子数≥4时,易得到电子(化合价=-得到的电子数)
=最外层电子数-8)关系:元素化合价在数值上等于原子失去或得到的电子数目(失为正,得为负)最外层电子数与化合价的关系1.周期表中16号元素和4号元素的原子相比较,前者的下列数据是后者的4倍的是( )
A. 电子数 B. 最外层电子数 C.电子层数 D.次外层电子数
2.某元素原子核外第二层电子数是其他层电子数的2倍,则该元素的核电荷数为( )
A.6 B.8 C.12 D.20AC3.在核电荷数为1-20的元素的原子中,次外层电子数为最外层电子数的2倍的元素是( )
A.核电荷数为3的元素B.核电荷数为14的元素
C.核电荷数为6的元素D.核电荷数为16的元素 B⑵电性关系 ⑶质量关系:质量数(A)=质子数(Z)+中子数(N)⒉元素、核素、同位素原子:核电荷数(Z)=核内质子数=核外电子数
离子:核电荷数(Z)=核外电子数+电荷数(带+-)质子数决定元素的种类;中子数决定元素的同位素。(1)构成元素:具有相同质子数的同一类原子的总称。同位素:质子数相同而中子数不同的核素
互称为同位素核素:具有一定质子数和一定中子数的一种原子。三、元素、核素、同位素1.据报道,上海某医院正在研究用放射性的一
种碘 治疗肿瘤。该碘原子的核内的中子数与核外电子数之差是A、72 B、19 C、53 D、125B2.某二价阴离子,核外有18个电子,质量数为32,则其中子数为:A、12 B、14 C、16 D、18C【练习】再见
A.一定是一种单质 B.一定是纯净物
C.一定是混合物 D.可能是纯净物,也可能是混合物
D2.填表分析:只含一种元素,一定是单质而不是化合物,但可能是一种单质,如H2,为纯净物;也可能不是一种单质,而是两种单质的混合物,如金刚石和石墨,或O2和O3练习 (1)置换反应的规律与条件2、转化 (2)复分解反应的规律与条件氧化还原反应化合反应置换反应分解反应复分解反应单位 摩尔 ,符号为mol 。 * * 是表示含有一定数目微粒的集合体。{分子、原子、原子团、离子、电子、质子、中子等3、物质的量 * 是国际单位制七个基本物理量之一,表示物质含微粒集合体多少的。* *是一专有名词,由四个字组成 ,是一个整体,不能分割,也不可加字、减字。符号为n 问某物质的物质的量是多少?答:几摩尔我们把0.012kg12C中所含有的
碳原子数规定为1摩尔。规定:阿伏加德常数符号:NA数值:约为6.02×1023 。使用摩尔时,必须指明粒子(分子、原子、离子、质子、电子等)的种类。
公式: n=
【练习】
1.0.5 mol水中含有 个水分子。
2.2 mol水中含有 个水分子, 个氢原子。
3.1 mol H2SO4中含有 个H2SO4分子, 个硫酸根离子。
4.1 mol HCl溶于水,水中存在的溶质粒子是什么?它们的物质的量各是多少?
5.1个水分子中有 个电子,1 mol H2O中呢?定义:符号:g·mol-1单位:M摩尔质量单位物质的量的物质所具有的质量。数值:相对原子质量或相对分子质量练习 0.01 mol某物质的质量为1.08g,此物质的摩尔质量为 。108g.mol-1 483 g Na2SO4·10H2O中所含的Na+和SO42-的物质的量各是多少?所含H2O分子的数目是多少?
定义 :
符号:
表达式:Vm=
单位:
1、物质的聚集状态:
2、气体摩尔体积四、物质的聚集状态气态、液态和固态单位物质的量的气体所占的体积Vm在标准状况下,1 mol任何气体的体积
都约是22.4 L。L·mol-1物质
质量物质
的量微粒
数÷M×M×NA÷NA×22.4L/mol÷22.4L/mol[关系](标准状况)体积气体NaOH + HNO3 == NaNO3 + H2O [例1]完全中 和 0 .5 mol NaOH 需多少摩的 HNO3?其质量是多 少克?解: 答:完全中和0.5molNaOH需0.5mol HNO3 其质量为31.5g设需HNO3的物质的量为n。 n= 0.5 mol 1mol1moln0.5 molHNO3的摩尔质量为63 g/molm(HNO3)=nM= 0.5mol×63g/mol=31.5g因为所以“n” 用于化学方程式的计算1.分散系:一种(或几种)物质的微粒分散到另一种物质里形成的混合物。
(分散质、分散剂)
分类:溶液、 浊液、 胶体
2.胶体:
(1)概念:分散质微粒直径大小在10-9~10-7m之间的分散系。
(2)性质:丁达尔现象
3.溶液:电解质溶液、非电解质溶液(<1nm 1 ~100nm >100nm)五、物质的分散系4.化合物
电解质:在水溶液中或熔融的状态下能导电的化合物(酸、碱、盐、金属氧化物、水等)
非电解质:在水溶液中或熔融的状态下都不能导电的化合物(有机物、非金属氧化物(除水)、NH3等
5.电离方程式
NaCl == Na+ + Cl-
H2SO4 == 2H+ + SO42-
NaOH == Na+ + OH- 【2】、下列物质(1)能导电的是( )
(2)属于电解质的是( )
(3)属于非电解质的是( )
A.NaOH溶液 B.Cu C.液态HCl
D.液态CH3COOH E.蔗糖溶液 F.液氨 G.氨水H.CuSO4 I.石墨 J.无水乙醇ABGICDHFJ【1】 如何用简便的方法鉴别胶体和溶液呢?【3】、下列物质属于电解质的是 ( )
A.金属铁 B.食盐水 C.酒精 D.纯碱用丁达尔现象加以区别 D 【练习】§2.2 物质的检验 第二单元
研究物质的实验方法§2.1 物质的分离与提纯§2.3 溶液的配制与分析1、物质的分离与提纯【练习】
1.下列仪器常用于物质分离的是( )
①漏斗 ②试管 ③蒸馏烧瓶 ④天平 ⑤分液漏斗 ⑥研钵
A.①③④ B.①②⑥
C.①③⑤ D.①③⑥ 4.为了除去粗盐中Ca2+、Mg2+、SO42-
及泥沙,可将粗盐溶于水,然后进行下列五项操作。其中正确的操作顺序是( )
①过滤 ②加过量的NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液
A.①④②⑤③ B.④①②⑤③
C.②⑤④①③ D.⑤②④①③CDC含有K+透过蓝色钴玻璃观察到紫色在酒精灯火焰上灼烧K+(钾盐)含有SO42-生成白色沉淀、不溶解。加BaCl2溶液,再加稀HClSO42- (硫酸盐)有Cl-生成白色沉淀、不溶解。滴加AgNO3,再加稀硝酸Cl- (盐酸盐)含有NH4+。试纸变蓝。加浓的氢氧化钠、加热,用湿润的红色石蕊试纸放在 试管口NH4+ (铵盐)结论现象检验方法待检物质二、常见物质的检验法1.溶液中可能有下列阴离子中的一种或几种:SO42-、CO32-、SO32-、CL-
(1)当溶液中有大量H+存在时,则不可能有______ 存在。
(2)当溶液中有大量Ba2+存在时,溶液中不可能有___ __ _存在。
(3)当溶液中有______和______的阳离子存在时,上述所有阴离子都不可能存在。CO32-、SO32-SO42-、CO32-、SO32Ba2+ Ag+3、在允许加热的条件下,只用一种试剂就可以鉴别硫酸铵、氯化钾、氯化镁和硫酸铁溶液,这种试剂是( ) A.NaOH? ????????? B.Na2CO3
C.AgNO3? ???????? D.BaCl2 A1.物质的量的浓度
定义 :单位物质的量的气体所占的体积
符号: C(B)
表达式:C(B)= n(B)/V(溶液)
单位:moL·L-1
其他公式:C=1000ρW/M
2.物质的量的浓度的配制:计算、称量(或量取)、溶解、转移、洗涤、定容、摇匀、装瓶贴签。
3 .稀释公式:C1V1=C2V23、 溶液的配制与分析1.1gNa2CO3练习
1.? 把49gH2SO4配成2L稀H2SO4,稀H2SO4物质的量浓度为多少?
2.? 在200mL稀盐酸中溶有0.73g氯化氢气体,求稀盐酸的物质的量浓度?
3.? 在标准状况下,11.2LNH3溶于水,配成400mL溶液,此氨水物质的量浓度为多少?
4.? 37%的盐酸,密度为1.19g/cm3,求其物质的量浓度?
5 .配制500mL0.2mol/L硝酸溶液,需要密度为1.4g/cm3的65%的硝酸多少毫升?
原子结构模型的演变第三单元
人类对原子结构的认识1、原子核外电子排布规律①?能量最低原理:先排K层,排满K层后再排L层.②每个电子层最多只能容纳2n2个电子。
③ 最外层最多只能容纳 8个电子(K层为最外层时不能超过2个)
次外层最多只能容纳18个电子(K层为次外层时不能超过2个
倒数第三层最多只能容纳32个电子注意:多条规律必须同时兼顾。 为了形象地表示原子的结构,人们就创造了“原子结构示意图”这种特殊的图形。+15第1层第2层第3层K层L层M层2852、原子结构示意图三、原子结构与元素性质的关系(结构决定性质) (1)稳定结构:即最外层为8电子的结构
(K层为2个)
特点:原子既不容易失去电子又不容易得到电子(如He、Ne、Ar等)(2)不稳定结构:(如,失去: Na、Mg、Al 得到:F、O、Cl)金属:最外层电子数﹤4时,容易失去电子非金属:最外层电子数≧4时,容易得到电子①金属最外层电子数﹤4时,易失去电子(化合价=+失去的电子数目)
= 最外层电子数)②非金属最外层电子数≥4时,易得到电子(化合价=-得到的电子数)
=最外层电子数-8)关系:元素化合价在数值上等于原子失去或得到的电子数目(失为正,得为负)最外层电子数与化合价的关系1.周期表中16号元素和4号元素的原子相比较,前者的下列数据是后者的4倍的是( )
A. 电子数 B. 最外层电子数 C.电子层数 D.次外层电子数
2.某元素原子核外第二层电子数是其他层电子数的2倍,则该元素的核电荷数为( )
A.6 B.8 C.12 D.20AC3.在核电荷数为1-20的元素的原子中,次外层电子数为最外层电子数的2倍的元素是( )
A.核电荷数为3的元素B.核电荷数为14的元素
C.核电荷数为6的元素D.核电荷数为16的元素 B⑵电性关系 ⑶质量关系:质量数(A)=质子数(Z)+中子数(N)⒉元素、核素、同位素原子:核电荷数(Z)=核内质子数=核外电子数
离子:核电荷数(Z)=核外电子数+电荷数(带+-)质子数决定元素的种类;中子数决定元素的同位素。(1)构成元素:具有相同质子数的同一类原子的总称。同位素:质子数相同而中子数不同的核素
互称为同位素核素:具有一定质子数和一定中子数的一种原子。三、元素、核素、同位素1.据报道,上海某医院正在研究用放射性的一
种碘 治疗肿瘤。该碘原子的核内的中子数与核外电子数之差是A、72 B、19 C、53 D、125B2.某二价阴离子,核外有18个电子,质量数为32,则其中子数为:A、12 B、14 C、16 D、18C【练习】再见
