溶液的配制与分析(1)[上学期]
图片预览








文档简介
课件21张PPT。溶液的配置及分析赵霞如何定量溶液的浓与稀?V体积量取溶液的一般方法n 物质的量溶液中的化学反应,一般用物质的量来计算 请你设想一下,能否建立一个新的表示溶液组成的物理量,可直接联系溶液的体积V和溶质的 物质的量 n ?设想物质的量浓度单位体积溶液中所含溶质B的物质的量.
符号CB物质的量浓度和溶液的质量分数溶液的体积溶质的物质的量用于物质的量的计算单位体积溶液中所含溶质B的物质的量.符号CB
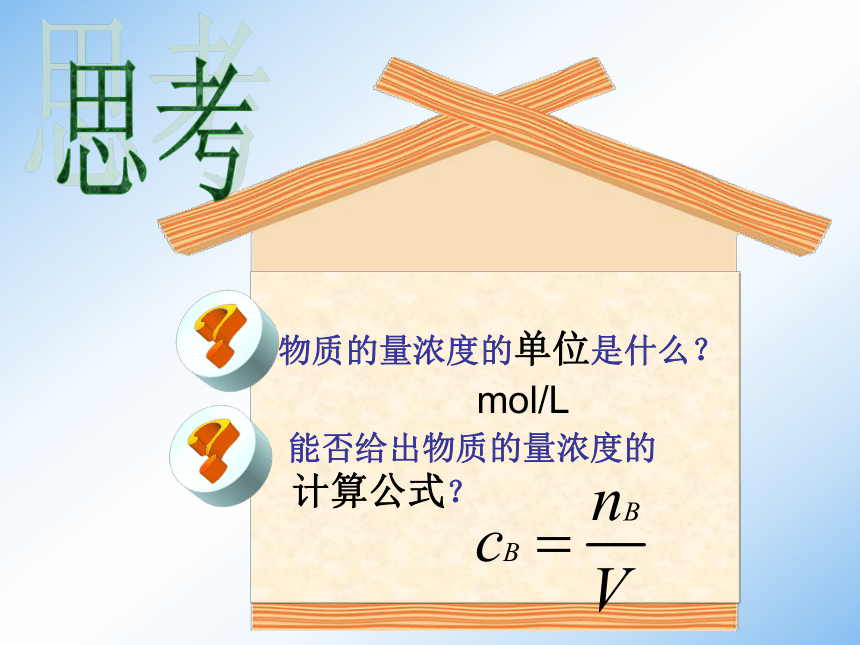
物质的量浓度的单位是什么?
能否给出物质的量浓度的 计算公式?思考mol/L例题1 将106 gNa2CO3溶解在水中,配成1.00L溶液,所得溶液中物质的量浓度是多少?解:答:所得溶液中物质的量浓度是1mol/L
A 将1gNaCl溶于水制成1L溶液 ,则C=1mol/L ;( )
判断B 将1molNaCl溶于1L水中,则C=1mol/L; ( ) V指的是溶液的体积,而不是溶剂的体积。这道题中应该是溶液的体积为1L,而不是溶剂的体积为1L时,溶液C=1mol/L。 因为溶液具有均一、稳定的特征,所以从一定物质的量浓度的溶液中取出任意体积的溶液,其浓度不变。所含溶质的质量(物质的量)因体积不同而不同。 从 1L 1 mol/L NaCl溶液中,分别取出 1mL、10mL 和 100mL 溶液,它们的物质的量浓度是否相等?所含溶质是否相等?物质的量浓度和溶液的质量分数或:g/ml⒈ 将6gNaOH溶于水配成250ml溶液,NaOH
的物质的量的浓度是多少?练习1解:答: NaOH 的物质的量的浓度是0.6mol/L⒉配置500ml0.1mol/L的NaCl溶液, 需NaCl的质量是多少?解:答:需NaCl的质量是2.925g关于溶液稀释的计算⒉ 配置100ml2mol/L的盐酸,需12mol/L的
盐酸多少毫升?练习2[小结] 解有关溶液稀释的问题,遵循的原则是:稀释前后溶质的量不变 .解:答:需12mol/L的盐酸16.7毫升10L1mol/L的酒精溶液和10L1mol/L的蔗糖溶液的溶质的微粒数目是否相等?为什么?10L1mol/L的NaCl溶液和10L1mol/L CaCl2溶液的溶质的微粒数目是否相等? 为什么?练习3一定物质量浓度溶液中溶质微粒数目下列溶液中Na+浓度最大的是( )
A.4L 0.5 mol·L-1 的NaCl 溶液
B.1L 0.3 mol·L-1 的Na2SO4溶液
C.0.8 L 0.4 mol·L-1 的NaOH溶液
D.2L 0.15 mol·L-1的Na3PO4溶液
选择B作业P25 第5题
P36 第12题解法一:
取100 g溶液来计算
m(H2SO4)=100 g×98%=98 g
n(H2SO4) =1 mol
V(液)=54.35 mL=0.05435 L
c(H2SO4)=18.4mol·L-1
答:98%的H2SO4溶液的物质的量浓 度为18.4 mol·L-1。附加题. 市售浓H2SO4中,溶质的质量分数为98%,密度为1.84 g·cm-3。计算市售浓H2SO4中, H2SO4的物质的量浓度。 解法二:
取1 L溶液来计算
V(液)=1 L
mH2SO4=V[ H2SO4 (aq)]·ρ·w
=1000 mL×1.84 g·cm-3×98%
=1083 g
n H2SO4 =18.4 mol
c H2SO4 =18.4 mol·L-1
答:98%的H2SO4溶液的物质的量浓度为18.4 mol·L-1。
符号CB物质的量浓度和溶液的质量分数溶液的体积溶质的物质的量用于物质的量的计算单位体积溶液中所含溶质B的物质的量.符号CB
物质的量浓度的单位是什么?
能否给出物质的量浓度的 计算公式?思考mol/L例题1 将106 gNa2CO3溶解在水中,配成1.00L溶液,所得溶液中物质的量浓度是多少?解:答:所得溶液中物质的量浓度是1mol/L
A 将1gNaCl溶于水制成1L溶液 ,则C=1mol/L ;( )
判断B 将1molNaCl溶于1L水中,则C=1mol/L; ( ) V指的是溶液的体积,而不是溶剂的体积。这道题中应该是溶液的体积为1L,而不是溶剂的体积为1L时,溶液C=1mol/L。 因为溶液具有均一、稳定的特征,所以从一定物质的量浓度的溶液中取出任意体积的溶液,其浓度不变。所含溶质的质量(物质的量)因体积不同而不同。 从 1L 1 mol/L NaCl溶液中,分别取出 1mL、10mL 和 100mL 溶液,它们的物质的量浓度是否相等?所含溶质是否相等?物质的量浓度和溶液的质量分数或:g/ml⒈ 将6gNaOH溶于水配成250ml溶液,NaOH
的物质的量的浓度是多少?练习1解:答: NaOH 的物质的量的浓度是0.6mol/L⒉配置500ml0.1mol/L的NaCl溶液, 需NaCl的质量是多少?解:答:需NaCl的质量是2.925g关于溶液稀释的计算⒉ 配置100ml2mol/L的盐酸,需12mol/L的
盐酸多少毫升?练习2[小结] 解有关溶液稀释的问题,遵循的原则是:稀释前后溶质的量不变 .解:答:需12mol/L的盐酸16.7毫升10L1mol/L的酒精溶液和10L1mol/L的蔗糖溶液的溶质的微粒数目是否相等?为什么?10L1mol/L的NaCl溶液和10L1mol/L CaCl2溶液的溶质的微粒数目是否相等? 为什么?练习3一定物质量浓度溶液中溶质微粒数目下列溶液中Na+浓度最大的是( )
A.4L 0.5 mol·L-1 的NaCl 溶液
B.1L 0.3 mol·L-1 的Na2SO4溶液
C.0.8 L 0.4 mol·L-1 的NaOH溶液
D.2L 0.15 mol·L-1的Na3PO4溶液
选择B作业P25 第5题
P36 第12题解法一:
取100 g溶液来计算
m(H2SO4)=100 g×98%=98 g
n(H2SO4) =1 mol
V(液)=54.35 mL=0.05435 L
c(H2SO4)=18.4mol·L-1
答:98%的H2SO4溶液的物质的量浓 度为18.4 mol·L-1。附加题. 市售浓H2SO4中,溶质的质量分数为98%,密度为1.84 g·cm-3。计算市售浓H2SO4中, H2SO4的物质的量浓度。 解法二:
取1 L溶液来计算
V(液)=1 L
mH2SO4=V[ H2SO4 (aq)]·ρ·w
=1000 mL×1.84 g·cm-3×98%
=1083 g
n H2SO4 =18.4 mol
c H2SO4 =18.4 mol·L-1
答:98%的H2SO4溶液的物质的量浓度为18.4 mol·L-1。
