常见物质的检验[上学期]
图片预览






文档简介
课件21张PPT。常 见 物 质 的 检 验依据物质的特殊性质和特征反应,选择适当的试剂和方法,准确观察反应中的明显现象,如颜色的变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等,进行判断。 1 区别硫酸铜溶液和氯化钠溶液(鉴别)
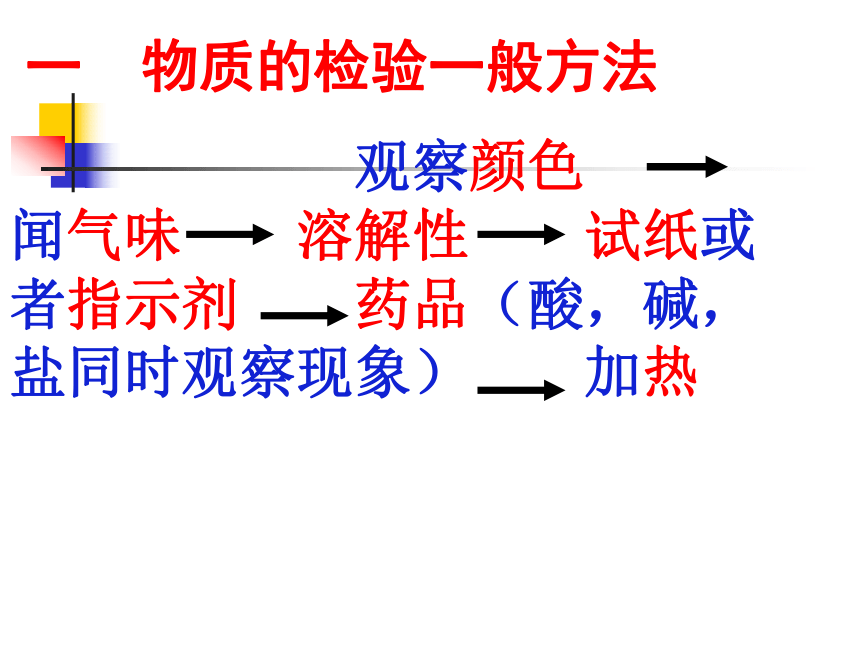
2 检验是否为硫酸铜溶液(鉴定) 一 物质的检验一般方法
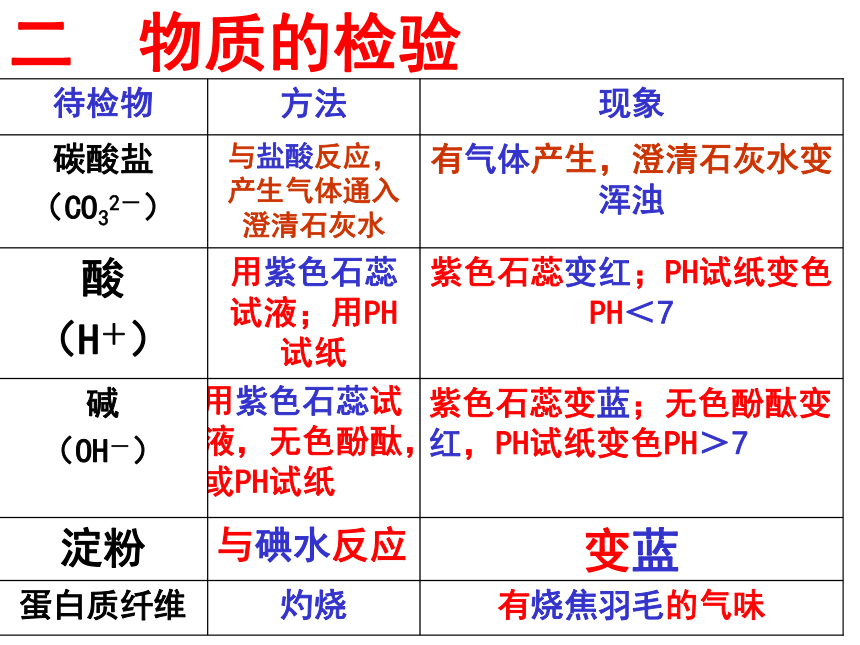
观察颜色 闻气味 溶解性 试纸或者指示剂 药品(酸,碱,盐同时观察现象) 加热2 常见检验物品⑴试纸类:PH试纸:红石蕊试纸:测定液体PH时不能先湿润石蕊试纸遇碱性物质变蓝蓝石蕊试纸:遇酸性物质变红(检验气体需先湿润)⑵试剂类:有烧焦羽毛的气味灼烧蛋白质纤维变蓝与碘水反应淀粉紫色石蕊变蓝;无色酚酞变红,PH试纸变色PH>7
用紫色石蕊试液,无色酚酞,或PH试纸碱
(OH-)紫色石蕊变红;PH试纸变色PH<7用紫色石蕊试液;用PH试纸酸
(H+)有气体产生,澄清石灰水变浑浊与盐酸反应,产生气体通入澄清石灰水碳酸盐
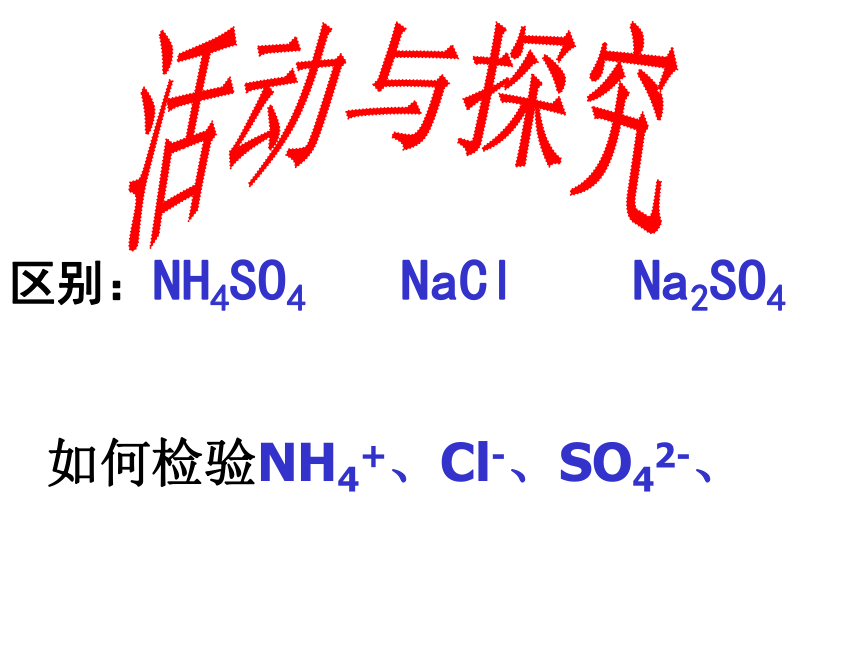
(CO32-)现象方法待检物二 物质的检验活动与探究如何检验NH4+、Cl-、SO42-、区别:NH4SO4 NaCl Na2SO4 取样(少量放在试管中)与碱混合加热,若有刺激性气味的气体产生,且该气体使湿润的红色石蕊试纸变蓝,证明该试样中含有NH4+。NH4+的检验(铵盐)实验原理:NH4Cl+NaOH==Na Cl +H2O +NH3↑ NH3 使湿润的红色石蕊试纸变___ 蓝 取样并向内加稀HNO3和AgNO3溶液,若生成白色沉淀,证明该试样中含有Cl- 。Cl-的检验(盐酸盐或称氯化物)
实验原理KCl+AgNO3==KNO3+AgCl↓
AgCl不溶于稀HNO3排除CO32-和SO32-的干扰取样并先加稀HCl、后Ba(NO3)2溶液,若生成白色沉淀,证明该样品中含有SO42- SO42-的检验(硫酸盐)
排除Ag+ 和CO32-和SO32-的干扰 实验原理
(NH4)2SO4 + BaCl2==BaSO4↓ + 2NH4Cl含有K+透过蓝色钴玻璃观察到紫色在酒精灯火焰上灼烧K+(钾盐)含有SO42-生成白色沉淀、不溶解。先加稀HCl酸化再加BaCl2溶液,SO42- (硫酸盐)有Cl-生成白色沉淀、不溶解。滴加AgNO3,再加稀硝酸Cl- (盐酸盐)含有NH4+。试纸变蓝。加氢氧化钠、共热,用湿润的红色石蕊试纸放在 试管口NH4+ (铵盐)结论现象检验方法待检物质二、物质的检验实验4怎么区别氯化钠和氯化钾?1金属或其化合物在灼烧时都会使火焰
呈现特殊的颜色,这个反应就叫做焰色反应。三、 焰色反应2检验金属或者金属离子的存在3注意点:⑴ 铂丝或细铁丝在使用前在稀盐酸中洗净,再酒精灯上灼烧至无色, 再使用!(除杂步骤:洗一次,烧一次,用一次)
⑵ 观察钾的焰色时要透过蓝色钴玻璃观察火焰颜色。记忆:口诀 红外光谱仪确定:物质中是否含有某些有机基团元素分析仪测定:物质中是否含C、H、O、N、S等元素四、 仪器分析法:原子吸收光谱确定:物质中是否含有哪些金属元素 现有一溶液中已知有铵根离子,氯离子,硫酸根离子存在,请思考:
(1)能否用氯化钡来检验硫酸根离子?为什么?如不能,则可改用什么试剂?
(2)你认为依次鉴定三种离子的顺序是什么?思考:1、以下是对某水溶液进行离子检验的方法和结论,其中正确的是( )
A、先加入BaCl2溶液,再加入足量的HNO3溶液,产生了白色沉淀,溶液中一定含有大量SO42-
B、加入足量的CaCl2溶液,产生了白色沉淀。溶液中一定含有大量 的CO32-
C、加入足量浓NaOH溶液,产生了带有强烈刺激性气味的气体。溶液中一定含有大量的NH4+
D、先加适量的盐酸将溶液酸化,再加入AgNO3溶液,产生了白色沉淀。溶液中一定含有大量的Cl-4C2、能用来区别BaCl2、NaCl、Na2CO3三种物质的
试剂是( )
A. AgNO3 B. 稀硫酸 C. 稀盐酸 D. 稀硝酸3、在允许加热的条件下,只用一种试剂就可以鉴别硫酸铵、氯化钾、氯化镁和硫酸铁溶液,这种试剂是( )
A.NaOH? ????????? B.Na2CO3
C.AgNO3? ???????? D.BaCl2 BA
A.某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐
B. 某溶液中滴加BaCl2溶液,生成白色沉淀,证明一定含有SO42-
C.某无色溶液滴入紫色石蕊试液显红色,该溶液一定是酸溶液
D.验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl-4、对下列实验过程的评价,正确的是D
2 检验是否为硫酸铜溶液(鉴定) 一 物质的检验一般方法
观察颜色 闻气味 溶解性 试纸或者指示剂 药品(酸,碱,盐同时观察现象) 加热2 常见检验物品⑴试纸类:PH试纸:红石蕊试纸:测定液体PH时不能先湿润石蕊试纸遇碱性物质变蓝蓝石蕊试纸:遇酸性物质变红(检验气体需先湿润)⑵试剂类:有烧焦羽毛的气味灼烧蛋白质纤维变蓝与碘水反应淀粉紫色石蕊变蓝;无色酚酞变红,PH试纸变色PH>7
用紫色石蕊试液,无色酚酞,或PH试纸碱
(OH-)紫色石蕊变红;PH试纸变色PH<7用紫色石蕊试液;用PH试纸酸
(H+)有气体产生,澄清石灰水变浑浊与盐酸反应,产生气体通入澄清石灰水碳酸盐
(CO32-)现象方法待检物二 物质的检验活动与探究如何检验NH4+、Cl-、SO42-、区别:NH4SO4 NaCl Na2SO4 取样(少量放在试管中)与碱混合加热,若有刺激性气味的气体产生,且该气体使湿润的红色石蕊试纸变蓝,证明该试样中含有NH4+。NH4+的检验(铵盐)实验原理:NH4Cl+NaOH==Na Cl +H2O +NH3↑ NH3 使湿润的红色石蕊试纸变___ 蓝 取样并向内加稀HNO3和AgNO3溶液,若生成白色沉淀,证明该试样中含有Cl- 。Cl-的检验(盐酸盐或称氯化物)
实验原理KCl+AgNO3==KNO3+AgCl↓
AgCl不溶于稀HNO3排除CO32-和SO32-的干扰取样并先加稀HCl、后Ba(NO3)2溶液,若生成白色沉淀,证明该样品中含有SO42- SO42-的检验(硫酸盐)
排除Ag+ 和CO32-和SO32-的干扰 实验原理
(NH4)2SO4 + BaCl2==BaSO4↓ + 2NH4Cl含有K+透过蓝色钴玻璃观察到紫色在酒精灯火焰上灼烧K+(钾盐)含有SO42-生成白色沉淀、不溶解。先加稀HCl酸化再加BaCl2溶液,SO42- (硫酸盐)有Cl-生成白色沉淀、不溶解。滴加AgNO3,再加稀硝酸Cl- (盐酸盐)含有NH4+。试纸变蓝。加氢氧化钠、共热,用湿润的红色石蕊试纸放在 试管口NH4+ (铵盐)结论现象检验方法待检物质二、物质的检验实验4怎么区别氯化钠和氯化钾?1金属或其化合物在灼烧时都会使火焰
呈现特殊的颜色,这个反应就叫做焰色反应。三、 焰色反应2检验金属或者金属离子的存在3注意点:⑴ 铂丝或细铁丝在使用前在稀盐酸中洗净,再酒精灯上灼烧至无色, 再使用!(除杂步骤:洗一次,烧一次,用一次)
⑵ 观察钾的焰色时要透过蓝色钴玻璃观察火焰颜色。记忆:口诀 红外光谱仪确定:物质中是否含有某些有机基团元素分析仪测定:物质中是否含C、H、O、N、S等元素四、 仪器分析法:原子吸收光谱确定:物质中是否含有哪些金属元素 现有一溶液中已知有铵根离子,氯离子,硫酸根离子存在,请思考:
(1)能否用氯化钡来检验硫酸根离子?为什么?如不能,则可改用什么试剂?
(2)你认为依次鉴定三种离子的顺序是什么?思考:1、以下是对某水溶液进行离子检验的方法和结论,其中正确的是( )
A、先加入BaCl2溶液,再加入足量的HNO3溶液,产生了白色沉淀,溶液中一定含有大量SO42-
B、加入足量的CaCl2溶液,产生了白色沉淀。溶液中一定含有大量 的CO32-
C、加入足量浓NaOH溶液,产生了带有强烈刺激性气味的气体。溶液中一定含有大量的NH4+
D、先加适量的盐酸将溶液酸化,再加入AgNO3溶液,产生了白色沉淀。溶液中一定含有大量的Cl-4C2、能用来区别BaCl2、NaCl、Na2CO3三种物质的
试剂是( )
A. AgNO3 B. 稀硫酸 C. 稀盐酸 D. 稀硝酸3、在允许加热的条件下,只用一种试剂就可以鉴别硫酸铵、氯化钾、氯化镁和硫酸铁溶液,这种试剂是( )
A.NaOH? ????????? B.Na2CO3
C.AgNO3? ???????? D.BaCl2 BA
A.某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐
B. 某溶液中滴加BaCl2溶液,生成白色沉淀,证明一定含有SO42-
C.某无色溶液滴入紫色石蕊试液显红色,该溶液一定是酸溶液
D.验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl-4、对下列实验过程的评价,正确的是D
