溶液的配制及分析分析[上学期]
图片预览








文档简介
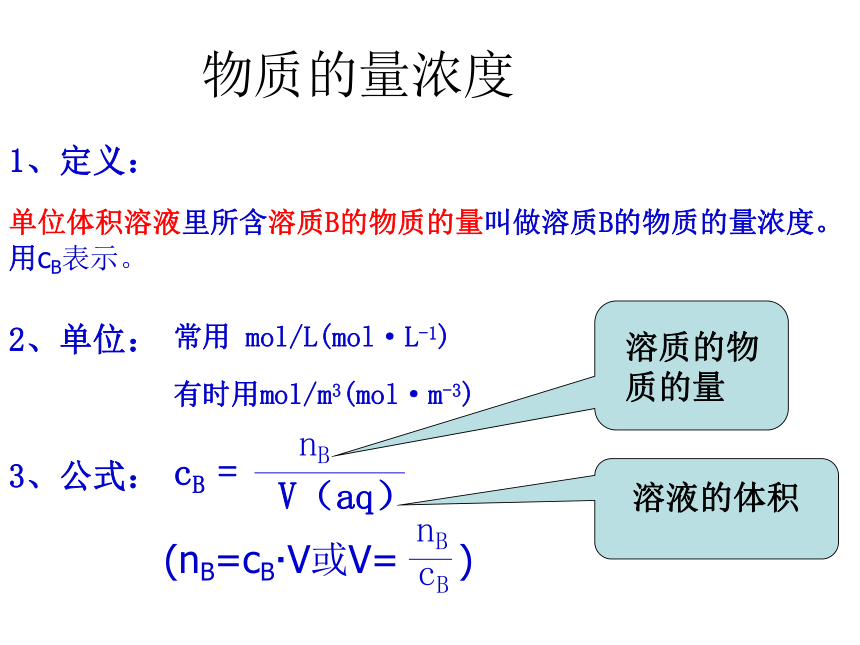
课件38张PPT。溶液的配制及分析 什么是溶液中溶质的质量分数?优点:1.配制简单。2. 溶液的质量-溶质的质量=溶剂的质量。缺点:1.称量液体的质量不如量体积方便。 2.描述反应物质间的量关系麻烦。质量分数(ω):溶质B的质量和溶液的质量之比物质的量浓度1、定义:单位体积溶液里所含溶质B的物质的量叫做溶质B的物质的量浓度。用cB表示。3、公式:2、单位:常用 mol/L(mol·L-1)有时用mol/m3(mol·m-3)讨 论 …1、将342g蔗糖(C12H22O11)溶解在1L水中,所得的溶液中溶质的物质的量浓度是否为1mol/L?结论1:溶液体积不等于溶剂体积。
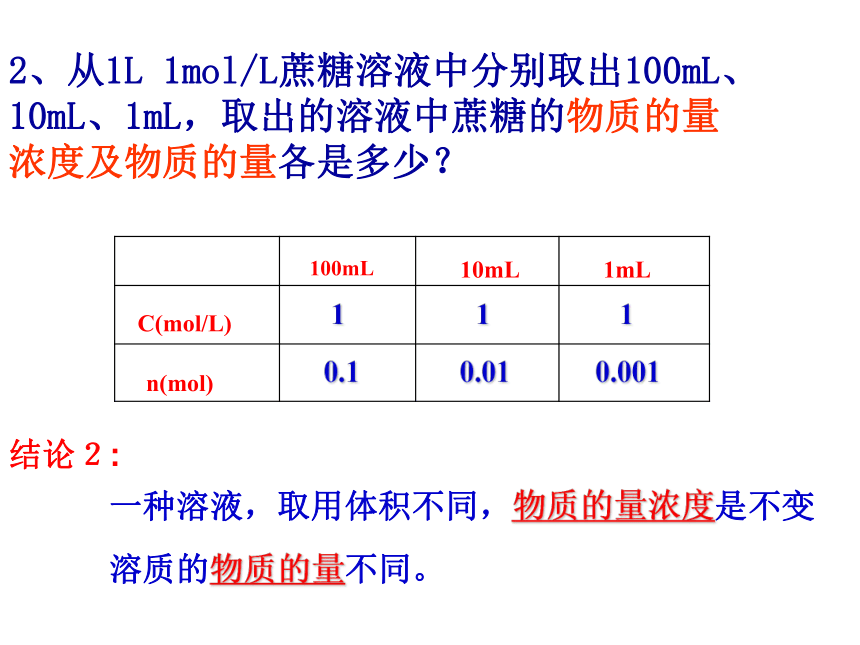
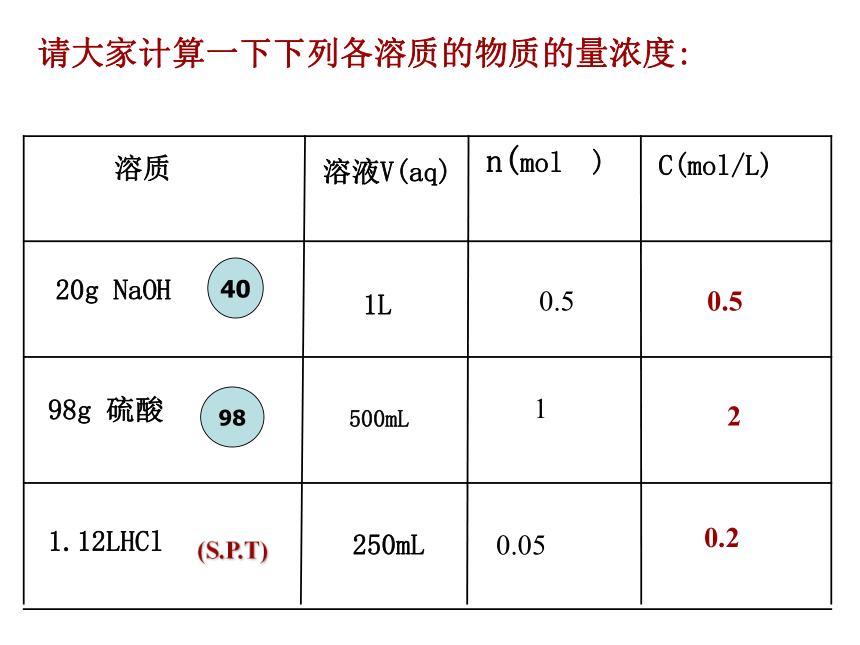
溶质溶于溶剂后,体积会发生变化。(否)2、从1L 1mol/L蔗糖溶液中分别取出100mL、10mL、1mL,取出的溶液中蔗糖的物质的量浓度及物质的量各是多少?1110.10.010.001溶质的物质的量不同。一种溶液,取用体积不同,物质的量浓度是不变结论2:1.基本量的换算请大家计算一下下列各溶质的物质的量浓度:0.520.20.510.05例1:将5.3gNa2CO3配成250mL溶液,求溶液的物质的量浓度。
解:n(Na2CO3) = m (Na2CO3) /M (Na2CO3)
= 5.3g/106g?mol-1 = 0.05molc (Na2CO3) = n (Na2CO3) /V[Na2CO3(aq)] = 0.05mol/0.25L= 0.2mol/L
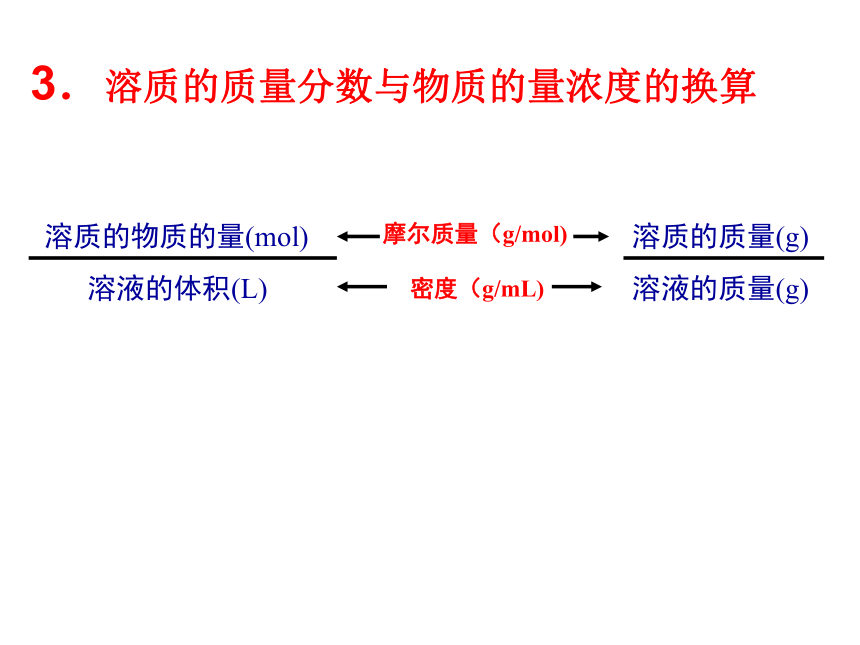
答:溶液的Na2CO3的物质的量浓度为0.2mol/L。(106)2.溶液中溶质微粒数目的计算 溶质的分子数必然也相同,但不能说所含微粒数也相同溶液体积相同,物质的量浓度相同,溶质的物质的量必然相同1、2L 1mol/L的H2SO4溶液,含溶质的物质的量为 mol,含H+ 个,SO42- 个。22.408×10241.204×10243.溶质的质量分数与物质的量浓度的换算
摩尔质量(g/mol) 密度(g/mL)例:某浓硝酸中溶质的质量分数为94%,密度为1.5g/cm3。计算该浓硝酸中HNO3的物质的量浓度。
解:设有1000ml硝酸溶液,则m(HNO3) =ρ[HNO3(aq)]·V[HNO3(aq)]·ω(HNO3)
= 1.5g/cm3×1000cm3×94% =1410g
n(HNO3) = m(HNO3)/M(HNO3) =1410g/63g·mol-1
= 22.4mol
答:该硝酸中HNO3的物质的量浓度为22.4mol/L思路:C = n / V 例:2mol/LNaOH溶液(ρ=1.08g/cm3) 的溶质的质量分数为:解:设有1L NaOH溶液,则m(NaOH) = 2mol/L×1L×40g/mol = 80g
m[NaOH(aq)]=1.08g/cm3×1000cm3= 1080g
ω[NaOH(aq)] = 80g/1080g×100% = 7.4%
答:该溶液溶质的质量分数为7.4%思路: ω = m B /m(aq ) 4.有关溶液稀释和浓缩的计算
思路:稀溶液前后溶质的物质的量相等
结论:浓溶液配制稀溶液前后溶质的量不变
C1V1= C2V2 1。将10毫升2 mol/L的硫酸溶液加水稀释到0.5mol/L,其体积为多少毫升?
解:10mL×2mol/L=V[H2SO4(aq)]×0.5mol/L
2。20%的蔗糖(C12H22O11)溶液342克稀释到1升,其物质的量浓度将是多少?
解:342×20%÷342=1L×C(蔗)
3。配制500mL1 mol/L的H2SO4溶液,需要密度为1.836g/mL的浓硫酸(98%硫酸)多少毫升?
解: 0.5×1=V×1.836×98%÷985.有关两种不同浓度溶液混合的计算
C3V3 = C1V1+C2V2
(混合前后溶质的物质的量总和不变)2 mol/L的盐酸溶液200L和4 mol/L的盐酸溶液100L混合,求:混合后溶液中盐酸的物质的量浓度。假定混合后液体体积不变。
2 mol/L的盐酸200L和4 mol/L的硫酸100L混合,则混合后溶液中H+的物质的量浓度是多少?假定混合后液体体积不变。 C混×(0.2+0.1)=2×0.2+4×0.1C(H+)×(0.2+0.1)=2×0.2+4×2×0.13、某同学用以下溶质配制一种混合液,己知溶液中:C(K+)
= C(Cl-) = 1/2 C(Na+) = C (SO42-),则其溶质可能为:
A、KCl Na2SO4
B、NaCl K2SO4
C、 NaCl Na2SO4 K2SO4
D、 KCl Na2SO4 K2SO4
AC4、下列溶液中的Cl-浓度与50 ml 1mol/l氯化铝溶液中的Cl-浓度
相等的是:
A、150 ml 1mol/L 氯化钠溶液
B、75 ml 2mol/l 氯化铵溶液
C、150 ml 1mol/l 氯化钾溶液
D、75 ml 1mol/l 氯化铝溶液D 1、中和1升0.5 mol/LNaOH溶液,需要多少升 1mol/LH2SO4溶液?
6.有关溶液反应的计算 解: 2NaOH~~~~H2SO4
2mol 1mol
1L×0.5mol/L V[H2SO4(aq)]×1mol/L2、将铜片放入0.1mol/l的FeCl3溶液中,反应一定的时间后取出
铜片,溶液中C(Fe3+):C(Fe2+)=2:3,则Cu2+与Fe3+的物质的量
之比为:
A、3:2
B、3:5
C、4:3
D、3:4D4、在100克浓度为18mol/L,密度为ρ的浓硫酸中加入一定量的
水稀释成9mol/l的硫酸,则加入水的体积为:
A、小于100ml
B、等于100ml
C、大于100ml
D、等于100/ ρ mlA5、将50ml C(H+)=0.1mol/L的硫酸和盐酸组成的混合物溶液
与50ml氢氧化钡溶液混合,充分反应过滤得0.466g沉淀,假如此
时的滤液为100ml,测得滤液的C(OH-)=0.1mol/L。
求:(1)原混合溶液中SO42-、Cl-的物质的量。
(2) 50ml氢氧化钡溶液的物质的量浓度。0.002mol 0.001mol 0.15mol/L6、在某温度下,无水硫酸钠的溶解度为S g,若在该温度下
取2S无水硫酸钠放入100g水中,将析出晶体全部取出,再将
此晶体制成该温度下的饱和溶液,则需加水的质量为:
A、200g
B、100g
C、50g
D、无法计算B7、在标准状况下,将 22.4L HCl气体溶于635ml水中,所得
盐酸的密度为1.18g/ml 。试计算:
(1)、取出这种盐酸10ml,稀释至1.45L,所得稀盐酸的物质
的量浓度。
(2)、在40ml 0.065mol/LNa2CO3溶液中,逐滴加入(1)所
配制的稀盐酸,边滴边振荡,若使反应不产生CO2气体,加入稀
盐酸的体积最多不超过多少ml?0.0814mol/L,31.9ml8、图是医院病人输液时用的一种质量分数为5%的葡萄糖(C6H12O6)注射液标签。请认真观察标签上所列的内容后
填写:
(1)、该溶液中含水————克
(2)、该溶液的密度约为————g/ml
(3)、该溶液的物质的量浓度为——————mol/L
葡萄糖注射液
Gluccse Injection
规格:250ml内含葡萄糖12.5g
生产批号:0503203
有效期:至2006年3月237.5 1 5/18小结:一、物质的量浓度
二、有关物质的量浓度的计算1.基本量的换算
2.在物质的量浓度溶液中溶质微粒数目的计算
3.溶液中溶质的质量分数与物质的量浓度的换算
4.有关溶液稀释和浓缩的计算
5.有关两种不同浓度溶液混合的计算
6.有关溶液反应的计算÷MM ××NANA ÷× V×Vm÷Vm 总结:m、V、N、n、cB之间的关系:÷V(溶液体积)一定物质的量浓度溶液 的配制实验名称:配制一定物质的量浓度的溶液
实验目的:配制100 mL 1 mol·L-1的
NaCl溶液。实验原理:CB=nB/V容量瓶的使用① 容量瓶的容积固定,有不同规格:
(100mL、 250mL、500mL、1000mL等)。③使用前须检验容量瓶是否漏水。④容量瓶不能用于溶解物质及长时间保存溶液。② 容量瓶上标有温度、容积、刻度线 1、计算m(NaCl) = n(NaCl)·M(NaCl)
= c(NaCl)×V [NaCl(aq)]×M(NaCl)
= 1 mol·L-1×0.1 L×58.5 g·mol-1
= 5.9 g 实验步骤:2、称量复习天平使用方法:
归零、调平衡,称质量,归零。注意:左物右码,从大到小取用砝码3.溶解 -------静置,恢复室温实验步骤:4.转移 —— 要用玻璃棒引流(注意在溶解或稀释时有明显的热量变化,就必须待溶液温度恢复到室温才能向容量瓶中转移)5.洗涤 —— 少量多次6.定容 —— 距刻线1~2cm时改用胶头滴管7.摇匀实验步骤:8.贴标签或将溶液转移到试剂瓶实验仪器: 天平、药匙、烧杯、玻璃棒、
100 mL容量瓶、胶头滴管量筒配制100mL 1mol/L CuSO4 溶液,
下列方法正确的是( )练习:D1.称量时,物体与砝码的位置颠倒。二、误差分析:C=n/V用到游码时偏低无影响偏低偏低2.容量瓶内壁存有水珠,未干燥。3.定容时仰视读数。4.未用蒸馏水洗涤烧杯内壁。5.溶质溶解后,没有恢复至室温即转移。误差分析:放热的偏高,吸热的偏低量得溶液体积少,偏低若直接称药品,则偏高;
若用差量法称药品,则可能无影响;6.用量筒量取液体时,俯视读数。8.天平的砝码沾有其他物质或已生锈。7.摇匀后发现液面低于刻线,再补加水到刻线。
溶质溶于溶剂后,体积会发生变化。(否)2、从1L 1mol/L蔗糖溶液中分别取出100mL、10mL、1mL,取出的溶液中蔗糖的物质的量浓度及物质的量各是多少?1110.10.010.001溶质的物质的量不同。一种溶液,取用体积不同,物质的量浓度是不变结论2:1.基本量的换算请大家计算一下下列各溶质的物质的量浓度:0.520.20.510.05例1:将5.3gNa2CO3配成250mL溶液,求溶液的物质的量浓度。
解:n(Na2CO3) = m (Na2CO3) /M (Na2CO3)
= 5.3g/106g?mol-1 = 0.05molc (Na2CO3) = n (Na2CO3) /V[Na2CO3(aq)] = 0.05mol/0.25L= 0.2mol/L
答:溶液的Na2CO3的物质的量浓度为0.2mol/L。(106)2.溶液中溶质微粒数目的计算 溶质的分子数必然也相同,但不能说所含微粒数也相同溶液体积相同,物质的量浓度相同,溶质的物质的量必然相同1、2L 1mol/L的H2SO4溶液,含溶质的物质的量为 mol,含H+ 个,SO42- 个。22.408×10241.204×10243.溶质的质量分数与物质的量浓度的换算
摩尔质量(g/mol) 密度(g/mL)例:某浓硝酸中溶质的质量分数为94%,密度为1.5g/cm3。计算该浓硝酸中HNO3的物质的量浓度。
解:设有1000ml硝酸溶液,则m(HNO3) =ρ[HNO3(aq)]·V[HNO3(aq)]·ω(HNO3)
= 1.5g/cm3×1000cm3×94% =1410g
n(HNO3) = m(HNO3)/M(HNO3) =1410g/63g·mol-1
= 22.4mol
答:该硝酸中HNO3的物质的量浓度为22.4mol/L思路:C = n / V 例:2mol/LNaOH溶液(ρ=1.08g/cm3) 的溶质的质量分数为:解:设有1L NaOH溶液,则m(NaOH) = 2mol/L×1L×40g/mol = 80g
m[NaOH(aq)]=1.08g/cm3×1000cm3= 1080g
ω[NaOH(aq)] = 80g/1080g×100% = 7.4%
答:该溶液溶质的质量分数为7.4%思路: ω = m B /m(aq ) 4.有关溶液稀释和浓缩的计算
思路:稀溶液前后溶质的物质的量相等
结论:浓溶液配制稀溶液前后溶质的量不变
C1V1= C2V2 1。将10毫升2 mol/L的硫酸溶液加水稀释到0.5mol/L,其体积为多少毫升?
解:10mL×2mol/L=V[H2SO4(aq)]×0.5mol/L
2。20%的蔗糖(C12H22O11)溶液342克稀释到1升,其物质的量浓度将是多少?
解:342×20%÷342=1L×C(蔗)
3。配制500mL1 mol/L的H2SO4溶液,需要密度为1.836g/mL的浓硫酸(98%硫酸)多少毫升?
解: 0.5×1=V×1.836×98%÷985.有关两种不同浓度溶液混合的计算
C3V3 = C1V1+C2V2
(混合前后溶质的物质的量总和不变)2 mol/L的盐酸溶液200L和4 mol/L的盐酸溶液100L混合,求:混合后溶液中盐酸的物质的量浓度。假定混合后液体体积不变。
2 mol/L的盐酸200L和4 mol/L的硫酸100L混合,则混合后溶液中H+的物质的量浓度是多少?假定混合后液体体积不变。 C混×(0.2+0.1)=2×0.2+4×0.1C(H+)×(0.2+0.1)=2×0.2+4×2×0.13、某同学用以下溶质配制一种混合液,己知溶液中:C(K+)
= C(Cl-) = 1/2 C(Na+) = C (SO42-),则其溶质可能为:
A、KCl Na2SO4
B、NaCl K2SO4
C、 NaCl Na2SO4 K2SO4
D、 KCl Na2SO4 K2SO4
AC4、下列溶液中的Cl-浓度与50 ml 1mol/l氯化铝溶液中的Cl-浓度
相等的是:
A、150 ml 1mol/L 氯化钠溶液
B、75 ml 2mol/l 氯化铵溶液
C、150 ml 1mol/l 氯化钾溶液
D、75 ml 1mol/l 氯化铝溶液D 1、中和1升0.5 mol/LNaOH溶液,需要多少升 1mol/LH2SO4溶液?
6.有关溶液反应的计算 解: 2NaOH~~~~H2SO4
2mol 1mol
1L×0.5mol/L V[H2SO4(aq)]×1mol/L2、将铜片放入0.1mol/l的FeCl3溶液中,反应一定的时间后取出
铜片,溶液中C(Fe3+):C(Fe2+)=2:3,则Cu2+与Fe3+的物质的量
之比为:
A、3:2
B、3:5
C、4:3
D、3:4D4、在100克浓度为18mol/L,密度为ρ的浓硫酸中加入一定量的
水稀释成9mol/l的硫酸,则加入水的体积为:
A、小于100ml
B、等于100ml
C、大于100ml
D、等于100/ ρ mlA5、将50ml C(H+)=0.1mol/L的硫酸和盐酸组成的混合物溶液
与50ml氢氧化钡溶液混合,充分反应过滤得0.466g沉淀,假如此
时的滤液为100ml,测得滤液的C(OH-)=0.1mol/L。
求:(1)原混合溶液中SO42-、Cl-的物质的量。
(2) 50ml氢氧化钡溶液的物质的量浓度。0.002mol 0.001mol 0.15mol/L6、在某温度下,无水硫酸钠的溶解度为S g,若在该温度下
取2S无水硫酸钠放入100g水中,将析出晶体全部取出,再将
此晶体制成该温度下的饱和溶液,则需加水的质量为:
A、200g
B、100g
C、50g
D、无法计算B7、在标准状况下,将 22.4L HCl气体溶于635ml水中,所得
盐酸的密度为1.18g/ml 。试计算:
(1)、取出这种盐酸10ml,稀释至1.45L,所得稀盐酸的物质
的量浓度。
(2)、在40ml 0.065mol/LNa2CO3溶液中,逐滴加入(1)所
配制的稀盐酸,边滴边振荡,若使反应不产生CO2气体,加入稀
盐酸的体积最多不超过多少ml?0.0814mol/L,31.9ml8、图是医院病人输液时用的一种质量分数为5%的葡萄糖(C6H12O6)注射液标签。请认真观察标签上所列的内容后
填写:
(1)、该溶液中含水————克
(2)、该溶液的密度约为————g/ml
(3)、该溶液的物质的量浓度为——————mol/L
葡萄糖注射液
Gluccse Injection
规格:250ml内含葡萄糖12.5g
生产批号:0503203
有效期:至2006年3月237.5 1 5/18小结:一、物质的量浓度
二、有关物质的量浓度的计算1.基本量的换算
2.在物质的量浓度溶液中溶质微粒数目的计算
3.溶液中溶质的质量分数与物质的量浓度的换算
4.有关溶液稀释和浓缩的计算
5.有关两种不同浓度溶液混合的计算
6.有关溶液反应的计算÷MM ××NANA ÷× V×Vm÷Vm 总结:m、V、N、n、cB之间的关系:÷V(溶液体积)一定物质的量浓度溶液 的配制实验名称:配制一定物质的量浓度的溶液
实验目的:配制100 mL 1 mol·L-1的
NaCl溶液。实验原理:CB=nB/V容量瓶的使用① 容量瓶的容积固定,有不同规格:
(100mL、 250mL、500mL、1000mL等)。③使用前须检验容量瓶是否漏水。④容量瓶不能用于溶解物质及长时间保存溶液。② 容量瓶上标有温度、容积、刻度线 1、计算m(NaCl) = n(NaCl)·M(NaCl)
= c(NaCl)×V [NaCl(aq)]×M(NaCl)
= 1 mol·L-1×0.1 L×58.5 g·mol-1
= 5.9 g 实验步骤:2、称量复习天平使用方法:
归零、调平衡,称质量,归零。注意:左物右码,从大到小取用砝码3.溶解 -------静置,恢复室温实验步骤:4.转移 —— 要用玻璃棒引流(注意在溶解或稀释时有明显的热量变化,就必须待溶液温度恢复到室温才能向容量瓶中转移)5.洗涤 —— 少量多次6.定容 —— 距刻线1~2cm时改用胶头滴管7.摇匀实验步骤:8.贴标签或将溶液转移到试剂瓶实验仪器: 天平、药匙、烧杯、玻璃棒、
100 mL容量瓶、胶头滴管量筒配制100mL 1mol/L CuSO4 溶液,
下列方法正确的是( )练习:D1.称量时,物体与砝码的位置颠倒。二、误差分析:C=n/V用到游码时偏低无影响偏低偏低2.容量瓶内壁存有水珠,未干燥。3.定容时仰视读数。4.未用蒸馏水洗涤烧杯内壁。5.溶质溶解后,没有恢复至室温即转移。误差分析:放热的偏高,吸热的偏低量得溶液体积少,偏低若直接称药品,则偏高;
若用差量法称药品,则可能无影响;6.用量筒量取液体时,俯视读数。8.天平的砝码沾有其他物质或已生锈。7.摇匀后发现液面低于刻线,再补加水到刻线。
