溶液的配制及分析(第一课时)[上学期]
图片预览






文档简介
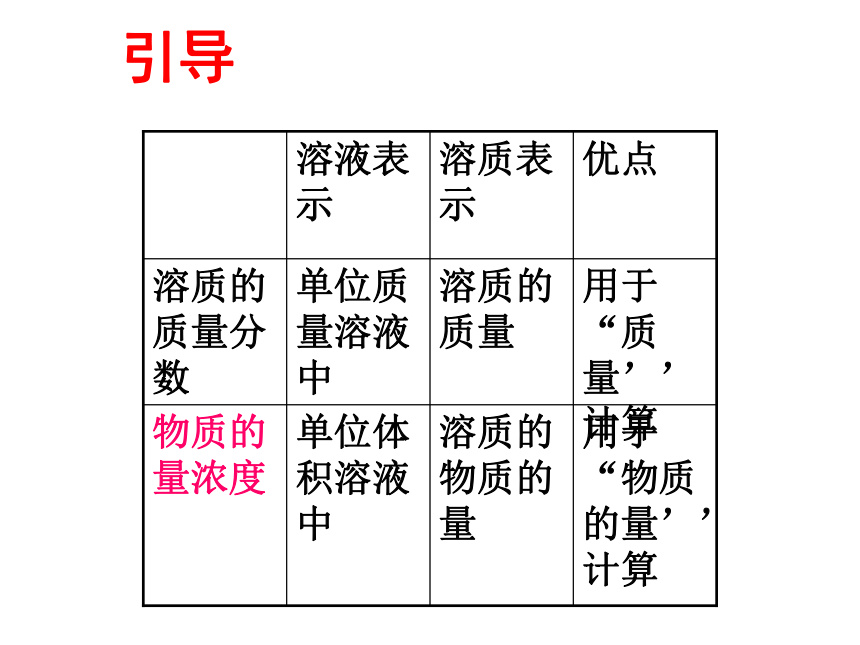
课件15张PPT。溶液的配制及分析 什么是溶液中溶质的质量分数?优点:1.配制容易。2.知道溶液的质量就可以算出溶质的质量。缺点:1.称量液体的质量不如量体积方便。 2.发生反应的各物质间的质量关系要比它们的物质的量关系要复杂得多。质量分数(ω):一定质量溶液中所含溶质的质量(既溶质B的质量和溶液的质量之比)复习:溶液浓度 怎样建立一个表示溶液组成的物理量?要求能够用此物理量进行“V(溶液)” 、 “ n(溶质)”之间的换算用于“物质的量’’计算溶质的物质的量单位体积溶液中
物质的量浓度用于“质量’’计算溶质的质量单位质量溶液中溶质的质量分数优点溶质表示溶液表示引导一、物质的量浓度1、定义:以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的量浓度。3、单位:常用 mol/L(mol·L-1)2、符号:用cB表示例1:将106gNa2CO3配成1.00L溶液,求溶液的物质的量浓度。
解:n(Na2CO3) = m (Na2CO3) /M (Na2CO3)
= 106g/106g?mol-1 = 1molc (Na2CO3) = n (Na2CO3) /V[Na2CO3(aq)] = 1mol/1L= 1mol/L
答:溶液的Na2CO3的物质的量浓度为1mol/L。(106)一、物质的量浓度1、定义:以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的量浓度。用cB表示。3、公式:2、单位:常用 mol/L(mol·L-1)例2:配制250mL1.6mol/LNaCl溶液,需要NaCl的质量是多少?
解:n(NaCl) = C(NaCl)·V[NaCl(aq)]
= 1.6mol/L×0.25L = 0.4mol
m(NaCl)=n(NaCl)·M(NaCl)
=0.4mol×58.5g/mol = 23.4g
答:需要NaCl的质量为23.4g。
500mL请大家计算一下下列各溶质的物质的量浓度:0.52250.20.5210.50.054098看教材P24页例3
思考问题解决2.生产过氧化氢的化工厂检验科分析人员需要测定生产车间出来的产品过氧化氢溶液的浓度:已知化学反应:
2KMnO4+3H2SO4+5H2O2==
K2SO4+2MnSO4+5O2+8H2O
当在过氧化氢溶液中滴加高锰酸钾至红色不再褪去时两者恰好完全反应。取过氧化氢样品1mL于锥形瓶中,加25mL水稀释,在用硫酸酸化,逐滴滴加0.1000mol/L的高锰酸钾溶液,当反应完全时,消耗高锰酸钾溶液20.00mL。计算过氧化氢样品的物质的量浓度。问题解决解:
2KMnO4+3H2SO4+ 5H2O2=K2SO4+2MnSO4+5O2+8H2O
2mol 5mol
0.1mol/L × 0.0202L CH2O2×0.001L
答:H2O2的物质的量浓度为5.05mol/L1、从1L 1mol/L蔗糖溶液中分别取出100mL、10mL、1mL,取出的溶液中蔗糖的物质的量浓度及物质的量各是多少?1110.10.010.001结论:溶液是均一的,对于一定物质的量浓度的溶液,不论取用它的体积多少,溶液中溶质的物质的量浓度是不变的。但是在不同体积的溶液中,溶质的物质的量不同。讨 论 …2、10L1mol/L蔗糖溶液与10L1mol/L酒精所含溶质的微粒数目是否相等,为什么? 10L1mol/LNaCl溶液与10L1mol/LCaCl2所含溶质的微粒数目是否相等,为什么? 3、下列溶液中Na浓度最大的是
A、4L0.5 10L1mol/LNaCl溶液
B、1L 0.3mol/LNa2SO溶液
C、0.8L0.4mol/LNa0H溶液
D、2L0.15mol/LNa3PO4溶液一、物质的量浓度1、定义:以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的量浓度。用cB表示。3、公式:2、单位:常用 mol/L(mol·L-1)小结
物质的量浓度用于“质量’’计算溶质的质量单位质量溶液中溶质的质量分数优点溶质表示溶液表示引导一、物质的量浓度1、定义:以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的量浓度。3、单位:常用 mol/L(mol·L-1)2、符号:用cB表示例1:将106gNa2CO3配成1.00L溶液,求溶液的物质的量浓度。
解:n(Na2CO3) = m (Na2CO3) /M (Na2CO3)
= 106g/106g?mol-1 = 1molc (Na2CO3) = n (Na2CO3) /V[Na2CO3(aq)] = 1mol/1L= 1mol/L
答:溶液的Na2CO3的物质的量浓度为1mol/L。(106)一、物质的量浓度1、定义:以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的量浓度。用cB表示。3、公式:2、单位:常用 mol/L(mol·L-1)例2:配制250mL1.6mol/LNaCl溶液,需要NaCl的质量是多少?
解:n(NaCl) = C(NaCl)·V[NaCl(aq)]
= 1.6mol/L×0.25L = 0.4mol
m(NaCl)=n(NaCl)·M(NaCl)
=0.4mol×58.5g/mol = 23.4g
答:需要NaCl的质量为23.4g。
500mL请大家计算一下下列各溶质的物质的量浓度:0.52250.20.5210.50.054098看教材P24页例3
思考问题解决2.生产过氧化氢的化工厂检验科分析人员需要测定生产车间出来的产品过氧化氢溶液的浓度:已知化学反应:
2KMnO4+3H2SO4+5H2O2==
K2SO4+2MnSO4+5O2+8H2O
当在过氧化氢溶液中滴加高锰酸钾至红色不再褪去时两者恰好完全反应。取过氧化氢样品1mL于锥形瓶中,加25mL水稀释,在用硫酸酸化,逐滴滴加0.1000mol/L的高锰酸钾溶液,当反应完全时,消耗高锰酸钾溶液20.00mL。计算过氧化氢样品的物质的量浓度。问题解决解:
2KMnO4+3H2SO4+ 5H2O2=K2SO4+2MnSO4+5O2+8H2O
2mol 5mol
0.1mol/L × 0.0202L CH2O2×0.001L
答:H2O2的物质的量浓度为5.05mol/L1、从1L 1mol/L蔗糖溶液中分别取出100mL、10mL、1mL,取出的溶液中蔗糖的物质的量浓度及物质的量各是多少?1110.10.010.001结论:溶液是均一的,对于一定物质的量浓度的溶液,不论取用它的体积多少,溶液中溶质的物质的量浓度是不变的。但是在不同体积的溶液中,溶质的物质的量不同。讨 论 …2、10L1mol/L蔗糖溶液与10L1mol/L酒精所含溶质的微粒数目是否相等,为什么? 10L1mol/LNaCl溶液与10L1mol/LCaCl2所含溶质的微粒数目是否相等,为什么? 3、下列溶液中Na浓度最大的是
A、4L0.5 10L1mol/LNaCl溶液
B、1L 0.3mol/LNa2SO溶液
C、0.8L0.4mol/LNa0H溶液
D、2L0.15mol/LNa3PO4溶液一、物质的量浓度1、定义:以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的量浓度。用cB表示。3、公式:2、单位:常用 mol/L(mol·L-1)小结
