初中化学内容体系[上学期]
图片预览







文档简介
课件23张PPT。 初中自然科学(化学部分)
知 识 体 系
桥头中学 俞华英一、化学基本概念和基本理论
二、常见元素及其化合物
三、化学计算
四、化学实验一、化学基本概念和基本理论
?(一)物质的组成
(宏观) (微观) 分 子
元素 物质 原 子
组成 构成 离 子
?
酸:H2SO4、、 HCl、H2S等
由分子构成的物质 非金属氧化物:CO2、SO2等
非金属单质:O2 、 N2、H2、等等
?
金属单质:Cu、Fe、Mg等等
由原子构成的物质 某些非金属单质:C、Si等等
稀有气体:He、Ne、Ar等等
碱:NaOH、KOH、Ba(OH)2等等
由离子构成的物质
大多数盐:NaCl、NH4NO3等等
1 、分子与原子的区别、联系
2 、元素和原子的区别、联系
3 、元素的状态(二)原子结构
原子核 质子:每1个质子带1个单位正电荷
1.原子的构成 中子:不带电
核外电子: 每一个电子带1个单位负电荷
重要关系式:
(1)质子数决定元素种类:质子数相同的一类原子即为同种元素。
(2)核电荷数=质子数
(3)对原子而言,质子数=核外电子数。
(4)相对原子质量= 质子数+中子数 2.原子结构示意图: Na 2)8)1)
3.原子结构与元素性质的关系
(1)最外层电子数决定元素的化学性质
金属元素1—3(H除外)
(2)根据最外层电子数把元素分成三类 非金属元素4—7
稀有气体8(Ne为2)
+11
初步介绍了原子
核外电子排布规律Na+ 2)8)+11
Mg 2)8)2) +12
可溶性盐:含Na+、K+、NH4+、NO3-的盐
不溶性盐:CaCO3、AgCl、BaSO4物质纯净物单质化合物无机化合物混合物:空气、海水等有机化合物:CH4、C2H5OH、CH3OH氧化物盐金 属:Mg、Fe、Al
非金属:C、O2、P碱性氧化物:Fe2O3、CuO、CaO
酸性氧化物:CO2、SO2、SO3酸按是否含氧按电离产生的H+个数
含氧酸:H2SO4、HNO3
无氧酸:HCl、H2S
一元酸:HCl、HNO3
二元酸:H2SO4、H2SO3
三元酸:H3PO4碱按溶解性
可溶性碱:NaOH、Ba(OH)2
微溶性碱:Ca(OH)2
不溶性碱:Fe(OH)3、Cu(OH)2按中和程度
正 盐:NaCl、CuSO4
酸式盐:NaHSO4、NaHCO3
碱式盐:Cu2(OH)2CO3
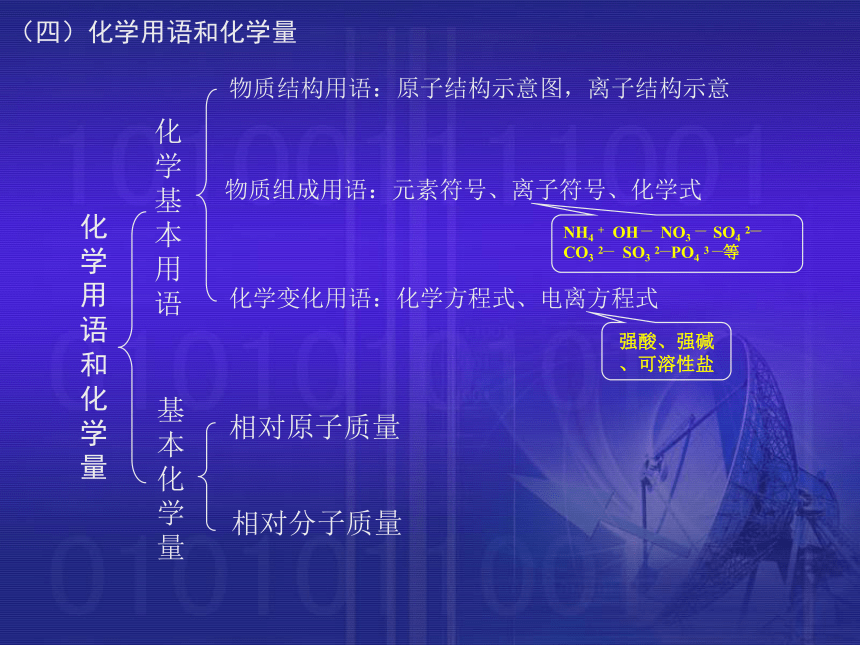
按溶解性(三)物质的分类化学用语和化学量化学基本用语基本化学量物质结构用语:原子结构示意图,离子结构示意物质组成用语:元素符号、离子符号、化学式化学变化用语:化学方程式、电离方程式相对原子质量相对分子质量(四)化学用语和化学量NH4 + OH — NO3 — SO4 2—
CO3 2— SO3 2—PO4 3 —等
强酸、强碱、可溶性盐物质的变化物理变化化学变化四种基本类型是否属于氧
化还原反应氧化还原反应非氧化还原反应化合反应分解反应复分解反应置换反应物质夺取氧的反应属于氧化反应,物质失去氧的反应的属于还原反应。
提供氧的物质具有氧化性,具有氧化性的物质叫做氧化剂。
从其他物质中夺取氧并与之结合的能力叫做还原性,具有还原性的物质叫做还原剂。(五 )物质的变化2、不饱和溶液与饱和溶液不饱和溶液3、溶解性与溶解度①加溶质②蒸发溶剂③降低温度①加溶剂②升高温度饱和溶液蒸发溶剂降低温度结晶结晶溶质溶剂
本身性质外界条件温度(压强)溶解性溶解度决定因素(定性)(定量)定义溶质溶剂
温度(压强)溶解度曲线溶质 溶解度
溶剂 100 =(六)溶 液1、溶液的特征和组成影响因素表示方法计算方法氧气(O2)物理性质1、通常状况下是无色无味的气体
2、标准状况下的密度为1.429g/L
3、不易溶于水化学性质
(比较活泼)1、跟金属的反应
2、跟非金属的反应
3、跟某些化合物的反应用途:用于医疗、炼制、炼钢、登山、潜水、气焊等制法工业制法:分离液态空气制氧气(物理变化)实
验
室
制
法反应原理:2KClO3======2KCl+3O2↑MnO2△ 2KMnO4======K2MnO4+MnO2+O2↑△装置:略收集
方法验满方法:用带火星的木条接近集气瓶口部,
若重新燃烧,证明已收集满。排水集气法(因为氧气不易溶于水)
向上排空气集气法(因为氧气的密度比空气的大)二、常见元素及其化合物水(H2O)水的组成水
的
性
质化
学
性
质宏观:水是由氢元素和氧元素组成
微观:水是由分子构成,每个水分子是由两个
氢原子和一个氧原子构成。物理
性质1、通常状况下是无色无味的液体
2、在大气压为1.01×105Pa时,水的沸点为100℃,凝固点0 ℃
3、4 ℃的密度最大,为1g/cm3。水结冰时体积膨胀,冰的密度比水小1、水通电能分解:2H2O====2H2↑+O2 ↑
2、水跟某些碱性氧化物反应生成碱,如:
CaO+H2O====Ca(OH)2
3、水跟酸性碱性氧化物(除SiO2外)反应生成酸,如:
CO2+H2O====H2CO3
4、水跟某些化合物结合,可生成结晶水合物,如:
CuSO4+5H2O====CuSO4·5H2O
(白色固体) (蓝色晶体)
5、水跟某些金属反应,如:
3Fe+4H2O(气)=====Fe3O4+4H2
2Na+2H2O=====2NaOH+H ↑高温氢气化
学
性
质物理
性质1、通常状况下是无色无味的气体
2、在标准状况下氢气的密度为0.0899g/L。仅为空气密度的1/14
3、难溶于水1、有可燃性:2H2+O2====2H2O
2、有还原性:CuO+H2====Cu+H2O
用途:充灌节日气球和探空气球;冶炼金属;理想的高能燃料
(H2)点燃△制
法工业
制法电解水法:2H2O====2H2↑+O2 ↑
水煤气法: H2O+C==== CO + H2
高温实
验
室
制
法反应原理:Zn+H2SO4====ZnSO4+H2 ↑
Fe+2HCl====FeCl2+H2 ↑
发生装备:略
收集方法:向下排空气集气法
排水集气法
通电碳物
理
性
质化
学
性
质天然存在单质有金刚石和石墨,它们物理性质不同。如金刚石是天然存在的最硬的物质,而石墨很软;金刚石不导电,而石黑却是电的良导体。……造成他们的物理性质不同的根本原因是:金刚石和石墨里碳原子的排列不同。(1)稳定性:常温下碳的化学性质不活泼的。碳受日光照射或跟水、空气接触都不容易起变化。
(2)可燃性:C+O2====CO2(充分燃烧)
2C+O2====2CO(不充分燃烧)
(3)还原性:2 CuO+O2====2Cu+CO2↑
CO2+C====2CO (C)点燃点燃高温高温CCOCO2H2CO3CaCO3O2O2CH2O△Ca(OH)2HCl一氧化碳物
理
性
质化
学
性
质(1)通常状况下是无色无味的液体。
(2)标准状况下CO的密度为1.25g/L,比空气的小
(3)难溶于水(1)可燃性:2CO+O2====2CO2
(2)还原性:CuO+CO====Cu+CO2
(CO)点燃有剧毒!CO跟血红蛋白的结合能力比氧气强,因此吸入较多量的CO时,就会使人因缺氧而死亡。△二氧化碳(CO2)物理性质1、通常状况下是无色无味的气体
2、标准状况下CO2的密度为1.977g/L,约是空气的1.5倍。
3、能溶于水化
学
性
质
用途:CO2可以用来灭火;固体CO2俗称干冰,可用作致冷剂;植物光合作用
需要CO2,在温室里可施用CO2,提高绿色植物光合作用。制
法工业制法:高温煅烧石灰石的副产品是CO2实
验
室
制
法反应原理:CaCO3+2HCl=====CaCl2+H2O+CO2↑发生装置:同氢气收集方法:只能用向上排空气集气法验满方法:用燃着的木条放进集气瓶口,若熄灭,证明已
收集满了。药品:石灰石或大理石(其主要成分是CaCO3),稀盐酸(1)三不能:不能供给呼吸、不能燃烧、一般情况下也不能支持燃烧。
(2)三 能:能跟水反应生成碳酸:CO2+H2O====H2CO3
能使澄清的石灰水变浑:CO2+Ca(OH)2====CaCO3↓+H2O
能被碳在高温条件下还原成CO:CO2+C====2CO
高温几种常见的有机物甲烷
(CH4)乙醇(酒精)
(C2HO3H)物理性质化学性质:可燃
CH4+2O2=====CO2+2H2O (1)通常情况下是无色无味的气体
(2)标准状况下密度为0.75g/L,比空气的小
(3)难溶于水物理性质:无色、有刺激性气味的液体,易挥发。化学性质:可燃
C2H5OH+3O2=====2CO2+3H2O点燃点燃 醋酸
(CH3COOH) 无色、有强烈刺激性气味的液体,易溶于水。
无水醋酸在16.6℃时能凝结成外形似冰的晶体----冰醋酸。铁(Fe)物理性质1、纯净的铁是有银白色金属光泽的固体
2、具有良好的延性和展性、传热性和导电性
3、铁的密度为7.8g/cm3,熔点1535℃化
学
性
质
铁
合
金钢1、带温下在潮湿的空气中易生锈,发生缓慢氧化反应。
铁锈的主要成分是Fe2O3。
2、点燃,在纯氧中铁丝可以燃烧,3Fe+2O2====Fe3O4跟氧气
反应点燃在高温下跟水蒸气反应: 3Fe+4H2O====Fe3O4+4H2
跟硫、氯气的反应: Fe+S====FeS 2Fe+3Cl2====2FeCl3
能跟酸发生,置换反应生成亚铁盐和氢气:
Fe+H2SO4(稀)====FeSO4+H2↑ Fe+2HCl====FeCl2+H2↑
能跟某此盐溶液发生置换反应生亚铁盐和另一种金属,如:
Fe+CuSO4====FeSO4+Cu 高温△生铁:成分:铁碳合金,含碳量为2-4.3%
冶炼:原料:铁矿石、焦炭、石灰石、空气
原理:高温条件下,用CO从铁的氧化物中,把铁还原出来。
Fe2O3+3CO=====2Fe+3CO2
设备:高炉高温成分:铁碳合金,含碳量为2-4.3%
冶炼:原料:生铁、氧气
原理:高温条件下,用氧气或铁的氧化物把生铁中过量的碳和
杂质氧化而除去。
设备:平炉、转炉、电炉△根据化学式计算的有关题型1、计算物质式量
2、求某一元素相对原子质量
3、求化合物中各元素质量比
4、求化合物中某一元素质量分数
5、求化合物中某元素质量
6、已知化合物中某元素质量,求化合物质量
7、求混合物中某物质的纯度求原子个数比
确定合物中元素化合价三、化学计算根据化学方程式的计算题型1、有关求反应物或生成物质量的计算
2、含一定量杂质的反应物或生成物的计算
3、多步反应的计算溶解度
计 算溶质质
量分数
的计算利用溶解度公式计算
把不饱和溶液转变成饱和溶液的计算
饱和溶液中析出晶体或加入溶质的计算利用质量分数公式的简单计算
关于溶液的稀释、浓缩和配制的计算
关于溶解度与饱和溶液质量分数的综合计算溶液的计算综
合
计
算溶解度计算
溶质质量分数计算
多步反应的计算
根据化学方程式的计算实 验
基 本
操 作常用化学仪器的使用
药品的取用
物质的加热
浓硫酸的稀释四、化学实验气体(O2、H2、CO2)反应原理药品和装置、气密性检查
反应原理
收集和检验
干燥和除杂1、常用化学仪器的使用和实验基本操作2、几种气体的制取和净化过滤
结晶
蒸馏物理方法化学方法提纯物质检验鉴别:运用实验手段对物质
加以区别的过程。
鉴定:运用实验手段对某种
物质进行确认的过程。3、物质的检验和提纯实验设计实验的化学原理设计(科学性、安全性、可行性、简约性)
实验的药品和仪器确定
实验的操作步骤的制定
实验的现象观察描述,实验结论的分析4、实验设计谢 谢 大 家 !
二、常见元素及其化合物
三、化学计算
四、化学实验一、化学基本概念和基本理论
?(一)物质的组成
(宏观) (微观) 分 子
元素 物质 原 子
组成 构成 离 子
?
酸:H2SO4、、 HCl、H2S等
由分子构成的物质 非金属氧化物:CO2、SO2等
非金属单质:O2 、 N2、H2、等等
?
金属单质:Cu、Fe、Mg等等
由原子构成的物质 某些非金属单质:C、Si等等
稀有气体:He、Ne、Ar等等
碱:NaOH、KOH、Ba(OH)2等等
由离子构成的物质
大多数盐:NaCl、NH4NO3等等
1 、分子与原子的区别、联系
2 、元素和原子的区别、联系
3 、元素的状态(二)原子结构
原子核 质子:每1个质子带1个单位正电荷
1.原子的构成 中子:不带电
核外电子: 每一个电子带1个单位负电荷
重要关系式:
(1)质子数决定元素种类:质子数相同的一类原子即为同种元素。
(2)核电荷数=质子数
(3)对原子而言,质子数=核外电子数。
(4)相对原子质量= 质子数+中子数 2.原子结构示意图: Na 2)8)1)
3.原子结构与元素性质的关系
(1)最外层电子数决定元素的化学性质
金属元素1—3(H除外)
(2)根据最外层电子数把元素分成三类 非金属元素4—7
稀有气体8(Ne为2)
+11
初步介绍了原子
核外电子排布规律Na+ 2)8)+11
Mg 2)8)2) +12
可溶性盐:含Na+、K+、NH4+、NO3-的盐
不溶性盐:CaCO3、AgCl、BaSO4物质纯净物单质化合物无机化合物混合物:空气、海水等有机化合物:CH4、C2H5OH、CH3OH氧化物盐金 属:Mg、Fe、Al
非金属:C、O2、P碱性氧化物:Fe2O3、CuO、CaO
酸性氧化物:CO2、SO2、SO3酸按是否含氧按电离产生的H+个数
含氧酸:H2SO4、HNO3
无氧酸:HCl、H2S
一元酸:HCl、HNO3
二元酸:H2SO4、H2SO3
三元酸:H3PO4碱按溶解性
可溶性碱:NaOH、Ba(OH)2
微溶性碱:Ca(OH)2
不溶性碱:Fe(OH)3、Cu(OH)2按中和程度
正 盐:NaCl、CuSO4
酸式盐:NaHSO4、NaHCO3
碱式盐:Cu2(OH)2CO3
按溶解性(三)物质的分类化学用语和化学量化学基本用语基本化学量物质结构用语:原子结构示意图,离子结构示意物质组成用语:元素符号、离子符号、化学式化学变化用语:化学方程式、电离方程式相对原子质量相对分子质量(四)化学用语和化学量NH4 + OH — NO3 — SO4 2—
CO3 2— SO3 2—PO4 3 —等
强酸、强碱、可溶性盐物质的变化物理变化化学变化四种基本类型是否属于氧
化还原反应氧化还原反应非氧化还原反应化合反应分解反应复分解反应置换反应物质夺取氧的反应属于氧化反应,物质失去氧的反应的属于还原反应。
提供氧的物质具有氧化性,具有氧化性的物质叫做氧化剂。
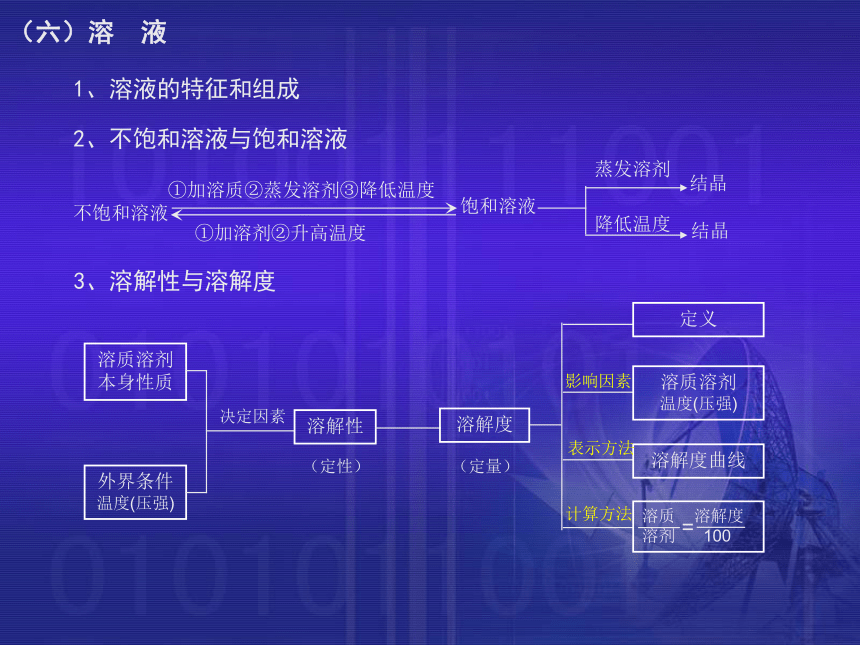
从其他物质中夺取氧并与之结合的能力叫做还原性,具有还原性的物质叫做还原剂。(五 )物质的变化2、不饱和溶液与饱和溶液不饱和溶液3、溶解性与溶解度①加溶质②蒸发溶剂③降低温度①加溶剂②升高温度饱和溶液蒸发溶剂降低温度结晶结晶溶质溶剂
本身性质外界条件温度(压强)溶解性溶解度决定因素(定性)(定量)定义溶质溶剂
温度(压强)溶解度曲线溶质 溶解度
溶剂 100 =(六)溶 液1、溶液的特征和组成影响因素表示方法计算方法氧气(O2)物理性质1、通常状况下是无色无味的气体
2、标准状况下的密度为1.429g/L
3、不易溶于水化学性质
(比较活泼)1、跟金属的反应
2、跟非金属的反应
3、跟某些化合物的反应用途:用于医疗、炼制、炼钢、登山、潜水、气焊等制法工业制法:分离液态空气制氧气(物理变化)实
验
室
制
法反应原理:2KClO3======2KCl+3O2↑MnO2△ 2KMnO4======K2MnO4+MnO2+O2↑△装置:略收集
方法验满方法:用带火星的木条接近集气瓶口部,
若重新燃烧,证明已收集满。排水集气法(因为氧气不易溶于水)
向上排空气集气法(因为氧气的密度比空气的大)二、常见元素及其化合物水(H2O)水的组成水
的
性
质化
学
性
质宏观:水是由氢元素和氧元素组成
微观:水是由分子构成,每个水分子是由两个
氢原子和一个氧原子构成。物理
性质1、通常状况下是无色无味的液体
2、在大气压为1.01×105Pa时,水的沸点为100℃,凝固点0 ℃
3、4 ℃的密度最大,为1g/cm3。水结冰时体积膨胀,冰的密度比水小1、水通电能分解:2H2O====2H2↑+O2 ↑
2、水跟某些碱性氧化物反应生成碱,如:
CaO+H2O====Ca(OH)2
3、水跟酸性碱性氧化物(除SiO2外)反应生成酸,如:
CO2+H2O====H2CO3
4、水跟某些化合物结合,可生成结晶水合物,如:
CuSO4+5H2O====CuSO4·5H2O
(白色固体) (蓝色晶体)
5、水跟某些金属反应,如:
3Fe+4H2O(气)=====Fe3O4+4H2
2Na+2H2O=====2NaOH+H ↑高温氢气化
学
性
质物理
性质1、通常状况下是无色无味的气体
2、在标准状况下氢气的密度为0.0899g/L。仅为空气密度的1/14
3、难溶于水1、有可燃性:2H2+O2====2H2O
2、有还原性:CuO+H2====Cu+H2O
用途:充灌节日气球和探空气球;冶炼金属;理想的高能燃料
(H2)点燃△制
法工业
制法电解水法:2H2O====2H2↑+O2 ↑
水煤气法: H2O+C==== CO + H2
高温实
验
室
制
法反应原理:Zn+H2SO4====ZnSO4+H2 ↑
Fe+2HCl====FeCl2+H2 ↑
发生装备:略
收集方法:向下排空气集气法
排水集气法
通电碳物
理
性
质化
学
性
质天然存在单质有金刚石和石墨,它们物理性质不同。如金刚石是天然存在的最硬的物质,而石墨很软;金刚石不导电,而石黑却是电的良导体。……造成他们的物理性质不同的根本原因是:金刚石和石墨里碳原子的排列不同。(1)稳定性:常温下碳的化学性质不活泼的。碳受日光照射或跟水、空气接触都不容易起变化。
(2)可燃性:C+O2====CO2(充分燃烧)
2C+O2====2CO(不充分燃烧)
(3)还原性:2 CuO+O2====2Cu+CO2↑
CO2+C====2CO (C)点燃点燃高温高温CCOCO2H2CO3CaCO3O2O2CH2O△Ca(OH)2HCl一氧化碳物
理
性
质化
学
性
质(1)通常状况下是无色无味的液体。
(2)标准状况下CO的密度为1.25g/L,比空气的小
(3)难溶于水(1)可燃性:2CO+O2====2CO2
(2)还原性:CuO+CO====Cu+CO2
(CO)点燃有剧毒!CO跟血红蛋白的结合能力比氧气强,因此吸入较多量的CO时,就会使人因缺氧而死亡。△二氧化碳(CO2)物理性质1、通常状况下是无色无味的气体
2、标准状况下CO2的密度为1.977g/L,约是空气的1.5倍。
3、能溶于水化
学
性
质
用途:CO2可以用来灭火;固体CO2俗称干冰,可用作致冷剂;植物光合作用
需要CO2,在温室里可施用CO2,提高绿色植物光合作用。制
法工业制法:高温煅烧石灰石的副产品是CO2实
验
室
制
法反应原理:CaCO3+2HCl=====CaCl2+H2O+CO2↑发生装置:同氢气收集方法:只能用向上排空气集气法验满方法:用燃着的木条放进集气瓶口,若熄灭,证明已
收集满了。药品:石灰石或大理石(其主要成分是CaCO3),稀盐酸(1)三不能:不能供给呼吸、不能燃烧、一般情况下也不能支持燃烧。
(2)三 能:能跟水反应生成碳酸:CO2+H2O====H2CO3
能使澄清的石灰水变浑:CO2+Ca(OH)2====CaCO3↓+H2O
能被碳在高温条件下还原成CO:CO2+C====2CO
高温几种常见的有机物甲烷
(CH4)乙醇(酒精)
(C2HO3H)物理性质化学性质:可燃
CH4+2O2=====CO2+2H2O (1)通常情况下是无色无味的气体
(2)标准状况下密度为0.75g/L,比空气的小
(3)难溶于水物理性质:无色、有刺激性气味的液体,易挥发。化学性质:可燃
C2H5OH+3O2=====2CO2+3H2O点燃点燃 醋酸
(CH3COOH) 无色、有强烈刺激性气味的液体,易溶于水。
无水醋酸在16.6℃时能凝结成外形似冰的晶体----冰醋酸。铁(Fe)物理性质1、纯净的铁是有银白色金属光泽的固体
2、具有良好的延性和展性、传热性和导电性
3、铁的密度为7.8g/cm3,熔点1535℃化
学
性
质
铁
合
金钢1、带温下在潮湿的空气中易生锈,发生缓慢氧化反应。
铁锈的主要成分是Fe2O3。
2、点燃,在纯氧中铁丝可以燃烧,3Fe+2O2====Fe3O4跟氧气
反应点燃在高温下跟水蒸气反应: 3Fe+4H2O====Fe3O4+4H2
跟硫、氯气的反应: Fe+S====FeS 2Fe+3Cl2====2FeCl3
能跟酸发生,置换反应生成亚铁盐和氢气:
Fe+H2SO4(稀)====FeSO4+H2↑ Fe+2HCl====FeCl2+H2↑
能跟某此盐溶液发生置换反应生亚铁盐和另一种金属,如:
Fe+CuSO4====FeSO4+Cu 高温△生铁:成分:铁碳合金,含碳量为2-4.3%
冶炼:原料:铁矿石、焦炭、石灰石、空气
原理:高温条件下,用CO从铁的氧化物中,把铁还原出来。
Fe2O3+3CO=====2Fe+3CO2
设备:高炉高温成分:铁碳合金,含碳量为2-4.3%
冶炼:原料:生铁、氧气
原理:高温条件下,用氧气或铁的氧化物把生铁中过量的碳和
杂质氧化而除去。
设备:平炉、转炉、电炉△根据化学式计算的有关题型1、计算物质式量
2、求某一元素相对原子质量
3、求化合物中各元素质量比
4、求化合物中某一元素质量分数
5、求化合物中某元素质量
6、已知化合物中某元素质量,求化合物质量
7、求混合物中某物质的纯度求原子个数比
确定合物中元素化合价三、化学计算根据化学方程式的计算题型1、有关求反应物或生成物质量的计算
2、含一定量杂质的反应物或生成物的计算
3、多步反应的计算溶解度
计 算溶质质
量分数
的计算利用溶解度公式计算
把不饱和溶液转变成饱和溶液的计算
饱和溶液中析出晶体或加入溶质的计算利用质量分数公式的简单计算
关于溶液的稀释、浓缩和配制的计算
关于溶解度与饱和溶液质量分数的综合计算溶液的计算综
合
计
算溶解度计算
溶质质量分数计算
多步反应的计算
根据化学方程式的计算实 验
基 本
操 作常用化学仪器的使用
药品的取用
物质的加热
浓硫酸的稀释四、化学实验气体(O2、H2、CO2)反应原理药品和装置、气密性检查
反应原理
收集和检验
干燥和除杂1、常用化学仪器的使用和实验基本操作2、几种气体的制取和净化过滤
结晶
蒸馏物理方法化学方法提纯物质检验鉴别:运用实验手段对物质
加以区别的过程。
鉴定:运用实验手段对某种
物质进行确认的过程。3、物质的检验和提纯实验设计实验的化学原理设计(科学性、安全性、可行性、简约性)
实验的药品和仪器确定
实验的操作步骤的制定
实验的现象观察描述,实验结论的分析4、实验设计谢 谢 大 家 !
