物质的分散系[上学期]
图片预览





文档简介
课件18张PPT。余姚二中 魏红 权物质的分散系一、分散系分散系:一种物质(或几种物质)以粒子形
式分散到另一种物质里所形成的混合物。水小油滴 水小土粒水Na+和Cl-分散成微粒的物质—分散质
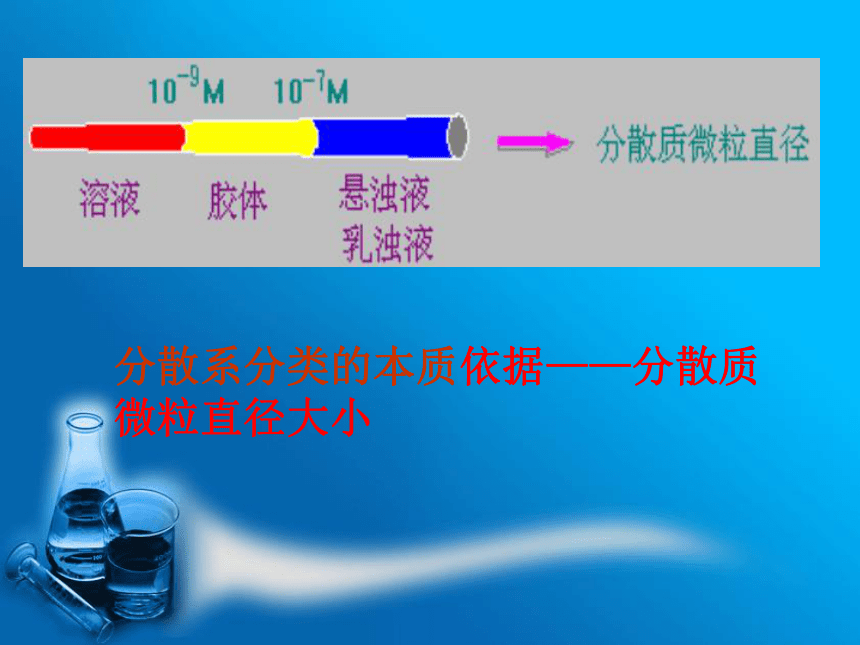
微粒分布在其中的物质—分散剂可见,不同的分散系取决于分散质微粒大小的不同分散质微粒的直径:
溶液: < 10-9m ;
悬浊液、乳浊液: > 10-7m 分散质微粒的直径大小在10-9-10-7m 之间的分散系叫做胶体分散系分类的本质依据——分散质微粒直径大小胶体不是一类物质,而是几乎任何物质都可能形成的一种分散状态。如:烟、云、雾 、淀粉溶液、蛋白质溶液、牛奶、豆浆、血液、墨水、有色玻璃、烟水晶等
NaCl溶于水形成溶液,如果分散在酒精中则可形成胶体。10-9--
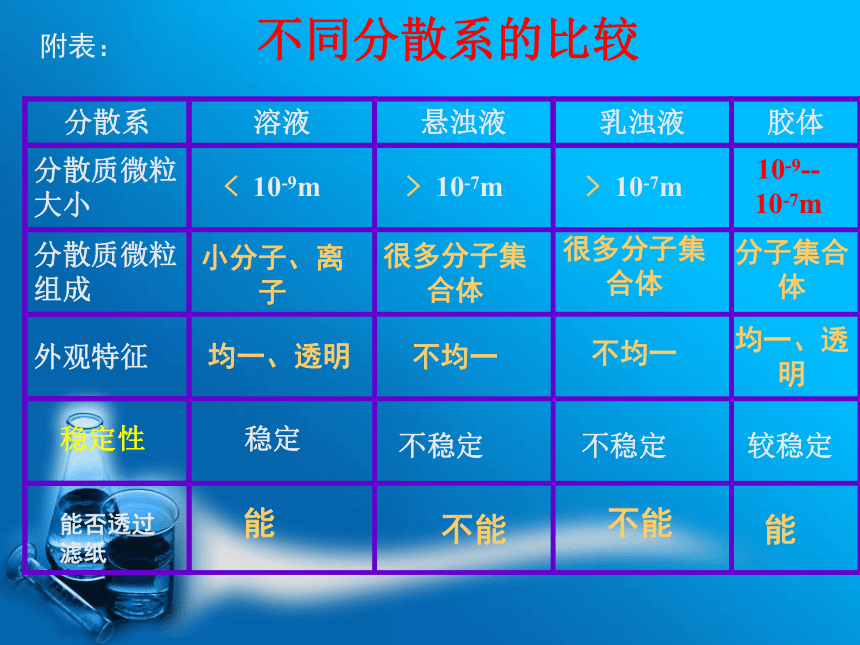
10-7m> 10-7m> 10-7m< 10-9m均一、透明不均一不均一均一、透明分子集合体很多分子集合体很多分子集合体小分子、离子不同分散系的比较 稳定性不稳定不稳定较稳定 稳定附表:能否透过滤纸
能能不能不能活动与探究1、胶体的性质和溶液有何不同?实验1:光束分别通过Fe(OH)3胶体和CuSO4溶液,观察现象。现象:一束光通过胶体时,从侧面可观察到胶体里
产生一条光亮的“通路”。胶体的特性:丁达尔效应活动与探究实验2:在两个烧杯中加入等量浑浊污水,向其中一只烧杯中加入10ml氢氧化铁胶体,搅拌后静置片刻,观察现象.现象:加入10ml氢氧化铁胶体的一只烧杯中,浑水 变澄清,并产生沉淀胶体有净水作用2 、根据对以上实验现象的分析,回答下列问题:
(1)如何用简便的方法鉴别胶体和溶液?
(2)氢氧化铁胶体有哪些应用?观察与思考实验:
在五只小烧杯中分别加入NaCl溶液、NaOH溶液、稀盐酸、酒精溶液和蔗糖溶液,分别按图1-10所示装置组装好仪器,接通电源。观察实验现象。实验现象 :NaCl、NaOH、HCl溶于水后能导电,酒精、蔗糖溶于水后不能导电。为什么有的化合物溶于水能导电,而有的化合物溶于水不能导电? NaCl溶解、电离 过程示意图在水溶液里或熔融状态下能导电的化合物叫做电解质
在水溶液里和熔融状态下均不能导电的化合物叫做
非电解质。三、电解质和非电解质电解质在水溶液中或熔融状态下产生自由移动的离子的过程称为电离电离方程式是表示酸、碱、盐等电解质在水溶液中或熔融状态下电离成能够自由移动的离子的式子 例如:
NaCl = Na+ + Cl-练习1:下列电离方程式书写不正确的是( )
A.Na2CO3 =2 Na++ CO32-
B.NaHSO4 = Na++H++SO42-
C.MgCl2 = Mg 2 ++ Cl2-
D.Ba(OH)2 =Ba2++2OH- 练习2:今有九种物质:①铝线 ②石墨 ③氯气 ④BaSO4晶体 ⑤纯硫酸 ⑥氨气 ⑦石灰水 ⑧乙醇 ⑨熔融的KNO3
其中能导电的是_______________,属于电解质的是___________,属于非电解质的___________,既不是电解质、又不是非电解质的是________。电解质和非电解质 在水溶液和熔融状态下都不能导电的化合物再 见!CuSO4溶液 Fe(OH)3胶体
式分散到另一种物质里所形成的混合物。水小油滴 水小土粒水Na+和Cl-分散成微粒的物质—分散质
微粒分布在其中的物质—分散剂可见,不同的分散系取决于分散质微粒大小的不同分散质微粒的直径:
溶液: < 10-9m ;
悬浊液、乳浊液: > 10-7m 分散质微粒的直径大小在10-9-10-7m 之间的分散系叫做胶体分散系分类的本质依据——分散质微粒直径大小胶体不是一类物质,而是几乎任何物质都可能形成的一种分散状态。如:烟、云、雾 、淀粉溶液、蛋白质溶液、牛奶、豆浆、血液、墨水、有色玻璃、烟水晶等
NaCl溶于水形成溶液,如果分散在酒精中则可形成胶体。10-9--
10-7m> 10-7m> 10-7m< 10-9m均一、透明不均一不均一均一、透明分子集合体很多分子集合体很多分子集合体小分子、离子不同分散系的比较 稳定性不稳定不稳定较稳定 稳定附表:能否透过滤纸
能能不能不能活动与探究1、胶体的性质和溶液有何不同?实验1:光束分别通过Fe(OH)3胶体和CuSO4溶液,观察现象。现象:一束光通过胶体时,从侧面可观察到胶体里
产生一条光亮的“通路”。胶体的特性:丁达尔效应活动与探究实验2:在两个烧杯中加入等量浑浊污水,向其中一只烧杯中加入10ml氢氧化铁胶体,搅拌后静置片刻,观察现象.现象:加入10ml氢氧化铁胶体的一只烧杯中,浑水 变澄清,并产生沉淀胶体有净水作用2 、根据对以上实验现象的分析,回答下列问题:
(1)如何用简便的方法鉴别胶体和溶液?
(2)氢氧化铁胶体有哪些应用?观察与思考实验:
在五只小烧杯中分别加入NaCl溶液、NaOH溶液、稀盐酸、酒精溶液和蔗糖溶液,分别按图1-10所示装置组装好仪器,接通电源。观察实验现象。实验现象 :NaCl、NaOH、HCl溶于水后能导电,酒精、蔗糖溶于水后不能导电。为什么有的化合物溶于水能导电,而有的化合物溶于水不能导电? NaCl溶解、电离 过程示意图在水溶液里或熔融状态下能导电的化合物叫做电解质
在水溶液里和熔融状态下均不能导电的化合物叫做
非电解质。三、电解质和非电解质电解质在水溶液中或熔融状态下产生自由移动的离子的过程称为电离电离方程式是表示酸、碱、盐等电解质在水溶液中或熔融状态下电离成能够自由移动的离子的式子 例如:
NaCl = Na+ + Cl-练习1:下列电离方程式书写不正确的是( )
A.Na2CO3 =2 Na++ CO32-
B.NaHSO4 = Na++H++SO42-
C.MgCl2 = Mg 2 ++ Cl2-
D.Ba(OH)2 =Ba2++2OH- 练习2:今有九种物质:①铝线 ②石墨 ③氯气 ④BaSO4晶体 ⑤纯硫酸 ⑥氨气 ⑦石灰水 ⑧乙醇 ⑨熔融的KNO3
其中能导电的是_______________,属于电解质的是___________,属于非电解质的___________,既不是电解质、又不是非电解质的是________。电解质和非电解质 在水溶液和熔融状态下都不能导电的化合物再 见!CuSO4溶液 Fe(OH)3胶体
