氮肥的生产和使用[上学期]
图片预览







文档简介
课件25张PPT。氮肥的生产和使用江苏省宿迁中学高一化学组科学家哈伯简介 弗里茨.哈泊:德国化学家,出生于一个犹太富商家中。1900年获得博士学位。1908年7月首次合成氨气,1909年7月建成每小时生产90克氨气的实验装置,1918年获得诺贝尔化学奖。
氨气的合成一方面使氮肥大量的工业化生产,提高了粮食的产量。另一方面氨氧化制得硝酸及TNT炸药。由于以上原因,德国才能将第一次 世界大战延续了几年。
哈伯首创了使用化学毒剂的化学战,在第一次世界大战中有130万人受到化学战的伤害,其中9万人死亡。一、氨的合成N2(g)+3H2(g) ? 2NH3(g)合成氨的条件:1.压强:20 MPa~50MPa
2.温度:500℃左右
3.催化剂:
铁触媒——以铁为主体的多成分催化剂。高温高压催化剂1、氨气的物理性质:
(1) 氨是一种无色、有刺激性气味的气体;
(2)极易溶于水(1:700),水溶液叫“氨水”;
(3)氨易液化→“液氨”,常作致冷剂。
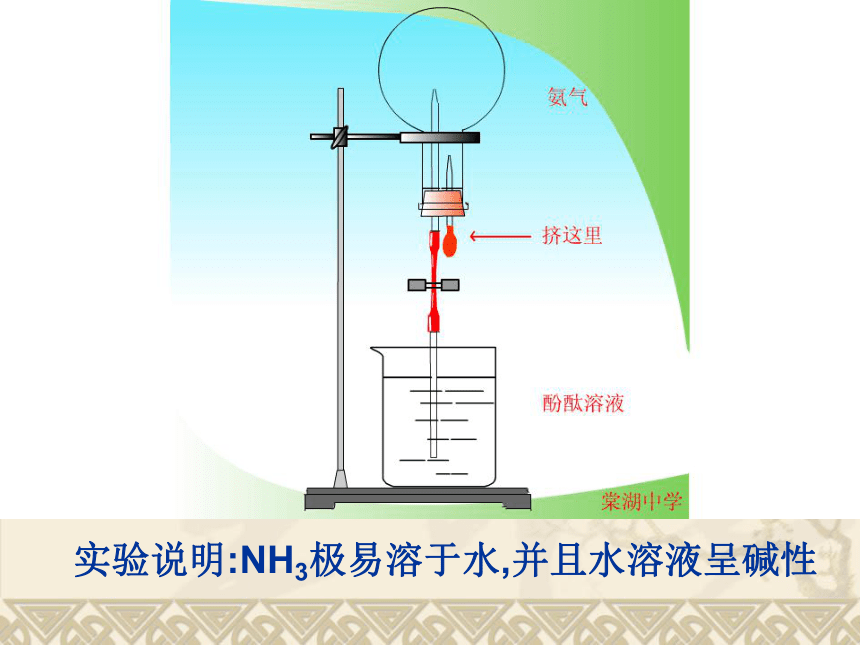
二、氨气的性质实验说明:NH3极易溶于水,并且水溶液呈碱性前面学过的气体SO2和Cl2,在水中溶解度不大,那么它们能不能也设计出喷泉实验呀?如能,需要什么样的试剂?你能设计出一个蓝色的喷泉实验来吗?知识
迁移1知识
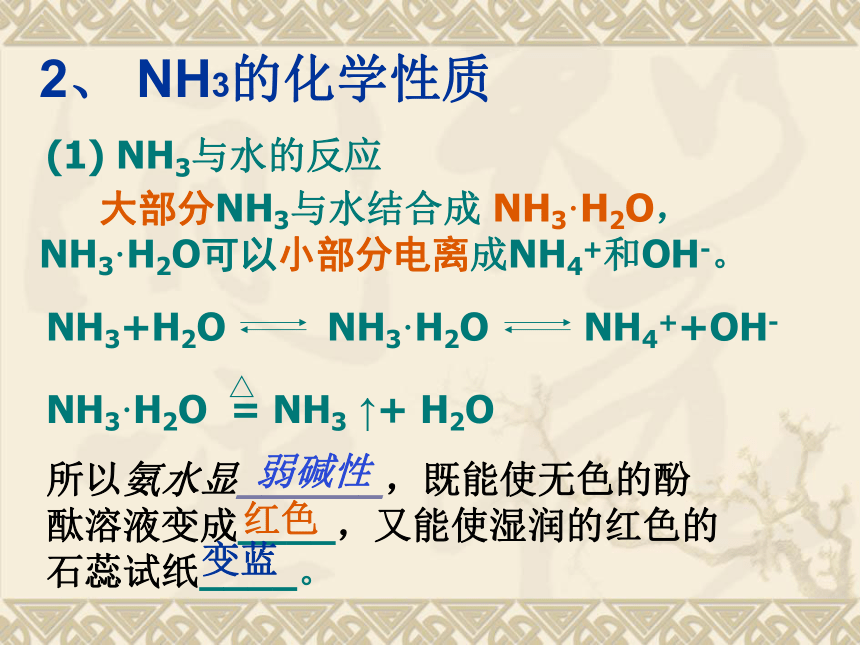
迁移2可以选用NaOH 溶液 大部分NH3与水结合成 NH3·H2O,
NH3·H2O可以小部分电离成NH4+和OH-。所以氨水显______,既能使无色的酚酞溶液变成____,又能使湿润的红色的石蕊试纸____。红色变蓝弱碱性2、 NH3的化学性质(1) NH3与水的反应氨水中的分子有:H2O、NH3 和 NH3·H2O
氨水中的离子有:NH4+、H+ 和 OH-
液氨 是氨气加压或降温后形成的液态物质,
液氨所含的微粒是NH3。所以:氨水是混合物。所以:液氨是纯净物。 讨论:
氨水的主要成份有哪些?
氨水与液态氨有何区别?NH3与挥发性酸反应会产生白烟(2) NH3与酸反应生成铵盐NH3+ HCl ===
NH3+HNO3===2NH3+H2SO4===(NH4)2SO4NH4NO3NH4Cl(3) NH3与氧气的反应:
讨论:已知NH3能将黑色的CuO还原为
红色的Cu,请写出此反应的化学方程式:NH3是一种还原性气体讨论:
①少量的 NH3 与足量的 Cl2 反应的产物是什么?请写出该化学反应的方程式。
②过量的NH3与少量的Cl2反应的产物又是什么?请写出该化学反应的方程式。2NH3 + 3Cl2 = N2 + 6HCl (少量的NH3)8NH3 +3Cl2 = N2 + 6NH4Cl(过量的NH3)三、铵盐
1、铵盐的涵义:由铵根离子和酸根离子构成的化合物
2、铵盐的物理性质:都是晶体,并且都能溶于水 3、铵盐的化学性质(1)、铵盐受热分解—不稳定性思考:1、NH4Cl加热分解的现象与以前学过的什么实验
现象相似,他们的本质是否相同?
2、如何分离NaCl晶体和NH4Cl晶体?(2)、铵盐与碱的反应4、铵盐的检验四、氨气的实验室制取:1、原理:2、装置:固体+固体 加热制取气体
——与制取O2相同 4、收集:向下排空气法5、验满:(1)湿润的红色石蕊试纸靠近试管口
(2)玻璃棒蘸取浓盐酸靠近试管口3、干燥:用碱石灰或生石灰在干燥管或U型管中干燥 6、尾气处理:用水或稀酸吸收实验室制氧气实验室制氨气干燥管U型管D
吸收尾气装置氨的用途五、氮肥铵态氮肥:
硝态氮肥:
有机氮肥:六、氮在自然界中的循环N2 NH3 N2 NO NO2
HNO3
NH4+ 、NO3-
动物蛋白质 氨基酸
植物 蛋白质本节课小结:NH3的物理性质NH3的化学性质碱性气体还原性气体NH3的工业合成、实验室制法、用途氮肥的使用思考与练习1、将1%的氨水和9%的氨水等体积混合
后,所得氨水的浓度为 ( )
A、5% B、小于5%
C、大于5% D、无法确定
2、氨水呈弱碱性的主要原因是 ( )
A、通常情况下,NH3的溶解度不大
B、一水合氨电离出少量的OH-
C、溶于水的NH3发生了电离
D、NH3本身的碱性太弱BB3、实验室不需要用棕色试剂瓶保存的试
剂是 ( )
A、浓硝酸 B、稀盐酸
C、氯水 D、氨水
4、如图,锥形瓶内有气体X,分液漏斗内有液体Y,如果Y流下,过一会儿,小气球鼓起,气体X和Y不可能是( )
A、X是NH3,Y是KCl溶液
B、X是SO2,Y是NaOH
C、X是H2,Y是浓硫酸
D、X是CO2,Y是KOHBC
氨气的合成一方面使氮肥大量的工业化生产,提高了粮食的产量。另一方面氨氧化制得硝酸及TNT炸药。由于以上原因,德国才能将第一次 世界大战延续了几年。
哈伯首创了使用化学毒剂的化学战,在第一次世界大战中有130万人受到化学战的伤害,其中9万人死亡。一、氨的合成N2(g)+3H2(g) ? 2NH3(g)合成氨的条件:1.压强:20 MPa~50MPa
2.温度:500℃左右
3.催化剂:
铁触媒——以铁为主体的多成分催化剂。高温高压催化剂1、氨气的物理性质:
(1) 氨是一种无色、有刺激性气味的气体;
(2)极易溶于水(1:700),水溶液叫“氨水”;
(3)氨易液化→“液氨”,常作致冷剂。
二、氨气的性质实验说明:NH3极易溶于水,并且水溶液呈碱性前面学过的气体SO2和Cl2,在水中溶解度不大,那么它们能不能也设计出喷泉实验呀?如能,需要什么样的试剂?你能设计出一个蓝色的喷泉实验来吗?知识
迁移1知识
迁移2可以选用NaOH 溶液 大部分NH3与水结合成 NH3·H2O,
NH3·H2O可以小部分电离成NH4+和OH-。所以氨水显______,既能使无色的酚酞溶液变成____,又能使湿润的红色的石蕊试纸____。红色变蓝弱碱性2、 NH3的化学性质(1) NH3与水的反应氨水中的分子有:H2O、NH3 和 NH3·H2O
氨水中的离子有:NH4+、H+ 和 OH-
液氨 是氨气加压或降温后形成的液态物质,
液氨所含的微粒是NH3。所以:氨水是混合物。所以:液氨是纯净物。 讨论:
氨水的主要成份有哪些?
氨水与液态氨有何区别?NH3与挥发性酸反应会产生白烟(2) NH3与酸反应生成铵盐NH3+ HCl ===
NH3+HNO3===2NH3+H2SO4===(NH4)2SO4NH4NO3NH4Cl(3) NH3与氧气的反应:
讨论:已知NH3能将黑色的CuO还原为
红色的Cu,请写出此反应的化学方程式:NH3是一种还原性气体讨论:
①少量的 NH3 与足量的 Cl2 反应的产物是什么?请写出该化学反应的方程式。
②过量的NH3与少量的Cl2反应的产物又是什么?请写出该化学反应的方程式。2NH3 + 3Cl2 = N2 + 6HCl (少量的NH3)8NH3 +3Cl2 = N2 + 6NH4Cl(过量的NH3)三、铵盐
1、铵盐的涵义:由铵根离子和酸根离子构成的化合物
2、铵盐的物理性质:都是晶体,并且都能溶于水 3、铵盐的化学性质(1)、铵盐受热分解—不稳定性思考:1、NH4Cl加热分解的现象与以前学过的什么实验
现象相似,他们的本质是否相同?
2、如何分离NaCl晶体和NH4Cl晶体?(2)、铵盐与碱的反应4、铵盐的检验四、氨气的实验室制取:1、原理:2、装置:固体+固体 加热制取气体
——与制取O2相同 4、收集:向下排空气法5、验满:(1)湿润的红色石蕊试纸靠近试管口
(2)玻璃棒蘸取浓盐酸靠近试管口3、干燥:用碱石灰或生石灰在干燥管或U型管中干燥 6、尾气处理:用水或稀酸吸收实验室制氧气实验室制氨气干燥管U型管D
吸收尾气装置氨的用途五、氮肥铵态氮肥:
硝态氮肥:
有机氮肥:六、氮在自然界中的循环N2 NH3 N2 NO NO2
HNO3
NH4+ 、NO3-
动物蛋白质 氨基酸
植物 蛋白质本节课小结:NH3的物理性质NH3的化学性质碱性气体还原性气体NH3的工业合成、实验室制法、用途氮肥的使用思考与练习1、将1%的氨水和9%的氨水等体积混合
后,所得氨水的浓度为 ( )
A、5% B、小于5%
C、大于5% D、无法确定
2、氨水呈弱碱性的主要原因是 ( )
A、通常情况下,NH3的溶解度不大
B、一水合氨电离出少量的OH-
C、溶于水的NH3发生了电离
D、NH3本身的碱性太弱BB3、实验室不需要用棕色试剂瓶保存的试
剂是 ( )
A、浓硝酸 B、稀盐酸
C、氯水 D、氨水
4、如图,锥形瓶内有气体X,分液漏斗内有液体Y,如果Y流下,过一会儿,小气球鼓起,气体X和Y不可能是( )
A、X是NH3,Y是KCl溶液
B、X是SO2,Y是NaOH
C、X是H2,Y是浓硫酸
D、X是CO2,Y是KOHBC
