氮氧化物的产生和转化[上学期]
图片预览




文档简介
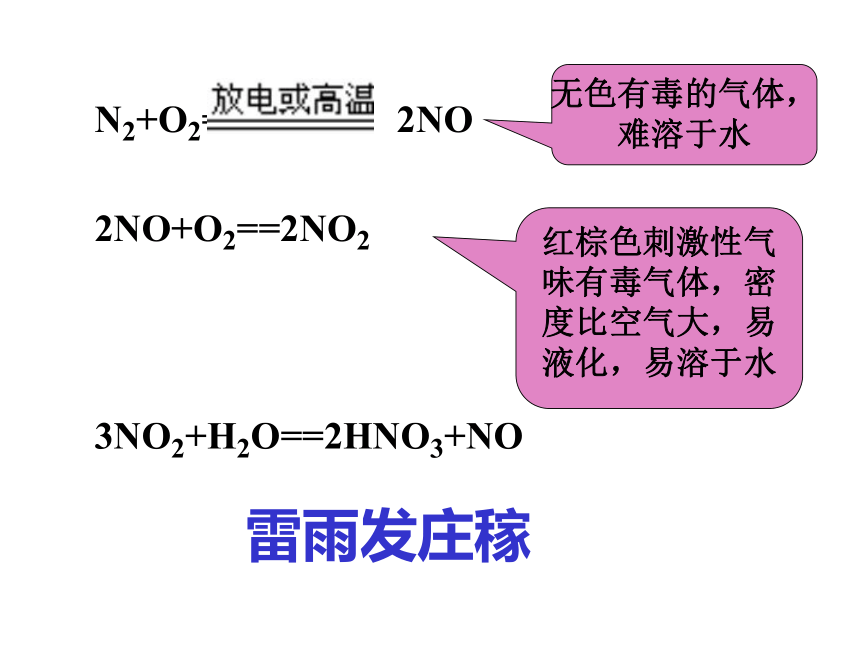
课件16张PPT。氮氧化物的产生和转化江苏省宿迁中学高一化学组雷雨发庄稼!2NO+O2==2NO23NO2+H2O==2HNO3+NO雷雨发庄稼N2+O2===== 2NO红棕色刺激性气味有毒气体,密度比空气大,易液化,易溶于水无色有毒的气体,难溶于水[科学探究]
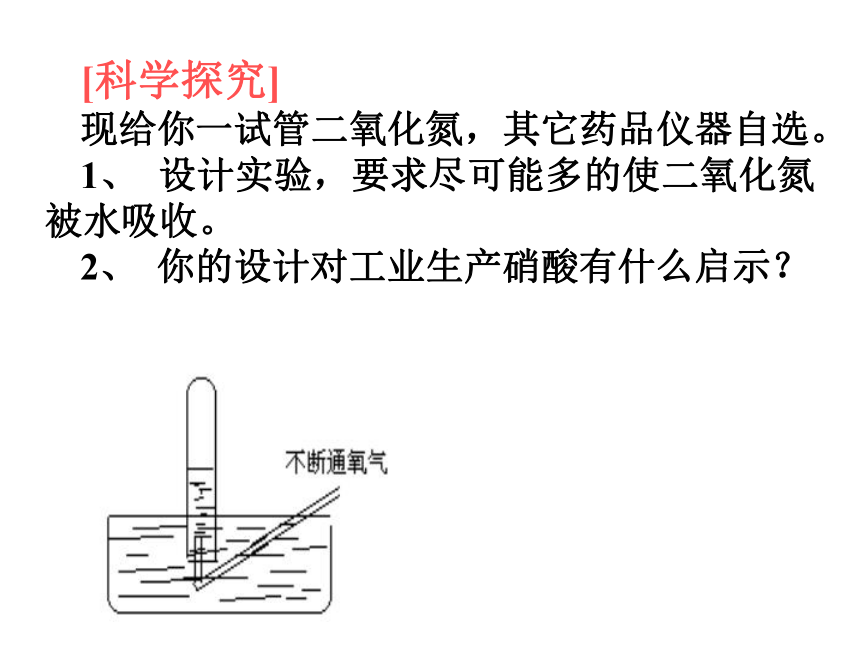
现给你一试管二氧化氮,其它药品仪器自选。
1、? 设计实验,要求尽可能多的使二氧化氮被水吸收。
2、? 你的设计对工业生产硝酸有什么启示?
步骤一
将一支充满二氧化氮的试管倒立在水槽中
现象
红棕色气体消失,水位上升,最后水充满试管的2/3,无色气体充满试管的 1/3(上部)
解释:
3NO2+H2O==2HNO3+NO
为红棕色气体,易溶于水,一氧化氮为无色气体,难溶于水。步骤二:
将氧气慢慢通入步骤一的试管中
现象
无色气体变为红棕色气体,又变为无色气体,但气体体积减少,液面不断上升
解释:
2NO+O2==2NO2
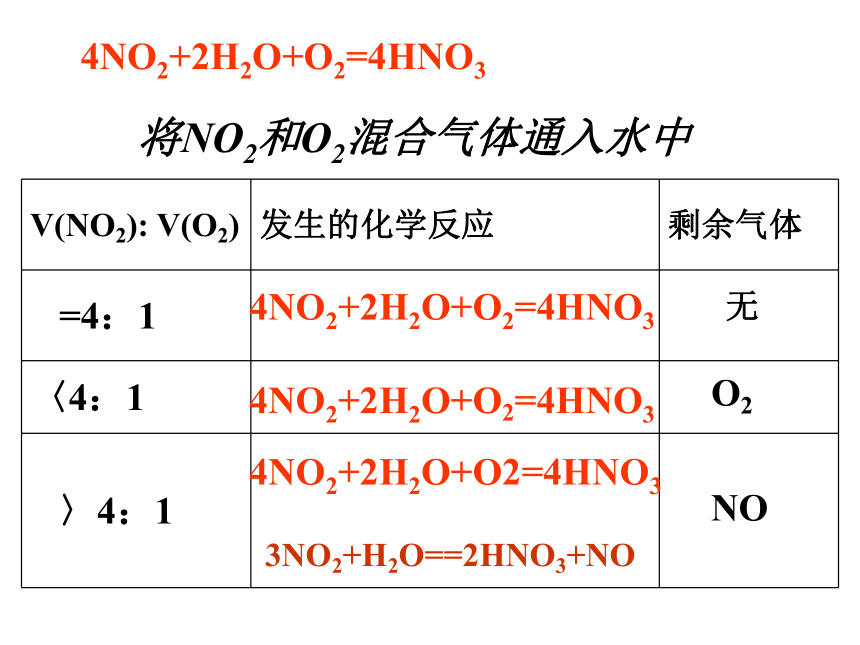
3NO2+H2O==2HNO3+NO… …将NO2和O2混合气体通入水中4NO2+2H2O+O2=4HNO34NO2+2H2O+O2=4HNO34NO2+2H2O+O2=4HNO33NO2+H2O==2HNO3+NOO2NO无4NO2+2H2O+O2=4HNO3将NO和O2混合气体通入水中4NO+2H2O+3O2=4HNO34NO+2H2O+3O2=4HNO34NO+2H2O+3O2=4HNO3O2NO无4NO+2H2O+3O2=4HNO3氮氧化物与环境污染的防治 1、主要危害:形成酸雨、破坏臭氧层、形成光化学烟雾、有毒2、消除污染的主要方法:碱液吸收法
NO+NO2 +2NaOH=2NaNO2 +H2 O
2NO2 +2NaOH=NaNO2 + NaNO3 + H2 O
NH3还原法 6NO+4NH3=5N2 +6H2 0pH值小于5.6的雨水叫酸雨 3NO2+H2O=2HNO3+NO
2SO2+O2=SO3
SO3+H2O=H2SO4
小结:二氧化氮和一氧化氮
1、NO的生成及与NO2转化
N2+O2 2NO
2NO+O2=2NO2
3NO2+H2O=2HNO3+NO
2、二氧化氮物理性质:红棕色刺激性气味有毒气体,密度比空气大,易液化,易溶与水。
3、4NO2+2H2O+O2=4HNO3
4NO+2H2O+3O2=4HNO3
氮的几种重要氧化物思考:二氧化氮是硝酸的酸酐吗?为什么?哪种氧化物是亚硝酸(HNO2)的酸酐?氧化物化合价N2ONON2O3NO2N2O4N2O5+1+2+3+4+4+5----亚硝酐硝酐------------酸酐?例1、将20mL NO2与NO的混合气体通入倒立在水槽中盛满水的玻璃筒(带刻度)后,筒内剩下10mL气体。求原混合气体中NO和NO2的体积。分析:NO不溶于水,NO2溶于水并与水反应生成HNO3和NO。所以玻璃筒内剩下10mL气体有原混合气体中NO,也有NO2与水生成的NO。4NO2+H2O+O2=4HNO3
4NO+H2O+3O2=4HNO3
例2、 一定条件下,将体积比均为1∶1的NO和O2、NO和NO2、NO2和O2三组气体分别充入a、b、c三支容积相同的试管中,并将试管倒置于水槽中,充分反应后,三支试管中水面上升高度ha、hb、hc的关系是________.
例题3、酸雨是因过度燃烧煤和石油,生成硫和氮的氧化物溶于水,生成了H2SO4和HNO3的缘故。分析某次雨水的数据如下:
[NH4+]=2.0×10—6mol·L—1
[Na+]=3×10—6mol·L—1
[CI—]=6×10—6mol·L—1
[SO42—]=2.8×10—5mol·L—1
[NO3—]=2.3×10—5mol·L—1
则此次降雨雨水的[H+]=___________mol·L—1
现给你一试管二氧化氮,其它药品仪器自选。
1、? 设计实验,要求尽可能多的使二氧化氮被水吸收。
2、? 你的设计对工业生产硝酸有什么启示?
步骤一
将一支充满二氧化氮的试管倒立在水槽中
现象
红棕色气体消失,水位上升,最后水充满试管的2/3,无色气体充满试管的 1/3(上部)
解释:
3NO2+H2O==2HNO3+NO
为红棕色气体,易溶于水,一氧化氮为无色气体,难溶于水。步骤二:
将氧气慢慢通入步骤一的试管中
现象
无色气体变为红棕色气体,又变为无色气体,但气体体积减少,液面不断上升
解释:
2NO+O2==2NO2
3NO2+H2O==2HNO3+NO… …将NO2和O2混合气体通入水中4NO2+2H2O+O2=4HNO34NO2+2H2O+O2=4HNO34NO2+2H2O+O2=4HNO33NO2+H2O==2HNO3+NOO2NO无4NO2+2H2O+O2=4HNO3将NO和O2混合气体通入水中4NO+2H2O+3O2=4HNO34NO+2H2O+3O2=4HNO34NO+2H2O+3O2=4HNO3O2NO无4NO+2H2O+3O2=4HNO3氮氧化物与环境污染的防治 1、主要危害:形成酸雨、破坏臭氧层、形成光化学烟雾、有毒2、消除污染的主要方法:碱液吸收法
NO+NO2 +2NaOH=2NaNO2 +H2 O
2NO2 +2NaOH=NaNO2 + NaNO3 + H2 O
NH3还原法 6NO+4NH3=5N2 +6H2 0pH值小于5.6的雨水叫酸雨 3NO2+H2O=2HNO3+NO
2SO2+O2=SO3
SO3+H2O=H2SO4
小结:二氧化氮和一氧化氮
1、NO的生成及与NO2转化
N2+O2 2NO
2NO+O2=2NO2
3NO2+H2O=2HNO3+NO
2、二氧化氮物理性质:红棕色刺激性气味有毒气体,密度比空气大,易液化,易溶与水。
3、4NO2+2H2O+O2=4HNO3
4NO+2H2O+3O2=4HNO3
氮的几种重要氧化物思考:二氧化氮是硝酸的酸酐吗?为什么?哪种氧化物是亚硝酸(HNO2)的酸酐?氧化物化合价N2ONON2O3NO2N2O4N2O5+1+2+3+4+4+5----亚硝酐硝酐------------酸酐?例1、将20mL NO2与NO的混合气体通入倒立在水槽中盛满水的玻璃筒(带刻度)后,筒内剩下10mL气体。求原混合气体中NO和NO2的体积。分析:NO不溶于水,NO2溶于水并与水反应生成HNO3和NO。所以玻璃筒内剩下10mL气体有原混合气体中NO,也有NO2与水生成的NO。4NO2+H2O+O2=4HNO3
4NO+H2O+3O2=4HNO3
例2、 一定条件下,将体积比均为1∶1的NO和O2、NO和NO2、NO2和O2三组气体分别充入a、b、c三支容积相同的试管中,并将试管倒置于水槽中,充分反应后,三支试管中水面上升高度ha、hb、hc的关系是________.
例题3、酸雨是因过度燃烧煤和石油,生成硫和氮的氧化物溶于水,生成了H2SO4和HNO3的缘故。分析某次雨水的数据如下:
[NH4+]=2.0×10—6mol·L—1
[Na+]=3×10—6mol·L—1
[CI—]=6×10—6mol·L—1
[SO42—]=2.8×10—5mol·L—1
[NO3—]=2.3×10—5mol·L—1
则此次降雨雨水的[H+]=___________mol·L—1
