钢铁的腐蚀和防护[上学期]
图片预览


文档简介
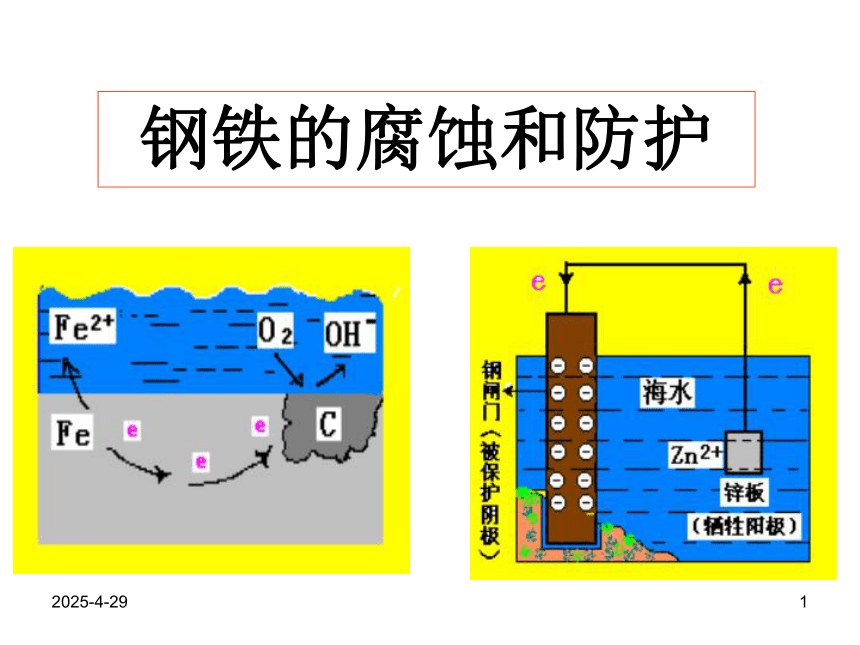
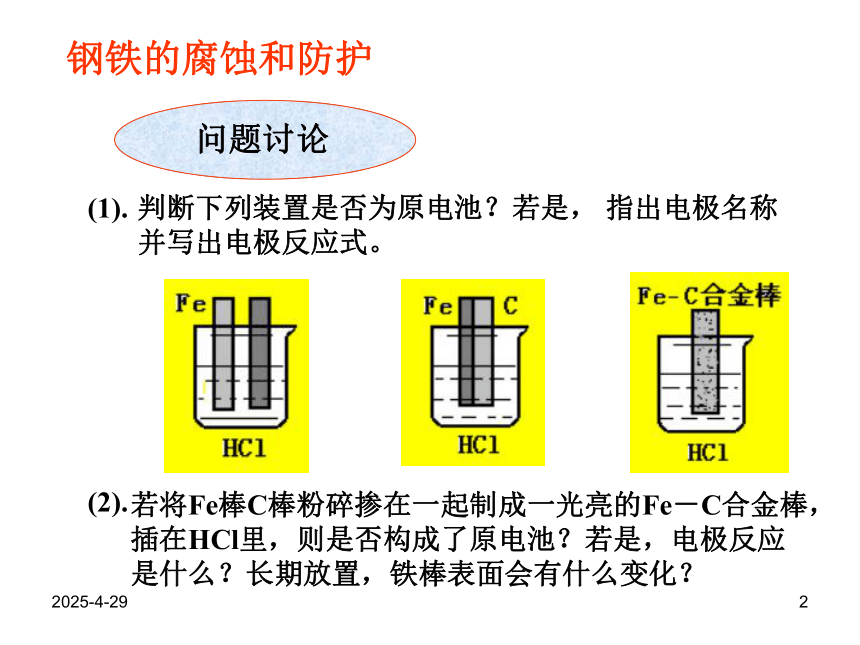
课件13张PPT。2019/2/281钢铁的腐蚀和防护2019/2/282问题讨论(1).(2).钢铁的腐蚀和防护判断下列装置是否为原电池?若是, 指出电极名称并写出电极反应式。若将Fe棒C棒粉碎掺在一起制成一光亮的Fe-C合金棒,插在HCl里,则是否构成了原电池?若是,电极反应是什么?长期放置,铁棒表面会有什么变化?2019/2/283(3) (4)(5)钢铁腐蚀的本质是什么?什么是钢铁的析氢腐蚀
和吸氧腐蚀?为什么常以后者为主?生产上常采取哪些金属防腐措施?钢铁及其制品通常为含碳的铁合金,若在潮湿的
环境里或浓度较大的环境里长期放置,常易生锈
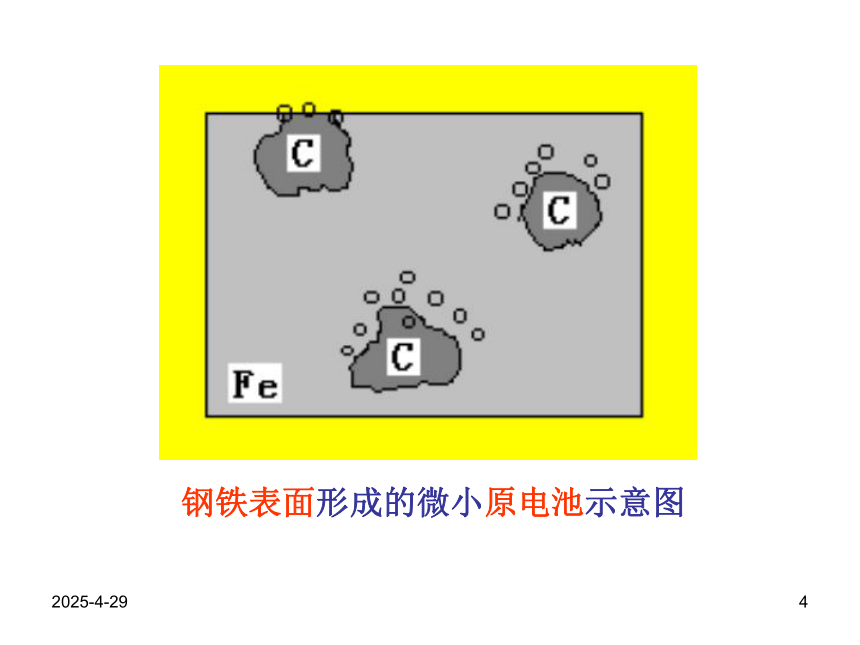
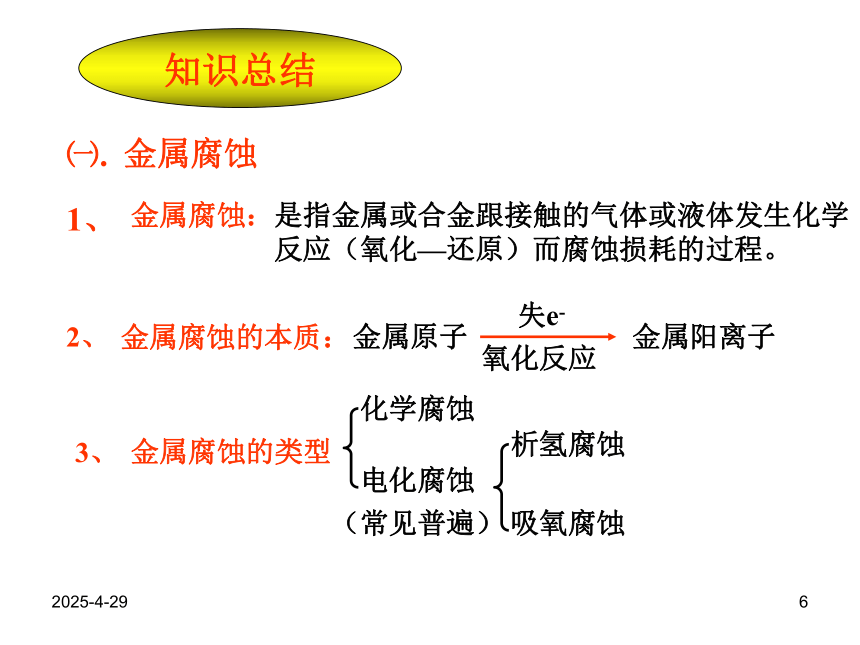
变红,原因是什么?2019/2/284钢铁表面形成的微小原电池示意图2019/2/285钢铁的析氢腐蚀示意图钢铁的吸氧腐蚀示意图2019/2/286知识总结1、2、金属阳离子失e-氧化反应金属腐蚀的类型化学腐蚀电化腐蚀析氢腐蚀吸氧腐蚀(常见普遍)㈠.金属腐蚀金属原子金属腐蚀的本质:3、金属腐蚀:是指金属或合金跟接触的气体或液体发生化学反应(氧化—还原)而腐蚀损耗的过程。2019/2/2874.钢铁的析氢腐蚀和吸氧腐蚀比较Fe2O3 · nH2O(铁锈)通常两种腐蚀同时存在,但以后者更普遍。析氢腐蚀吸氧腐蚀条件水膜呈酸性。水膜呈中性或酸性很弱。CO2+H2O?H2CO3 ? H++HCO 3- 电极反应负极Fe(- )Fe-2e=Fe2+2Fe-4e=2Fe2+正极C(+)2H++2e=H2↑O2+2H2O+4e=4OH-总反应:Fe+2H+=Fe2+↑2Fe+2H2O+O2= 2 Fe(OH)24Fe(OH)2+2H2O+O2=4Fe(OH)3联系2019/2/288㈡钢铁腐蚀的防护:例6:改变金属的内部组织结构:如将Cr、Ni等金属加进钢里制成合金钢。⒈A.C.铜的金属活动性比氢小,因此不宜被氧化;B.D.它们的表面都电镀上了一层耐腐蚀的黄金;2000年5月,保利集团在香港拍卖会上花费3000多万港币购回在火烧圆明园时流失的国宝:铜铸的牛首、猴首和虎首,普通铜器时间稍久容易出现铜绿,其主要成分是[Cu2(OH)2CO3]这三件1760年铜铸的国宝在240 年后看上去仍然熠熠生辉不生锈,下列对起原因的分析,最可能的是环境污染日趋严重,它们表面的铜绿被酸雨溶解洗去;( D )它们是含一定比例金、银、锡、锌的合金;2019/2/2892.金属表面覆盖保护层3.电化学保护法原理:原理 :如油漆、油脂等,电镀(Zn,Cr等易氧化形成致密的氧化
物薄膜)作保护层。隔绝金属与外界空气、电解质溶液的接触。——牺牲阳极的阴极保护法形成原电池反应时,让被保护金属做正极,不反应,起到保护作用;而活泼金属反应受到腐蚀。2019/2/2810牺牲阳极的阴极保护法示意图2019/2/2811练 习1。 如图, 水槽中试管内有一枚铁钉,放置数天观察:(1)若液面上升,则溶液呈 性,发生
腐蚀,电极反应式为:负极: ,
正极: ; 若液面下降,则溶液呈 性,发生
腐蚀,电极反应式为:负极:
正极: 。(2)中性或碱性 吸氧Fe–2e-=Fe2+O2+2H2O+4e-=4OH-酸性析氢Fe–2e-=Fe2+2H++2e-=H2↑ 2019/2/28122、分析右图,按要求写出有关反应方程式:
(1)、铁棒上的电极反应式为:
(2)、碳棒上的电极反应式为:
(3)、溶液中发生反应的化学方程式:
3、镍—镉可充电电池可发生如下反应:Cd+2NiO(OH)+2H2O由此可知,该电池的负极材料是Cd(OH)2+2Ni(OH)2放电充电A. Cd, ( A )B. NiO(OH), D. Ni(OH)2C. Cd(OH)22Fe+2H2O+O2= 2 Fe(OH)24Fe(OH)2+2H2O+O2=4Fe(OH)3O2+2H2O+4e-=4OH-2Fe–4e-=2Fe2+2019/2/2813原电池小结定义形成条件正负极名称和电子流向判断工作原理(氧还反应,熟写电极反应式)应用分析各种电池。比较金属活动性强弱比较反应速率比较金属腐蚀的快慢金属的腐蚀和防护原电池腐蚀(定义、本质、类型)腐蚀防护(常见三种方法)(从活泼性比较、电子得失、氧还反应等多角度判断)题型(三点记住)
和吸氧腐蚀?为什么常以后者为主?生产上常采取哪些金属防腐措施?钢铁及其制品通常为含碳的铁合金,若在潮湿的
环境里或浓度较大的环境里长期放置,常易生锈
变红,原因是什么?2019/2/284钢铁表面形成的微小原电池示意图2019/2/285钢铁的析氢腐蚀示意图钢铁的吸氧腐蚀示意图2019/2/286知识总结1、2、金属阳离子失e-氧化反应金属腐蚀的类型化学腐蚀电化腐蚀析氢腐蚀吸氧腐蚀(常见普遍)㈠.金属腐蚀金属原子金属腐蚀的本质:3、金属腐蚀:是指金属或合金跟接触的气体或液体发生化学反应(氧化—还原)而腐蚀损耗的过程。2019/2/2874.钢铁的析氢腐蚀和吸氧腐蚀比较Fe2O3 · nH2O(铁锈)通常两种腐蚀同时存在,但以后者更普遍。析氢腐蚀吸氧腐蚀条件水膜呈酸性。水膜呈中性或酸性很弱。CO2+H2O?H2CO3 ? H++HCO 3- 电极反应负极Fe(- )Fe-2e=Fe2+2Fe-4e=2Fe2+正极C(+)2H++2e=H2↑O2+2H2O+4e=4OH-总反应:Fe+2H+=Fe2+↑2Fe+2H2O+O2= 2 Fe(OH)24Fe(OH)2+2H2O+O2=4Fe(OH)3联系2019/2/288㈡钢铁腐蚀的防护:例6:改变金属的内部组织结构:如将Cr、Ni等金属加进钢里制成合金钢。⒈A.C.铜的金属活动性比氢小,因此不宜被氧化;B.D.它们的表面都电镀上了一层耐腐蚀的黄金;2000年5月,保利集团在香港拍卖会上花费3000多万港币购回在火烧圆明园时流失的国宝:铜铸的牛首、猴首和虎首,普通铜器时间稍久容易出现铜绿,其主要成分是[Cu2(OH)2CO3]这三件1760年铜铸的国宝在240 年后看上去仍然熠熠生辉不生锈,下列对起原因的分析,最可能的是环境污染日趋严重,它们表面的铜绿被酸雨溶解洗去;( D )它们是含一定比例金、银、锡、锌的合金;2019/2/2892.金属表面覆盖保护层3.电化学保护法原理:原理 :如油漆、油脂等,电镀(Zn,Cr等易氧化形成致密的氧化
物薄膜)作保护层。隔绝金属与外界空气、电解质溶液的接触。——牺牲阳极的阴极保护法形成原电池反应时,让被保护金属做正极,不反应,起到保护作用;而活泼金属反应受到腐蚀。2019/2/2810牺牲阳极的阴极保护法示意图2019/2/2811练 习1。 如图, 水槽中试管内有一枚铁钉,放置数天观察:(1)若液面上升,则溶液呈 性,发生
腐蚀,电极反应式为:负极: ,
正极: ; 若液面下降,则溶液呈 性,发生
腐蚀,电极反应式为:负极:
正极: 。(2)中性或碱性 吸氧Fe–2e-=Fe2+O2+2H2O+4e-=4OH-酸性析氢Fe–2e-=Fe2+2H++2e-=H2↑ 2019/2/28122、分析右图,按要求写出有关反应方程式:
(1)、铁棒上的电极反应式为:
(2)、碳棒上的电极反应式为:
(3)、溶液中发生反应的化学方程式:
3、镍—镉可充电电池可发生如下反应:Cd+2NiO(OH)+2H2O由此可知,该电池的负极材料是Cd(OH)2+2Ni(OH)2放电充电A. Cd, ( A )B. NiO(OH), D. Ni(OH)2C. Cd(OH)22Fe+2H2O+O2= 2 Fe(OH)24Fe(OH)2+2H2O+O2=4Fe(OH)3O2+2H2O+4e-=4OH-2Fe–4e-=2Fe2+2019/2/2813原电池小结定义形成条件正负极名称和电子流向判断工作原理(氧还反应,熟写电极反应式)应用分析各种电池。比较金属活动性强弱比较反应速率比较金属腐蚀的快慢金属的腐蚀和防护原电池腐蚀(定义、本质、类型)腐蚀防护(常见三种方法)(从活泼性比较、电子得失、氧还反应等多角度判断)题型(三点记住)
