乙烯[下学期]
图片预览




文档简介
(共24张PPT)
乙烯 烯烃
不饱和烃:
分子中含有C=C或C≡C的烃,其中所含的H原子数少于相同碳原子数的烷烃中的H原子数。
如:CH2=CH2 CH2=CHCH3
CH≡CH CH≡CCH3
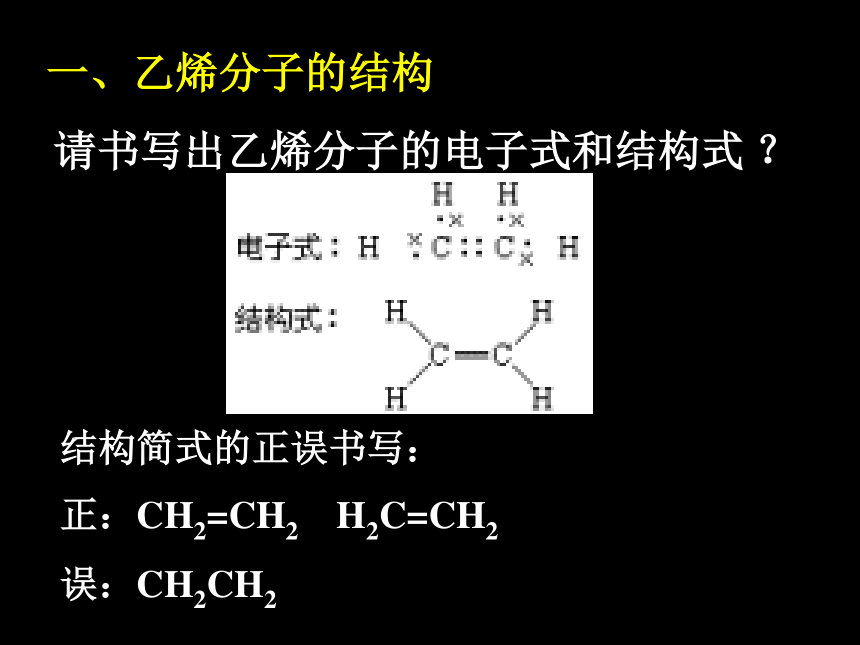
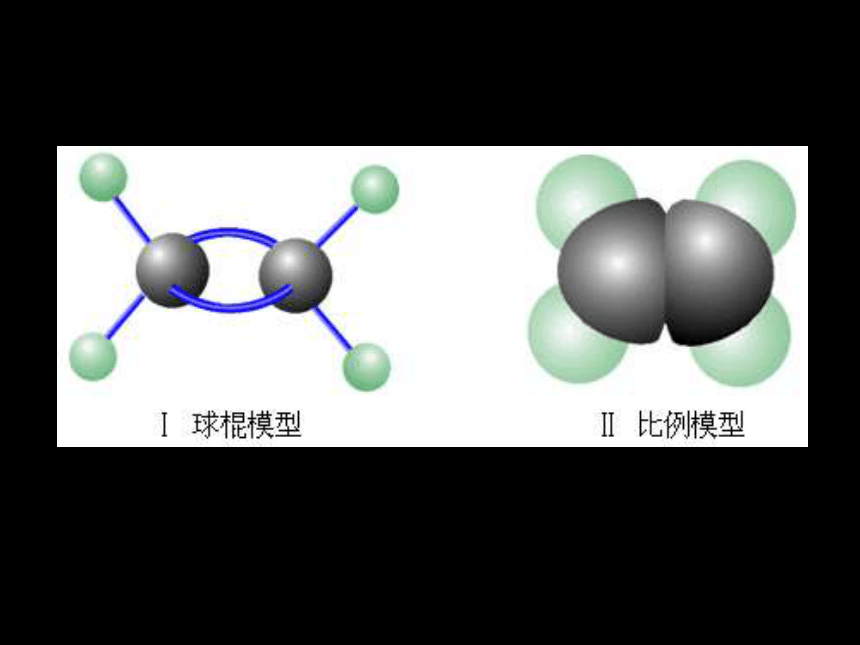
一、乙烯分子的结构
请书写出乙烯分子的电子式和结构式 ?
结构简式的正误书写:
正:CH2=CH2 H2C=CH2
误:CH2CH2
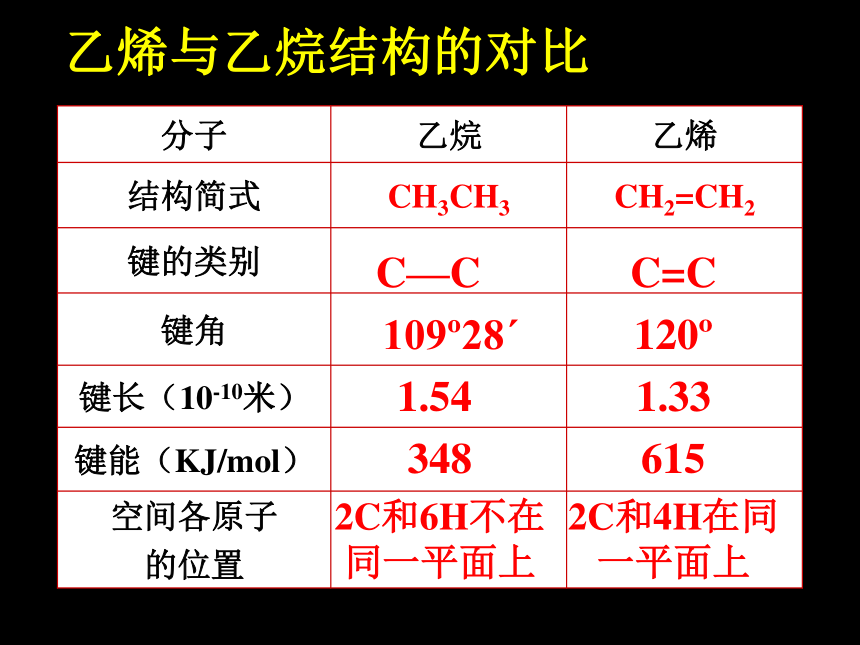
分子 乙烷 乙烯
结构简式 CH3CH3 CH2=CH2
键的类别
键角
键长(10-10米)
键能(KJ/mol)
空间各原子
的位置
C—C
109 28ˊ
1.54
348
2C和6H不在同一平面上
C=C
120
1.33
615
2C和4H在同一平面上
乙烯与乙烷结构的对比
二、乙烯的制法:
1、工业制法:
工业上所用的乙烯,主要是从石油炼制厂和石油化工厂所产生的气体中分离出来的。
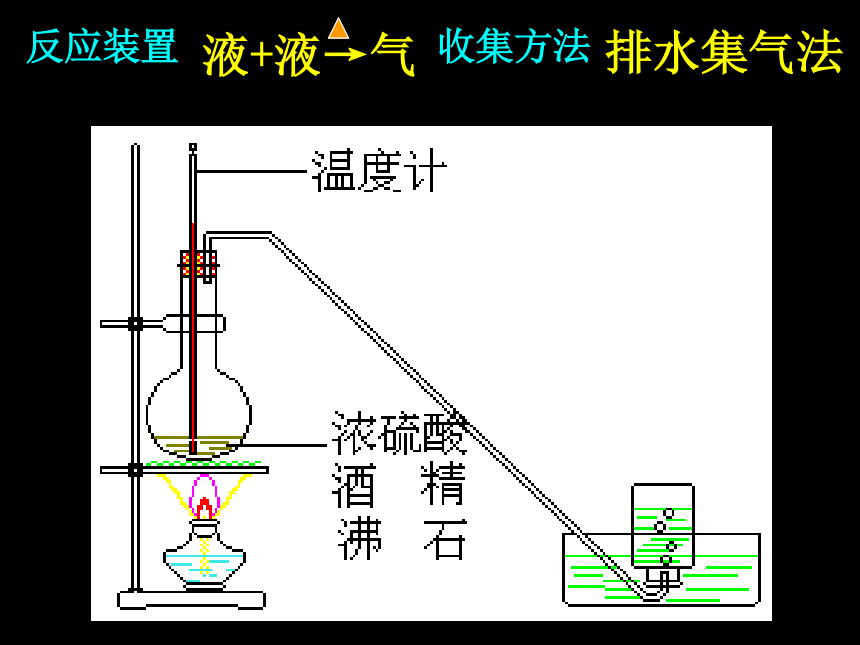
2、乙烯的实验室制法
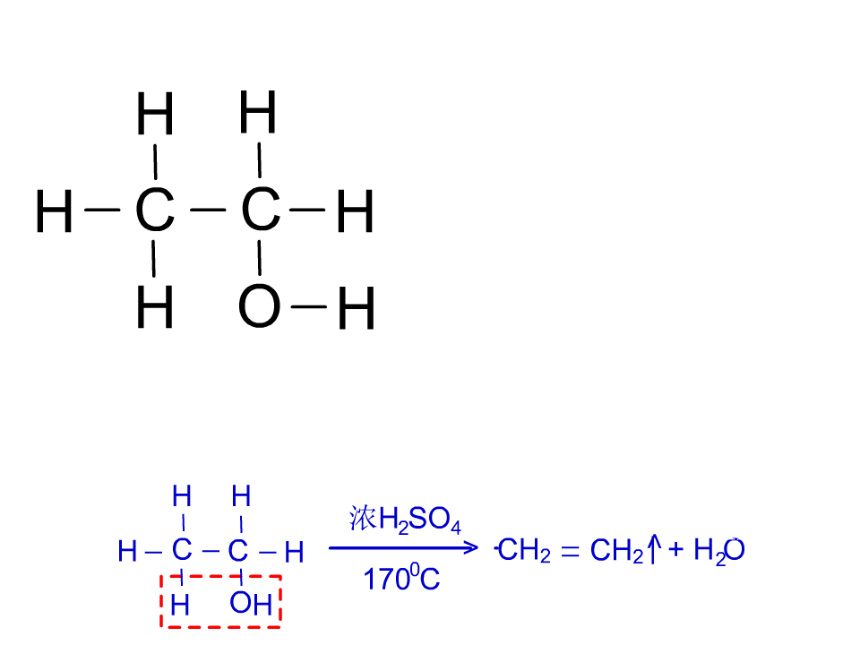
实验室常用加热乙醇和浓硫酸的混合物来制取乙烯。
思考以下问题:
1、由乙醇(CH3CH2OH)变成乙烯(CH2=CH2) ,从分子组成的角度看,还应有什么产物?
2、要从乙醇分子中去掉一个水分子,应选用什么试剂?它在反应中起了什么作用?用量是多少呢?
V(乙醇):V(浓硫酸)=1:3
反应装置 收集方法
液+液→气
排水集气法
+
H2O
(1)浓硫酸:催化剂、脱水剂。 浓硫酸与乙醇的体积比为3:1,如何混合
C2H5OH 2C+3H2O
浓硫酸
C+2H2SO4(浓)==CO2↑+2SO2↑+2H2O
△
(2)对反应温度的要求:170℃以下及170 ℃以上不能有效脱水,故必须迅速将温度升至170℃并保持恒温。
140 ℃时 分子间脱水生成乙醚和水 ;
170℃以上浓硫酸使乙醇脱水而炭化。
(3)需要在混合液中加入少量的碎瓷片,作用是什么
(5)气体的净化:
NaOH
H2SO4
(4)用温度计指示反应温度,温度计的水银球应该放在哪里
可能有哪些杂质?
三、乙烯的性质:
1、物理性质:
乙烯是无色气体,稍有气味,
标准状况下的密度是 g/L,比空 气略轻(相对分子量28)
乙烯是 分子,难溶于水。
非极性
2、化学性质:
(1)氧化反应:
a、燃烧(被O2氧化)
CH2=CH2 + 3O2 →2CO2 + 2H2O
明亮火焰,少量黑烟.
b、使酸性KMnO4溶液褪色(被KMnO4氧化)
鉴别乙烯和甲烷等
[思考]在实验室里制备的乙烯中常含有SO2,试设计一个实验,检验SO2的存在并验证乙烯的还原性。
(2)加成反应(与H2、Br2、HX、H2O等):
CH2=CH2 + H H→CH3CH3
CH2=CH2 + Br-Br→ CH2BrCH2Br
CH2=CH2 +H-Cl →CH3CH2Cl
CH2=CH2 + H-OH → CH3CH2OH
有机物分子中双键或叁键两端的碳原子与其他原子或原子团结合生成新的化合物的反应,叫做加成反应。
(3)加聚反应:
CH2=CH2+CH2=CH2+ CH2=CH2+…→ -CH2-CH2-+-CH2-CH2-+-CH2-CH2- …→…-CH2-CH2-CH2- CH2-CH2-CH2-… → CH2-CH2
n
单体
链节
由分子量小的化合物(单体)生成分子量很大的化合物(高分子化合物)的反应(也叫聚合反应)
聚合度
乙烯的用途
(1)乙烯是石油化工的一种基础 原料,用于制造合成橡胶、合成树脂(如聚苯乙烯、聚氯乙烯)、合成纤维、炸药、乙醇、乙醛、醋酸、环氧乙烷等有机合成产品
(2)植物生长调节剂,催熟剂
H H
H H
H—C—C—O—H + H—O—C—C—H
H H
H H
浓H2SO4
140 C
H—C—C—O—C—C—H + H2O
H H
H H
H H
H H
乙醚
实验中应采取什么方法来减少副反应的发生
乙烯 烯烃
不饱和烃:
分子中含有C=C或C≡C的烃,其中所含的H原子数少于相同碳原子数的烷烃中的H原子数。
如:CH2=CH2 CH2=CHCH3
CH≡CH CH≡CCH3
一、乙烯分子的结构
请书写出乙烯分子的电子式和结构式 ?
结构简式的正误书写:
正:CH2=CH2 H2C=CH2
误:CH2CH2
分子 乙烷 乙烯
结构简式 CH3CH3 CH2=CH2
键的类别
键角
键长(10-10米)
键能(KJ/mol)
空间各原子
的位置
C—C
109 28ˊ
1.54
348
2C和6H不在同一平面上
C=C
120
1.33
615
2C和4H在同一平面上
乙烯与乙烷结构的对比
二、乙烯的制法:
1、工业制法:
工业上所用的乙烯,主要是从石油炼制厂和石油化工厂所产生的气体中分离出来的。
2、乙烯的实验室制法
实验室常用加热乙醇和浓硫酸的混合物来制取乙烯。
思考以下问题:
1、由乙醇(CH3CH2OH)变成乙烯(CH2=CH2) ,从分子组成的角度看,还应有什么产物?
2、要从乙醇分子中去掉一个水分子,应选用什么试剂?它在反应中起了什么作用?用量是多少呢?
V(乙醇):V(浓硫酸)=1:3
反应装置 收集方法
液+液→气
排水集气法
+
H2O
(1)浓硫酸:催化剂、脱水剂。 浓硫酸与乙醇的体积比为3:1,如何混合
C2H5OH 2C+3H2O
浓硫酸
C+2H2SO4(浓)==CO2↑+2SO2↑+2H2O
△
(2)对反应温度的要求:170℃以下及170 ℃以上不能有效脱水,故必须迅速将温度升至170℃并保持恒温。
140 ℃时 分子间脱水生成乙醚和水 ;
170℃以上浓硫酸使乙醇脱水而炭化。
(3)需要在混合液中加入少量的碎瓷片,作用是什么
(5)气体的净化:
NaOH
H2SO4
(4)用温度计指示反应温度,温度计的水银球应该放在哪里
可能有哪些杂质?
三、乙烯的性质:
1、物理性质:
乙烯是无色气体,稍有气味,
标准状况下的密度是 g/L,比空 气略轻(相对分子量28)
乙烯是 分子,难溶于水。
非极性
2、化学性质:
(1)氧化反应:
a、燃烧(被O2氧化)
CH2=CH2 + 3O2 →2CO2 + 2H2O
明亮火焰,少量黑烟.
b、使酸性KMnO4溶液褪色(被KMnO4氧化)
鉴别乙烯和甲烷等
[思考]在实验室里制备的乙烯中常含有SO2,试设计一个实验,检验SO2的存在并验证乙烯的还原性。
(2)加成反应(与H2、Br2、HX、H2O等):
CH2=CH2 + H H→CH3CH3
CH2=CH2 + Br-Br→ CH2BrCH2Br
CH2=CH2 +H-Cl →CH3CH2Cl
CH2=CH2 + H-OH → CH3CH2OH
有机物分子中双键或叁键两端的碳原子与其他原子或原子团结合生成新的化合物的反应,叫做加成反应。
(3)加聚反应:
CH2=CH2+CH2=CH2+ CH2=CH2+…→ -CH2-CH2-+-CH2-CH2-+-CH2-CH2- …→…-CH2-CH2-CH2- CH2-CH2-CH2-… → CH2-CH2
n
单体
链节
由分子量小的化合物(单体)生成分子量很大的化合物(高分子化合物)的反应(也叫聚合反应)
聚合度
乙烯的用途
(1)乙烯是石油化工的一种基础 原料,用于制造合成橡胶、合成树脂(如聚苯乙烯、聚氯乙烯)、合成纤维、炸药、乙醇、乙醛、醋酸、环氧乙烷等有机合成产品
(2)植物生长调节剂,催熟剂
H H
H H
H—C—C—O—H + H—O—C—C—H
H H
H H
浓H2SO4
140 C
H—C—C—O—C—C—H + H2O
H H
H H
H H
H H
乙醚
实验中应采取什么方法来减少副反应的发生
