元素周期律[下学期]
图片预览






文档简介
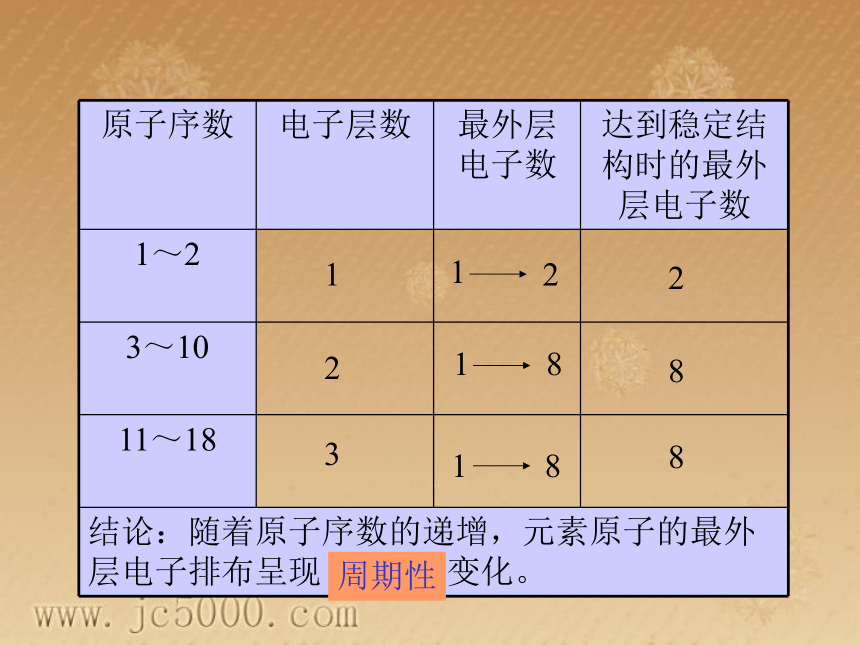
课件19张PPT。元素周期律思考 通过对1~18号元素的原子结构示意图的比较,分析原子的核外电子层数和最外层电子数的变化有何规律﹖ 123882周期性 一、核外电子排布的周期性变化 1. 随着元素原子序数的递增,元素原子的最外层电子数呈现1到8递增的周期性变化。2.原子序数:为了方便,人们按核电荷数由小到大的顺序给元素编号,这种编号叫做原子序数。原子序数=元素的核电荷数
=原子核内的质子数 二、原子半径的周期性变化原子半径逐渐减小逐渐减小周期性 二、原子半径的周期性变化 随着元素原子序数的递增,元素原子半径呈现周期性变化。半径比较的规律:①原子电子层相同时,最外层电子数越多,半径越小②最外层电子数相同时,电子层数越多,半径越大③阳离子半径<对应的原子半径,
阴离子半径>对应的原子半径④电子层排布相同的离子,核电荷数越大,半径越小。 三、元素化合价的周期性变化元素的化合价周期性 三、元素化合价的周期性变化 随着元素原子序数的递增,元素的最高化合价从+1递增到+7,最低化合价从-4递增到-1的周期性变化。最高正价数==最外层电子数(除氧、氟及稀有气体)元素的负价=最外层电子数-8原子半径
=原子核内的质子数 二、原子半径的周期性变化原子半径逐渐减小逐渐减小周期性 二、原子半径的周期性变化 随着元素原子序数的递增,元素原子半径呈现周期性变化。半径比较的规律:①原子电子层相同时,最外层电子数越多,半径越小②最外层电子数相同时,电子层数越多,半径越大③阳离子半径<对应的原子半径,
阴离子半径>对应的原子半径④电子层排布相同的离子,核电荷数越大,半径越小。 三、元素化合价的周期性变化元素的化合价周期性 三、元素化合价的周期性变化 随着元素原子序数的递增,元素的最高化合价从+1递增到+7,最低化合价从-4递增到-1的周期性变化。最高正价数==最外层电子数(除氧、氟及稀有气体)元素的负价=最外层电子数-8原子半径
