晶体结构试题分类解析[下学期]
图片预览




文档简介
课件20张PPT。晶体结构试题
分类解析一、几种重要的晶体结构示意图 NaCl的晶体结构 CsCl的晶体结构 干冰的晶体结构 SiO2晶体结构 金刚石晶体结构 石墨晶体结构俯视 二、根据晶体结构或晶胞结构示意图推断晶体的化学式 1.石墨是层状晶体,每一层内碳原子排列成正六边形,一个个正六边形排列成平面网状结构,如果将每对相邻碳原子间的短线看成一个化学键,则石墨晶体中每一层内碳原子数与C—C键数的比是( )
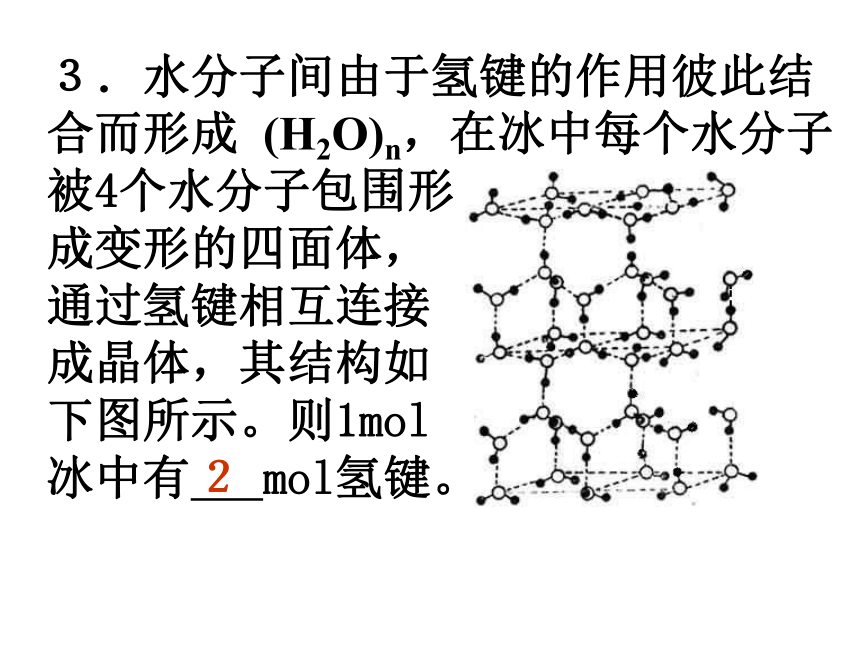
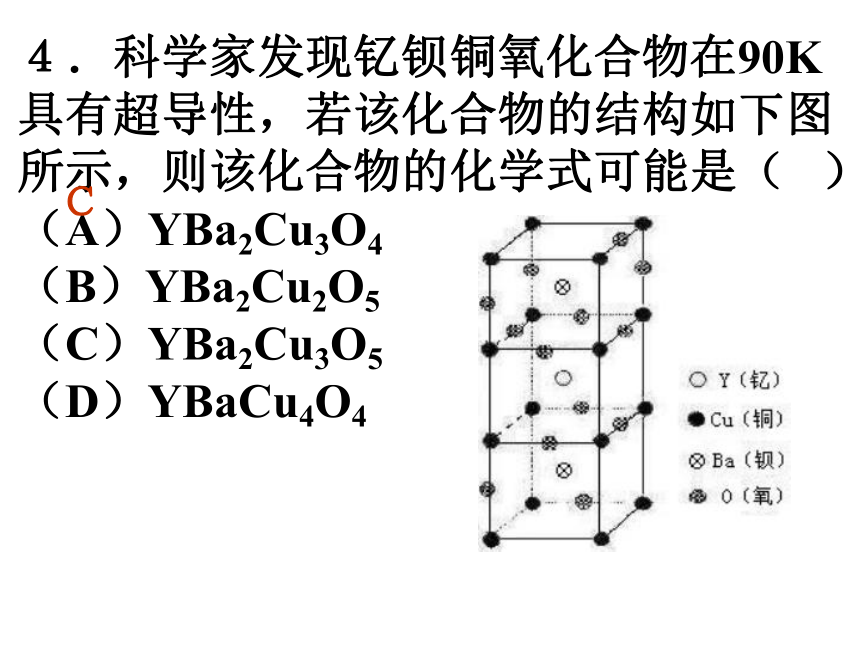
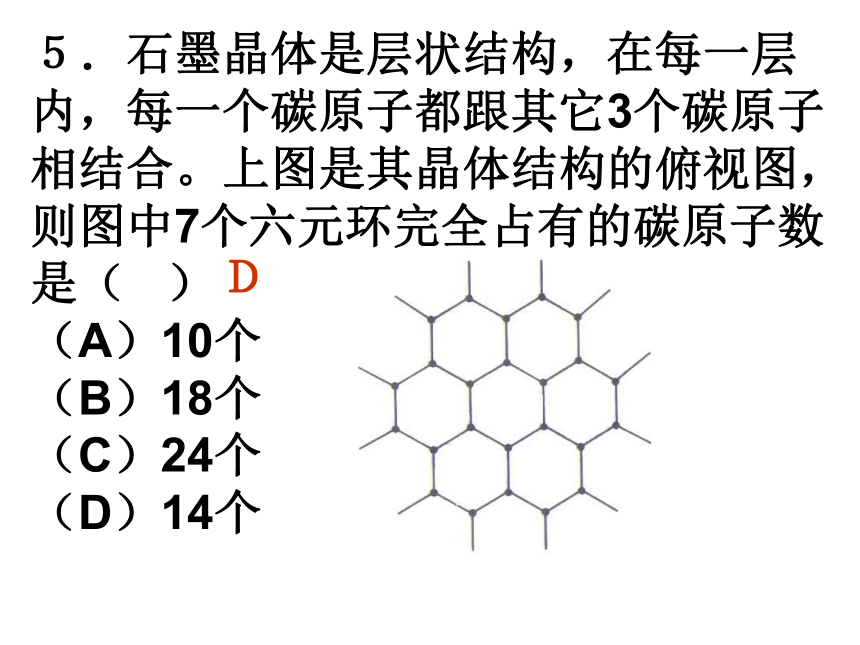
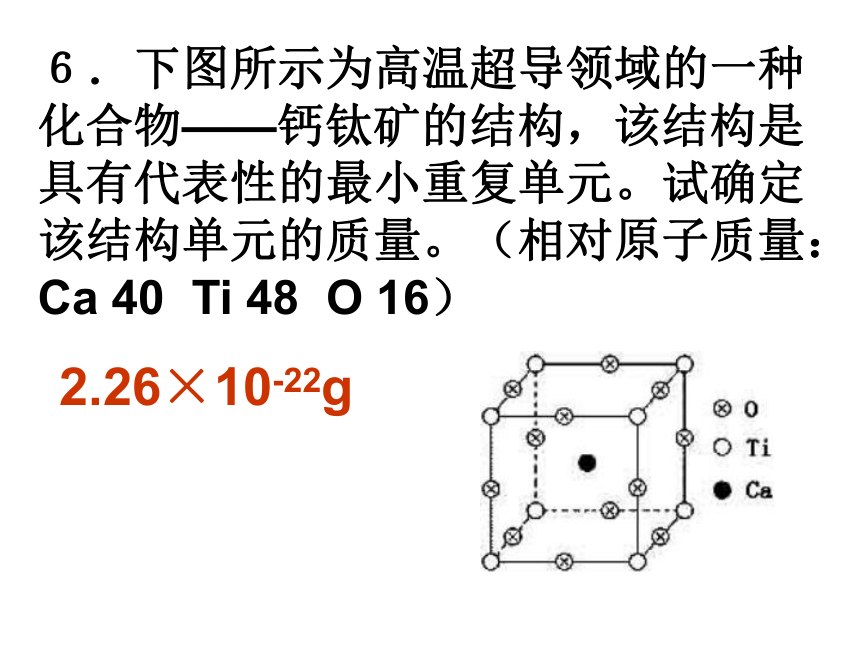
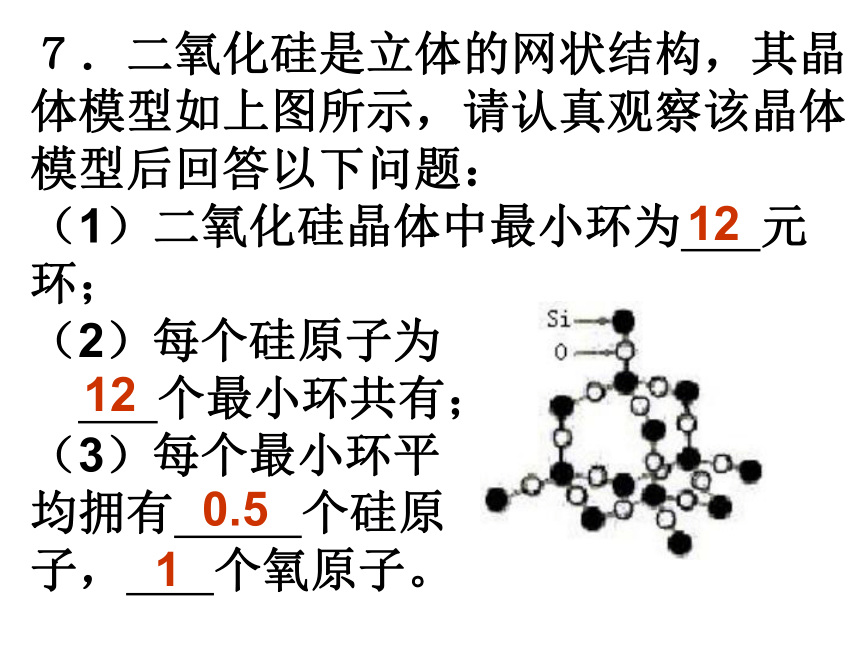
(A)2∶3 (B)1∶3 (C)1∶1 (D)1∶2A2.最近发现一种由钛原子和碳原子构成的气态团簇分子(如图所示),顶角和面心的原子是 钛原子,棱的中心和 体心的原子是碳原子, 它的化学式是 。Ti14C13 3.水分子间由于氢键的作用彼此结合而形成 (H2O)n,在冰中每个水分子被4个水分子包围形 成变形的四面体, 通过氢键相互连接 成晶体,其结构如 下图所示。则1mol 冰中有 mol氢键。 24.科学家发现钇钡铜氧化合物在90K具有超导性,若该化合物的结构如下图所示,则该化合物的化学式可能是( ) (A)YBa2Cu3O4 (B)YBa2Cu2O5 (C)YBa2Cu3O5 (D)YBaCu4O4 C5.石墨晶体是层状结构,在每一层内,每一个碳原子都跟其它3个碳原子相结合。上图是其晶体结构的俯视图,则图中7个六元环完全占有的碳原子数是( ) (A)10个 (B)18个 (C)24个 (D)14个D6.下图所示为高温超导领域的一种化合物——钙钛矿的结构,该结构是具有代表性的最小重复单元。试确定该结构单元的质量。(相对原子质量:Ca 40 Ti 48 O 16) 2.26×10-22g 7.二氧化硅是立体的网状结构,其晶体模型如上图所示,请认真观察该晶体模型后回答以下问题: (1)二氧化硅晶体中最小环为 元环; (2)每个硅原子为 个最小环共有; (3)每个最小环平 均拥有 个硅原 子, 个氧原子。 12120.51三、晶胞结构与晶体密度的计算8.如图是CsCl晶体的晶胞(晶体中最小重复单元),已知晶体中两个最近的Cs+ 核间距为a cm,氯化铯的式量为M,NA为阿伏加德罗常数,则氯化铯晶体的密度为 .
四、分子内或晶体中化学键数目及多面体面数等的计算 9.德国和美国科学家首次制造出了由20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成的(如右图所示)。请回答:
C20分子中共有 个
正五边形,共有 条
棱边。C20晶体属于
(填晶体类型)。1230分子晶体10.已知晶体硼的基本结构单元是由硼原子组成的正二十面体(如下图)。其中有二十个等边三角形的面和一定数目的顶点,每个 顶点各有一个硼原 子,则这个基本结 构单元由 个硼原 子构成,共含有 个 B—B键。 1230五、综合性试题分析 11.在离子晶体中,阴、阳离子按一定规律在空间排列,下图(a)是NaCl的晶体结构,在离子晶体中,阴、阳离子具有或近似具有球形对称结构,它们可以被看作是不等径的刚性圆球,并彼此相切如NaCl晶体结构图(b),已知a为常数。(1)在NaCl晶体中,每个Na+ 同时吸引 个Clˉ;Na+ 数目和Clˉ数目之比为 ; (2)Na+ 半径与Clˉ半径之比= (已知 =1.414); 61︰10.414 (3)NaCl晶体中不存在分子,但在1.013×105Pa,1413℃时,NaCl晶体形成气体,并以分子形式存在。现有29.25克NaCl晶体,在1.013×105Pa时强热使温度达到1501.5℃,测得气体体积为36.4L,试应用有关物理、化学知识计算此时氯化钠气体的分子式 Na2Cl2 (4)若a=5.6×10-8cm,求NaCl晶体的密度(已知5.6 3=175.6,NaCl的摩尔质量为58.5g·mol-1)。 12.某离子晶体晶胞结构如右图所示,X位于立方体的顶点,Y位于立方体的中心,试回答: (1)晶体中每个Y同 时吸引着 个X,每 个X同时吸引着 个 Y,该晶体的化学式为 。 (2)晶体中在每个X周围与它最接近且距离相等的X共有 个。 48XY2或Y2X 12 (3)晶体中距离最近的2个X与一个Y形成的夹角(∠XYX)为(填角的度数) 。 (4)设该晶体的摩尔 质量为M g·mol-1,晶 体密度为ρg·cm-3, 阿伏加德罗常数为NA, 则晶体中两个距离最近的X中心间的距离为 cm。109°28′ 13.根据石墨晶体结构示意图及提供的数据计算(保留三位有效数字)。有关公式、数据见框图。 (1)12g石墨中,正六边形的数目有多少? (2)求石墨的密度。 (3)求12g石墨的体积 (cm3)。 3.01×1023 2.28g·cm-3 5.26
(A)2∶3 (B)1∶3 (C)1∶1 (D)1∶2A2.最近发现一种由钛原子和碳原子构成的气态团簇分子(如图所示),顶角和面心的原子是 钛原子,棱的中心和 体心的原子是碳原子, 它的化学式是 。Ti14C13 3.水分子间由于氢键的作用彼此结合而形成 (H2O)n,在冰中每个水分子被4个水分子包围形 成变形的四面体, 通过氢键相互连接 成晶体,其结构如 下图所示。则1mol 冰中有 mol氢键。 24.科学家发现钇钡铜氧化合物在90K具有超导性,若该化合物的结构如下图所示,则该化合物的化学式可能是( ) (A)YBa2Cu3O4 (B)YBa2Cu2O5 (C)YBa2Cu3O5 (D)YBaCu4O4 C5.石墨晶体是层状结构,在每一层内,每一个碳原子都跟其它3个碳原子相结合。上图是其晶体结构的俯视图,则图中7个六元环完全占有的碳原子数是( ) (A)10个 (B)18个 (C)24个 (D)14个D6.下图所示为高温超导领域的一种化合物——钙钛矿的结构,该结构是具有代表性的最小重复单元。试确定该结构单元的质量。(相对原子质量:Ca 40 Ti 48 O 16) 2.26×10-22g 7.二氧化硅是立体的网状结构,其晶体模型如上图所示,请认真观察该晶体模型后回答以下问题: (1)二氧化硅晶体中最小环为 元环; (2)每个硅原子为 个最小环共有; (3)每个最小环平 均拥有 个硅原 子, 个氧原子。 12120.51三、晶胞结构与晶体密度的计算8.如图是CsCl晶体的晶胞(晶体中最小重复单元),已知晶体中两个最近的Cs+ 核间距为a cm,氯化铯的式量为M,NA为阿伏加德罗常数,则氯化铯晶体的密度为 .
四、分子内或晶体中化学键数目及多面体面数等的计算 9.德国和美国科学家首次制造出了由20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成的(如右图所示)。请回答:
C20分子中共有 个
正五边形,共有 条
棱边。C20晶体属于
(填晶体类型)。1230分子晶体10.已知晶体硼的基本结构单元是由硼原子组成的正二十面体(如下图)。其中有二十个等边三角形的面和一定数目的顶点,每个 顶点各有一个硼原 子,则这个基本结 构单元由 个硼原 子构成,共含有 个 B—B键。 1230五、综合性试题分析 11.在离子晶体中,阴、阳离子按一定规律在空间排列,下图(a)是NaCl的晶体结构,在离子晶体中,阴、阳离子具有或近似具有球形对称结构,它们可以被看作是不等径的刚性圆球,并彼此相切如NaCl晶体结构图(b),已知a为常数。(1)在NaCl晶体中,每个Na+ 同时吸引 个Clˉ;Na+ 数目和Clˉ数目之比为 ; (2)Na+ 半径与Clˉ半径之比= (已知 =1.414); 61︰10.414 (3)NaCl晶体中不存在分子,但在1.013×105Pa,1413℃时,NaCl晶体形成气体,并以分子形式存在。现有29.25克NaCl晶体,在1.013×105Pa时强热使温度达到1501.5℃,测得气体体积为36.4L,试应用有关物理、化学知识计算此时氯化钠气体的分子式 Na2Cl2 (4)若a=5.6×10-8cm,求NaCl晶体的密度(已知5.6 3=175.6,NaCl的摩尔质量为58.5g·mol-1)。 12.某离子晶体晶胞结构如右图所示,X位于立方体的顶点,Y位于立方体的中心,试回答: (1)晶体中每个Y同 时吸引着 个X,每 个X同时吸引着 个 Y,该晶体的化学式为 。 (2)晶体中在每个X周围与它最接近且距离相等的X共有 个。 48XY2或Y2X 12 (3)晶体中距离最近的2个X与一个Y形成的夹角(∠XYX)为(填角的度数) 。 (4)设该晶体的摩尔 质量为M g·mol-1,晶 体密度为ρg·cm-3, 阿伏加德罗常数为NA, 则晶体中两个距离最近的X中心间的距离为 cm。109°28′ 13.根据石墨晶体结构示意图及提供的数据计算(保留三位有效数字)。有关公式、数据见框图。 (1)12g石墨中,正六边形的数目有多少? (2)求石墨的密度。 (3)求12g石墨的体积 (cm3)。 3.01×1023 2.28g·cm-3 5.26
