晶体结构[下学期]
图片预览









文档简介
课件43张PPT。晶 体 结 构晶体的概念什么叫晶体?
决定晶体物理性质的因素是什么?通过结晶过程形成的具有规则几何外形的固体叫晶体。
晶体中的微粒按一定的规则排列。
构成晶体微粒之间的结合力。
结合力越强,晶体的熔沸点越高,晶体的硬度越大。构成晶体的基本微粒和作用力阴阳离子
分子
原子阴阳离子间以离子键结合,形成离子晶体。
分子间以分子间作用力(又称范德华力)
结合,形成 分子晶体。
所有原子间以共价键结合,形成原子晶体。分子间作用力(范德华力)分子间存在作用力的事实:
由分子构成的物质,在一定条件下能发生三态变化,说明分子间存在作用力。
分子间作用力与化学键的区别:
化学键存在于原子之间(即分子之内),而分子间作用力显然是在“分子之间”。
强度:化学键的键能为200~800kJ/mol,而分子间作用力只有几到几十kJ/mol。 分子晶体 原子晶体 离子晶体氢键离子晶体什么叫离子晶体?
离子晶体的特点?
哪些物质属于离子晶体?
离子间通过离子键结合而成的晶体。
无单个分子存在;NaCl不表示分子式。
熔沸点较高,硬度较大,难挥发难压缩。
水溶液或者熔融状态下均导电。
强碱、部分金属氧化物、部分盐类。Na ClCs Cl熔 点硬 度 分子晶体 原子晶体分子晶体什么叫分子晶体?
分子晶体的特点?
哪些物质可以形成分子晶体?
分子间通过分子间作用力结合成的晶体。
有单个分子存在;化学式就是分子式。
熔沸点较低,硬度较小,易升华。
非金属单质、稀有气体、非金属氢化物、非金属氧化物等。干冰1干冰2熔 点 原子晶体 离子晶体原子晶体什么叫原子晶体?
原子晶体的特点?
哪些物质属于原子晶体?
原子间通过共价键结合成的具有空间网状结构的晶体。
熔沸点很高,硬度很大,难溶于一般溶剂。
金刚石、单晶硅、碳化硅、二氧化硅 金刚石熔 点硬 度 离子晶体 分子晶体石 墨共价键的键能与半径有关,半径越大,键能越小。 C—C > C– Si >Si—Si 石墨石墨为什么很软?
石墨的熔沸点为什么很高?石墨为层状结构,各层之间是范德华力结合,容易滑动,所以石墨很软。
石墨各层均为平面网状结构,碳原子之间存在很强的共价键,故熔沸点很高。
所以,石墨称为混合型晶体。 知识归纳—混合型晶体 石墨结构 一、金属共同的物理性质容易导电、导热、有延展性、有金属光泽等。二、金属的结构金属晶体组成粒子:
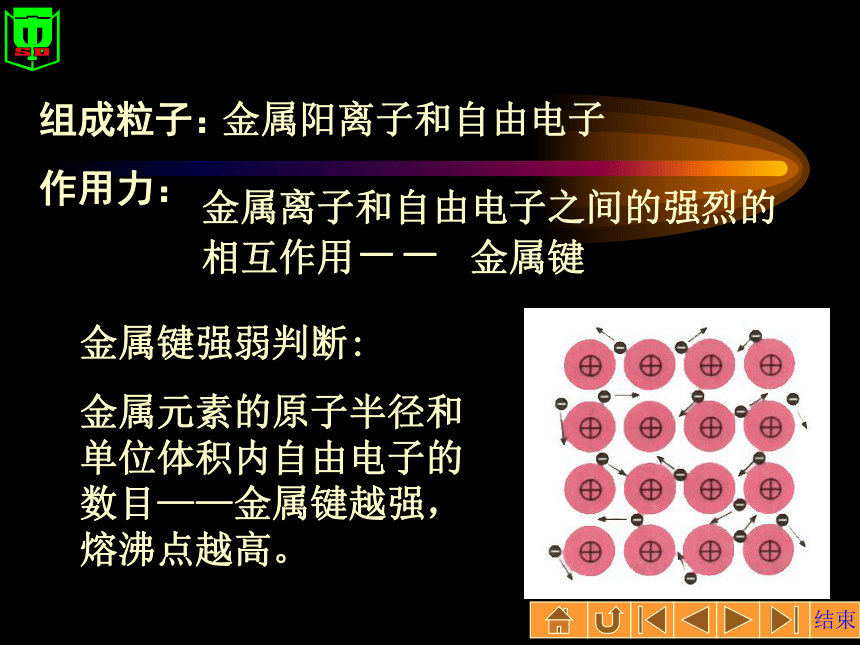
作用力:金属阳离子和自由电子金属离子和自由电子之间的强烈的相互作用-- 金属键金属键强弱判断:
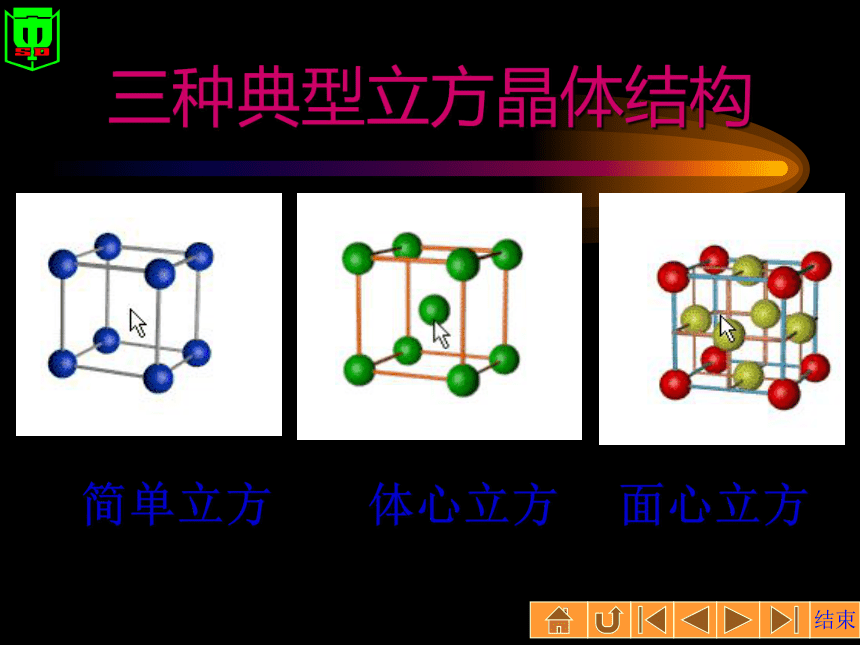
金属元素的原子半径和单位体积内自由电子的数目——金属键越强,熔沸点越高。三种典型立方晶体结构简单立方体心立方面心立方资料金属之最熔点最低的金属是--------汞熔点最高的金属是--------钨密度最小的金属是--------锂密度最大的金属是--------锇硬度最小的金属是--------铯硬度最大的金属是--------铬最活泼的金属是----------铯最稳定的金属是----------金延性最好的金属是--------铂展性最好的金属是--------金四种晶体类型与性质的比较资料 l克金子能拉成2400米长的金丝。 还可以把金子轧成特别薄的金箔,厚度只有1厘米的五十万分之一 晶体类型的判断从组成上判断(仅限于中学范围):
有无阴阳离子?(有:离子晶体)
是否属于“四种原子晶体”?
以上皆否定,则多数是分子晶体。
从性质上判断:
熔沸点和硬度;(高:原子晶体;中:离子晶体;低:分子晶体)
熔融状态的导电性。(导电:离子晶体) 开拓思考 结束课程 课堂训练课堂练习题下列不存在化学键的晶体是:
A.硝酸钾 B.干冰 C.石墨 D.固体氩
常温常压下的分子晶体是:
A.碘 B.水 C. 硫酸铵 D.干冰
晶体中的一个微粒周围有6个微粒,这种晶体是:
A.金刚石 B.石墨 C.干冰 D.氯化钠 结束课程 开拓思考 晶体判断讨论 2、 CO2和SiO2的一些物理性质如下表所示,通过比较判断SiO2晶体是否属于分子晶体。
熔 点 沸 点
干 冰(CO2) -56.2℃ -78.4℃
SiO2 1723℃ 2230℃1、比较碘晶体与溴晶体 冰与硫化氢晶体
的熔点,并解析原因。 结束课程 开拓思考 晶体判断开拓思考题仔细观察左边的示意图后,回答下列问题:
金刚石与石墨的熔点均很高,那么二者熔点是否相同?为什么?若不相同,哪种更高一些? 结束课程 课堂训练 晶体判断氯化钠的晶体结构 晶格扩展 回离子晶体 回离子晶体NaCl的晶体结构示意图氯化铯的晶体结构 回离子晶体 回离子晶体CsCl的晶体结构示意图三种典型立方晶体结构简单立方体心立方面心立方结束 返回原处干冰的晶体结构图 进一步研究 回分子晶体二氧化碳分子范德华力共价键干冰的晶体结构示意图 进一步研究 回分子晶体干冰晶体结构示意结束 回分子晶体由此可见,每个二氧化碳分子周围有12个二氧化碳分子。金刚石的晶体结构 回原子晶体 旋转模型金刚石晶体结构模型结束 回原子晶体109o28′金刚石的晶体结构示意图共价键 回原子晶体1、在金刚石的网状结构中, 其中最小的环上有______(填数字)个碳原子,每个碳原子上的任意两个C─C键的夹角都是________ (填角度)
2.金刚石结构中,一个碳原子与 个碳原子成键,
则每个碳原子实际形成的化学键为 个;
a mol金刚石中,碳碳键数为 mol。Sio二氧化硅的晶体结构示意图共价键 回原子晶体石墨的晶体结构 返回石墨石墨是层状结构的混合型晶体 返回石墨 2.分析石墨结构中碳原子数与碳碳键数目比。 三种晶体的熔点金刚石食 盐干 冰结束 返回原处晶体的硬度金刚石食 盐石 墨结束 返回原处氢键的形成 ⑴ 同种分子之间 ⑵ 不同种分子之间 氢键的形成 氢键形成的条件 ⑴与非金属性(电负性)很大的原子X 形成强极性键的氢原子
⑵ 较小半径、较大电负性、含孤电子对、带有部分负电荷的原子 X(F、O、N) 氢键的本质: 强极性键(X-H)上的氢核, 与另一分子上电负性很大的原子Y之间的静电引力。
⑶ 表示氢键结合的通式:可用X-H…Y表示。式中X
和Y代表F、O、N电负性大而原子半径较小的非金属原子。
X和Y可以是两种相同的元素,也可以是两种不同的元素。 氢键的强度 氢键的牢固程度──键强度也可以用键能来表示。粗略而言,氢键键能是指每拆开单位物质的量的H…Y键所需的能量。氢键的键能一般在42kJ·mol-1以下,比共价键的键能小得多,而与分子间力更为接近些。
如:H2O分子中 O-H 键的键能为463kJ·mol-1; O-H…O中氢键的键能为18.83 kJ·mol-1。 分子内氢键 某些分子内,例如HNO3、邻硝基苯酚分子可以形成分子内氢键。分子内氢键由于受环状结构的限制,X-H…Y往往不能在同一直线上。分子内氢键与分子间氢键的比较氢键形成对物质性质的影响熔点、沸点
溶解度 HF和HN3
粘度 例如甘油、磷酸、浓硫酸等
密度 常温下液态水中除了简单H2O分子外,还有(H2O)2,(H2O)3,…,(H2O)n等缔合分子存在。降低温度,有利于水分子的缔合。温度降至0℃时,全部水分子结成巨大的缔合物──冰。 分子晶体 原子晶体 离子晶体
决定晶体物理性质的因素是什么?通过结晶过程形成的具有规则几何外形的固体叫晶体。
晶体中的微粒按一定的规则排列。
构成晶体微粒之间的结合力。
结合力越强,晶体的熔沸点越高,晶体的硬度越大。构成晶体的基本微粒和作用力阴阳离子
分子
原子阴阳离子间以离子键结合,形成离子晶体。
分子间以分子间作用力(又称范德华力)
结合,形成 分子晶体。
所有原子间以共价键结合,形成原子晶体。分子间作用力(范德华力)分子间存在作用力的事实:
由分子构成的物质,在一定条件下能发生三态变化,说明分子间存在作用力。
分子间作用力与化学键的区别:
化学键存在于原子之间(即分子之内),而分子间作用力显然是在“分子之间”。
强度:化学键的键能为200~800kJ/mol,而分子间作用力只有几到几十kJ/mol。 分子晶体 原子晶体 离子晶体氢键离子晶体什么叫离子晶体?
离子晶体的特点?
哪些物质属于离子晶体?
离子间通过离子键结合而成的晶体。
无单个分子存在;NaCl不表示分子式。
熔沸点较高,硬度较大,难挥发难压缩。
水溶液或者熔融状态下均导电。
强碱、部分金属氧化物、部分盐类。Na ClCs Cl熔 点硬 度 分子晶体 原子晶体分子晶体什么叫分子晶体?
分子晶体的特点?
哪些物质可以形成分子晶体?
分子间通过分子间作用力结合成的晶体。
有单个分子存在;化学式就是分子式。
熔沸点较低,硬度较小,易升华。
非金属单质、稀有气体、非金属氢化物、非金属氧化物等。干冰1干冰2熔 点 原子晶体 离子晶体原子晶体什么叫原子晶体?
原子晶体的特点?
哪些物质属于原子晶体?
原子间通过共价键结合成的具有空间网状结构的晶体。
熔沸点很高,硬度很大,难溶于一般溶剂。
金刚石、单晶硅、碳化硅、二氧化硅 金刚石熔 点硬 度 离子晶体 分子晶体石 墨共价键的键能与半径有关,半径越大,键能越小。 C—C > C– Si >Si—Si 石墨石墨为什么很软?
石墨的熔沸点为什么很高?石墨为层状结构,各层之间是范德华力结合,容易滑动,所以石墨很软。
石墨各层均为平面网状结构,碳原子之间存在很强的共价键,故熔沸点很高。
所以,石墨称为混合型晶体。 知识归纳—混合型晶体 石墨结构 一、金属共同的物理性质容易导电、导热、有延展性、有金属光泽等。二、金属的结构金属晶体组成粒子:
作用力:金属阳离子和自由电子金属离子和自由电子之间的强烈的相互作用-- 金属键金属键强弱判断:
金属元素的原子半径和单位体积内自由电子的数目——金属键越强,熔沸点越高。三种典型立方晶体结构简单立方体心立方面心立方资料金属之最熔点最低的金属是--------汞熔点最高的金属是--------钨密度最小的金属是--------锂密度最大的金属是--------锇硬度最小的金属是--------铯硬度最大的金属是--------铬最活泼的金属是----------铯最稳定的金属是----------金延性最好的金属是--------铂展性最好的金属是--------金四种晶体类型与性质的比较资料 l克金子能拉成2400米长的金丝。 还可以把金子轧成特别薄的金箔,厚度只有1厘米的五十万分之一 晶体类型的判断从组成上判断(仅限于中学范围):
有无阴阳离子?(有:离子晶体)
是否属于“四种原子晶体”?
以上皆否定,则多数是分子晶体。
从性质上判断:
熔沸点和硬度;(高:原子晶体;中:离子晶体;低:分子晶体)
熔融状态的导电性。(导电:离子晶体) 开拓思考 结束课程 课堂训练课堂练习题下列不存在化学键的晶体是:
A.硝酸钾 B.干冰 C.石墨 D.固体氩
常温常压下的分子晶体是:
A.碘 B.水 C. 硫酸铵 D.干冰
晶体中的一个微粒周围有6个微粒,这种晶体是:
A.金刚石 B.石墨 C.干冰 D.氯化钠 结束课程 开拓思考 晶体判断讨论 2、 CO2和SiO2的一些物理性质如下表所示,通过比较判断SiO2晶体是否属于分子晶体。
熔 点 沸 点
干 冰(CO2) -56.2℃ -78.4℃
SiO2 1723℃ 2230℃1、比较碘晶体与溴晶体 冰与硫化氢晶体
的熔点,并解析原因。 结束课程 开拓思考 晶体判断开拓思考题仔细观察左边的示意图后,回答下列问题:
金刚石与石墨的熔点均很高,那么二者熔点是否相同?为什么?若不相同,哪种更高一些? 结束课程 课堂训练 晶体判断氯化钠的晶体结构 晶格扩展 回离子晶体 回离子晶体NaCl的晶体结构示意图氯化铯的晶体结构 回离子晶体 回离子晶体CsCl的晶体结构示意图三种典型立方晶体结构简单立方体心立方面心立方结束 返回原处干冰的晶体结构图 进一步研究 回分子晶体二氧化碳分子范德华力共价键干冰的晶体结构示意图 进一步研究 回分子晶体干冰晶体结构示意结束 回分子晶体由此可见,每个二氧化碳分子周围有12个二氧化碳分子。金刚石的晶体结构 回原子晶体 旋转模型金刚石晶体结构模型结束 回原子晶体109o28′金刚石的晶体结构示意图共价键 回原子晶体1、在金刚石的网状结构中, 其中最小的环上有______(填数字)个碳原子,每个碳原子上的任意两个C─C键的夹角都是________ (填角度)
2.金刚石结构中,一个碳原子与 个碳原子成键,
则每个碳原子实际形成的化学键为 个;
a mol金刚石中,碳碳键数为 mol。Sio二氧化硅的晶体结构示意图共价键 回原子晶体石墨的晶体结构 返回石墨石墨是层状结构的混合型晶体 返回石墨 2.分析石墨结构中碳原子数与碳碳键数目比。 三种晶体的熔点金刚石食 盐干 冰结束 返回原处晶体的硬度金刚石食 盐石 墨结束 返回原处氢键的形成 ⑴ 同种分子之间 ⑵ 不同种分子之间 氢键的形成 氢键形成的条件 ⑴与非金属性(电负性)很大的原子X 形成强极性键的氢原子
⑵ 较小半径、较大电负性、含孤电子对、带有部分负电荷的原子 X(F、O、N) 氢键的本质: 强极性键(X-H)上的氢核, 与另一分子上电负性很大的原子Y之间的静电引力。
⑶ 表示氢键结合的通式:可用X-H…Y表示。式中X
和Y代表F、O、N电负性大而原子半径较小的非金属原子。
X和Y可以是两种相同的元素,也可以是两种不同的元素。 氢键的强度 氢键的牢固程度──键强度也可以用键能来表示。粗略而言,氢键键能是指每拆开单位物质的量的H…Y键所需的能量。氢键的键能一般在42kJ·mol-1以下,比共价键的键能小得多,而与分子间力更为接近些。
如:H2O分子中 O-H 键的键能为463kJ·mol-1; O-H…O中氢键的键能为18.83 kJ·mol-1。 分子内氢键 某些分子内,例如HNO3、邻硝基苯酚分子可以形成分子内氢键。分子内氢键由于受环状结构的限制,X-H…Y往往不能在同一直线上。分子内氢键与分子间氢键的比较氢键形成对物质性质的影响熔点、沸点
溶解度 HF和HN3
粘度 例如甘油、磷酸、浓硫酸等
密度 常温下液态水中除了简单H2O分子外,还有(H2O)2,(H2O)3,…,(H2O)n等缔合分子存在。降低温度,有利于水分子的缔合。温度降至0℃时,全部水分子结成巨大的缔合物──冰。 分子晶体 原子晶体 离子晶体
