原子核外电子的排布[下学期]
图片预览





文档简介
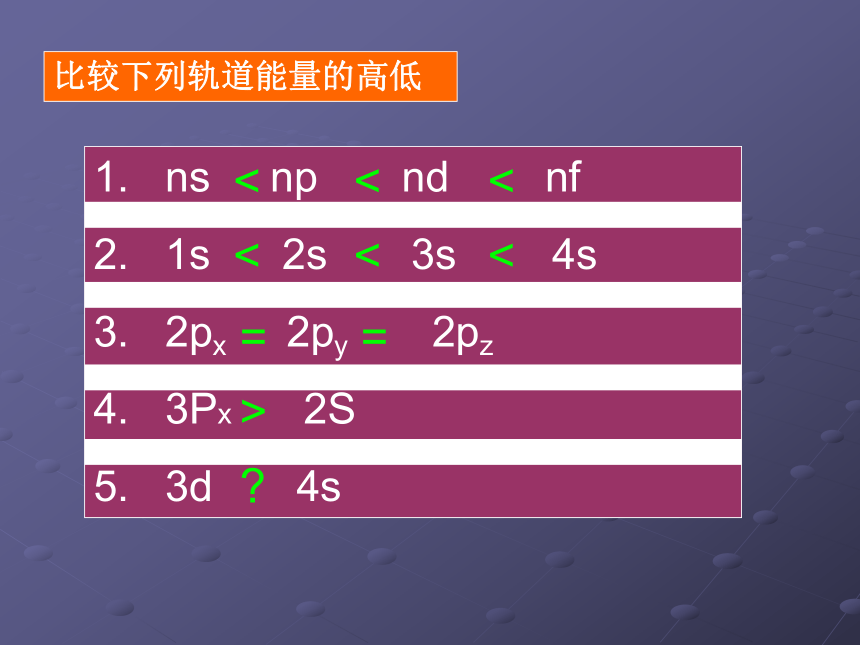
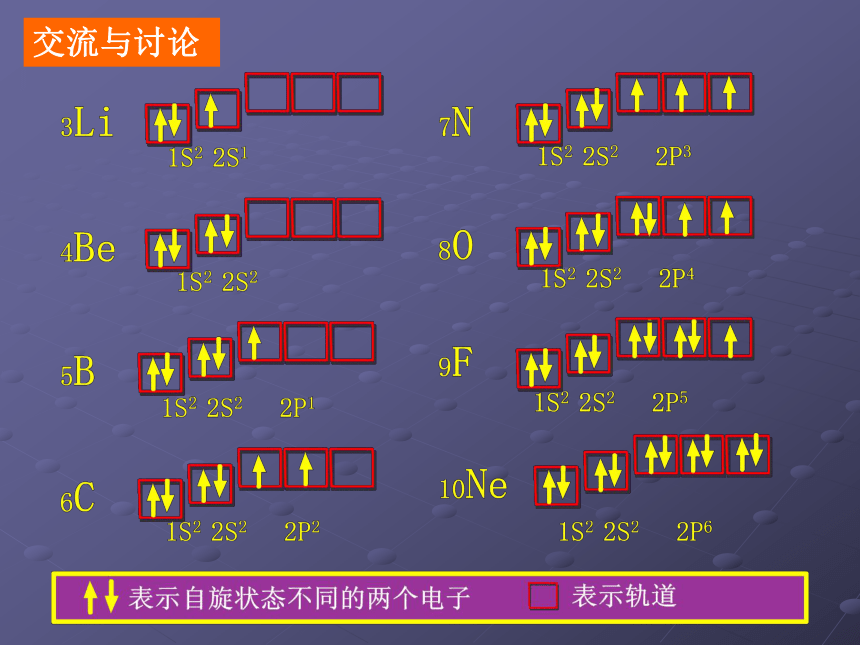
课件17张PPT。原子核外电子的排布实验中学 朱广美丽的烟火和激光 跟原子的结构有何关系呢?氦被称为太阳元素,因为最初是从太阳上发现的, 又是如何发现的呢?内容回顾:比较下列轨道能量的高低< < << < <= = >?原子核外电子排布的轨道能量顺序 交流与讨论 原子核外电子的排布所遵循的原理:1、能量最低原理
电子先占据能量低的轨道,再依次进入能量高的轨道2、泡利不相容原理
每个轨道最多容纳两个自旋状态不同的电子3、洪特规则
在能量相同的轨道上排布时,电子尽可能分占不同的轨
道,且自旋状态相同下列关于氮原子的轨道表示式是否正确,为什么?思考与探索:交流与讨论1、写出 11Na、13Al的电子排布式和轨道表示式,思考17Cl原子核外电子的排布,总结第三周期元素原子核外电子排布的特点2、写出19K、22Ti、24Cr的电子排布式的简式和轨道表示式,思考35Br原子的电子排布,总结第四周期元素原子电子排布的特点,并仔细对照周期表,观察是否所有原子电子排布都符合前面的排布规律 对于能量相同的轨道(同一电子亚层),当电子排布处于全满(s2、p6、d10、f14)、半满(s1、p3、d5、f7)、全空(s0、p0、d0、f0)时比较稳定,整个体系的能量最低。 洪特规则的特例:原子核外电子的排布原子核外电子在具有确定能量的轨道上运动,当原子不受外界影响时,电子既不吸收也不放出能量。
不同的原子轨道具有不同的能量,轨道能量的变化是不连续的,即量子化的。
(3)当电子吸收了能量(如光能、热能等),就会从从能量较低的轨道跃迁到能量较高的轨道上。处于能量较高轨道的电子不稳定,会回到能量较低的轨道上,当电子从能量较高的(E2)轨道跃迁到能量较低的(E0)轨道时发射出光子,发出光的波长取决于两个轨道的能量差。原子光谱原理原子发射光谱原子吸收光谱锂、氦、汞的发射与吸收光谱练习与实践1. 分析下列两种核外电子的排布是否正确?
A.1s22s22p33s2 B.1s22s22p5
2.判断K原子电子排布式是否正确?
A. 1s22s22p63s23p63d1 B. 1s22s22p63s23p54s2
C. 1s22s22p63s23p64s1 D.[Ar] 4s1
3.某原子的第四电子层只有两个电子,则该原子第三电子层的电子数肯定为( )
A.8个 B.18个 C.8~18个 D.8~32个1.下列元素中,电子排布不正确的是( )
A.20Ca 4s2 B.24Cr 3d44s2
C.18Ar 3s23d6 D.28Ni 3d84s2
3.第四周期元素原子中未成对电子数最多可达( )
A.4个 B.5个 C.6个 D.7个
4.已知下列元素原子的外围电子构型为:
3s2; 3s23p3; 4s1; 4s24p1; 3d54s2,
它们分别属于第几周期?第几族?最高化合价是多少?
电子先占据能量低的轨道,再依次进入能量高的轨道2、泡利不相容原理
每个轨道最多容纳两个自旋状态不同的电子3、洪特规则
在能量相同的轨道上排布时,电子尽可能分占不同的轨
道,且自旋状态相同下列关于氮原子的轨道表示式是否正确,为什么?思考与探索:交流与讨论1、写出 11Na、13Al的电子排布式和轨道表示式,思考17Cl原子核外电子的排布,总结第三周期元素原子核外电子排布的特点2、写出19K、22Ti、24Cr的电子排布式的简式和轨道表示式,思考35Br原子的电子排布,总结第四周期元素原子电子排布的特点,并仔细对照周期表,观察是否所有原子电子排布都符合前面的排布规律 对于能量相同的轨道(同一电子亚层),当电子排布处于全满(s2、p6、d10、f14)、半满(s1、p3、d5、f7)、全空(s0、p0、d0、f0)时比较稳定,整个体系的能量最低。 洪特规则的特例:原子核外电子的排布原子核外电子在具有确定能量的轨道上运动,当原子不受外界影响时,电子既不吸收也不放出能量。
不同的原子轨道具有不同的能量,轨道能量的变化是不连续的,即量子化的。
(3)当电子吸收了能量(如光能、热能等),就会从从能量较低的轨道跃迁到能量较高的轨道上。处于能量较高轨道的电子不稳定,会回到能量较低的轨道上,当电子从能量较高的(E2)轨道跃迁到能量较低的(E0)轨道时发射出光子,发出光的波长取决于两个轨道的能量差。原子光谱原理原子发射光谱原子吸收光谱锂、氦、汞的发射与吸收光谱练习与实践1. 分析下列两种核外电子的排布是否正确?
A.1s22s22p33s2 B.1s22s22p5
2.判断K原子电子排布式是否正确?
A. 1s22s22p63s23p63d1 B. 1s22s22p63s23p54s2
C. 1s22s22p63s23p64s1 D.[Ar] 4s1
3.某原子的第四电子层只有两个电子,则该原子第三电子层的电子数肯定为( )
A.8个 B.18个 C.8~18个 D.8~32个1.下列元素中,电子排布不正确的是( )
A.20Ca 4s2 B.24Cr 3d44s2
C.18Ar 3s23d6 D.28Ni 3d84s2
3.第四周期元素原子中未成对电子数最多可达( )
A.4个 B.5个 C.6个 D.7个
4.已知下列元素原子的外围电子构型为:
3s2; 3s23p3; 4s1; 4s24p1; 3d54s2,
它们分别属于第几周期?第几族?最高化合价是多少?
