元素周期律[下学期]
图片预览


文档简介
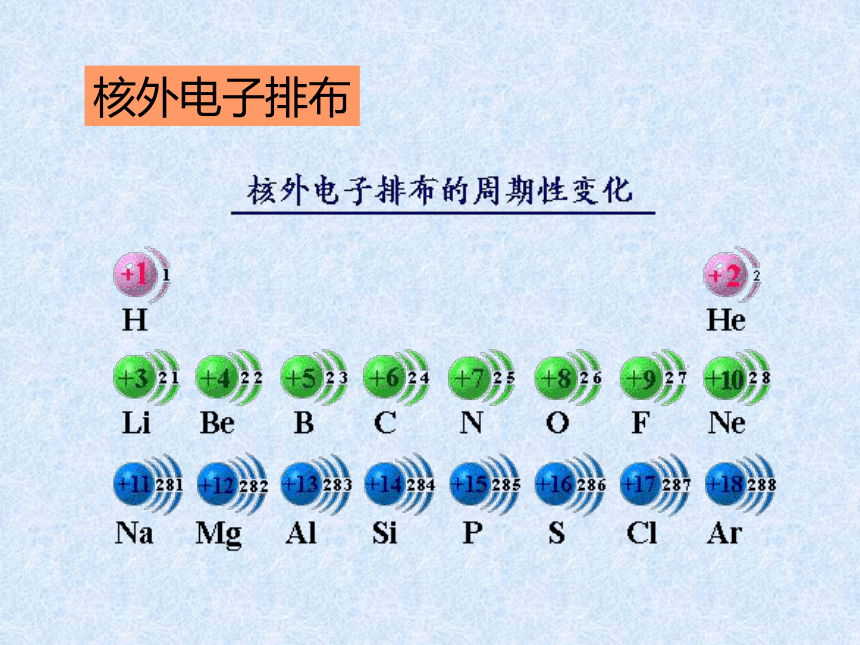
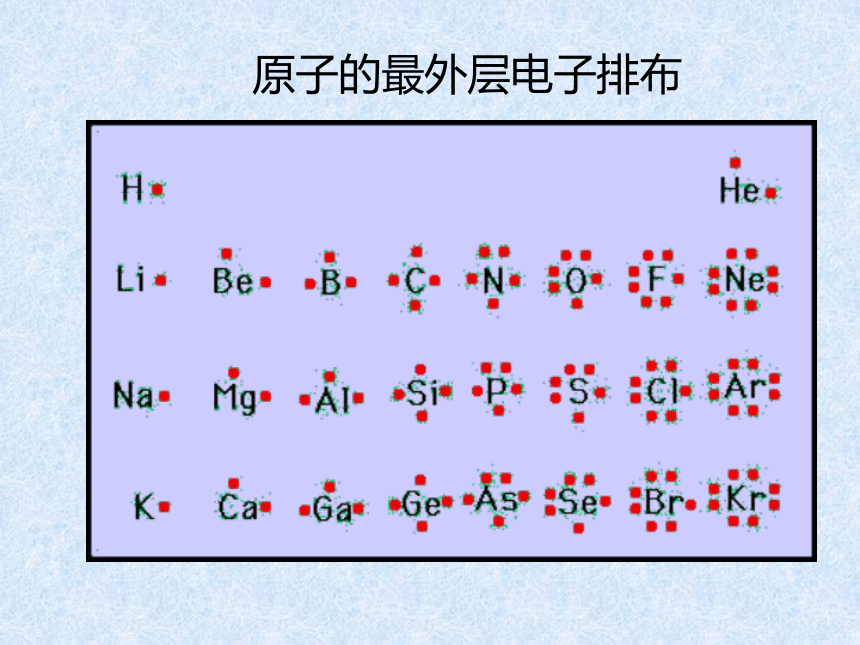
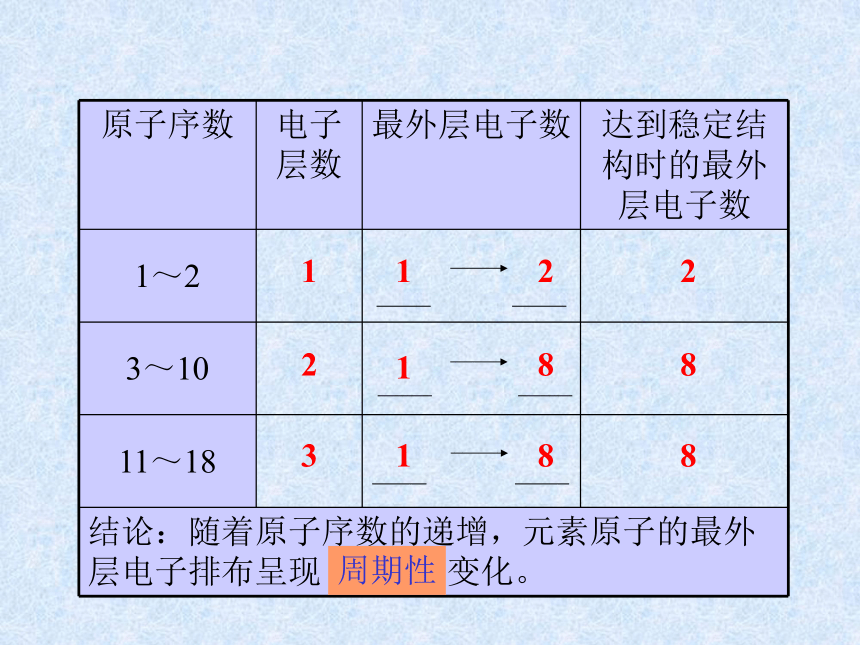
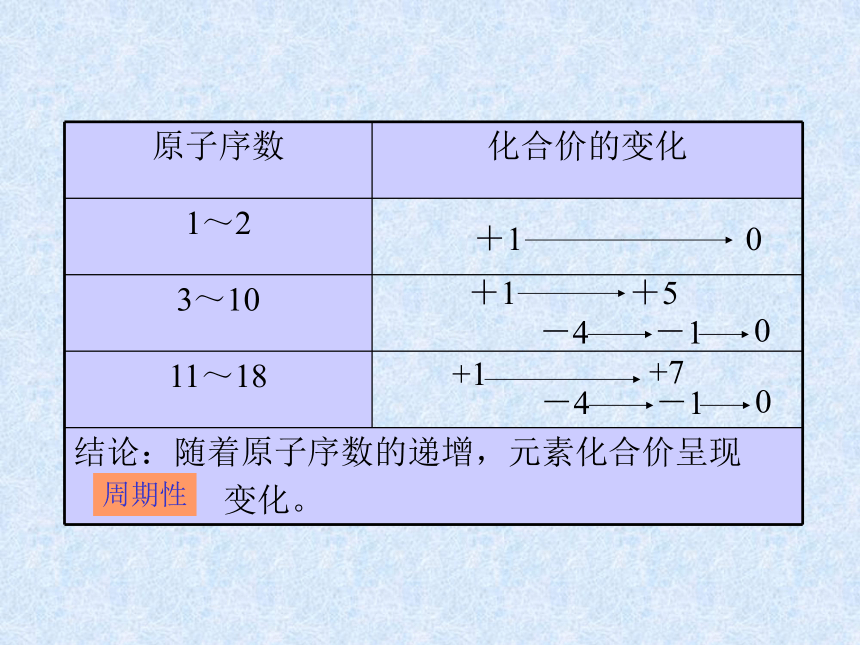
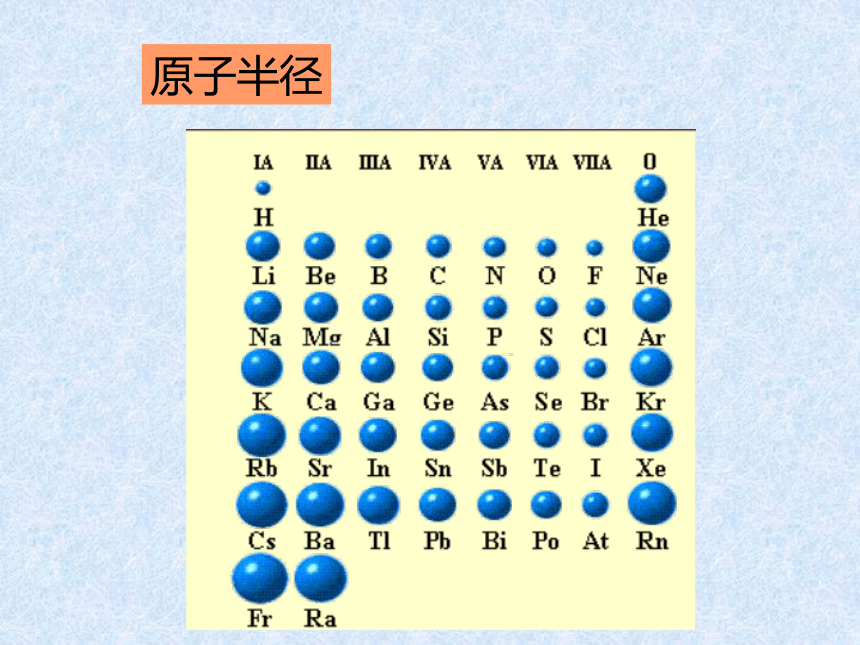
课件14张PPT。元素周期律第二课时核外电子排布 原子的最外层电子排布1122周期性21883188元素化合价周期性+10+1+5-4-10-4-10原子半径逐渐减小逐渐减小周期性 通过上面的讨论,我们知道,
随着原子序数的递增,元素的
电子层排布、原子半径及化合
价都呈现周期性变化。判断依据跟冷水剧
烈反应NaOH强碱跟沸水反应
放H2;跟酸
剧烈反应放
H2Mg(OH)2
中强碱跟酸较为
迅速反应
放H2Al(OH)3
两性
氢氧化物结论:金属性 Na>Mg>AlSiO2P2O5SO3Cl2O7H4SiO4H3PO4H2SO4HClO4弱酸中强酸强酸最强酸高温加热加热点燃或光照SiH4PH3H2SHCl非金属性逐渐增强11~18号元素性质的变化中得出如下的结论:课本:P18,2、3元素的性质随着元素原子序数的递增
而呈周期性的变化。这个规律叫做元
素周期律。元素性质的周期性变化是元素原子的核
外电子排布的周期性变化的必然结果。
随着原子序数的递增,元素的
电子层排布、原子半径及化合
价都呈现周期性变化。判断依据跟冷水剧
烈反应NaOH强碱跟沸水反应
放H2;跟酸
剧烈反应放
H2Mg(OH)2
中强碱跟酸较为
迅速反应
放H2Al(OH)3
两性
氢氧化物结论:金属性 Na>Mg>AlSiO2P2O5SO3Cl2O7H4SiO4H3PO4H2SO4HClO4弱酸中强酸强酸最强酸高温加热加热点燃或光照SiH4PH3H2SHCl非金属性逐渐增强11~18号元素性质的变化中得出如下的结论:课本:P18,2、3元素的性质随着元素原子序数的递增
而呈周期性的变化。这个规律叫做元
素周期律。元素性质的周期性变化是元素原子的核
外电子排布的周期性变化的必然结果。
