核外电子排布[下学期]
图片预览



文档简介
课件16张PPT。第一单元
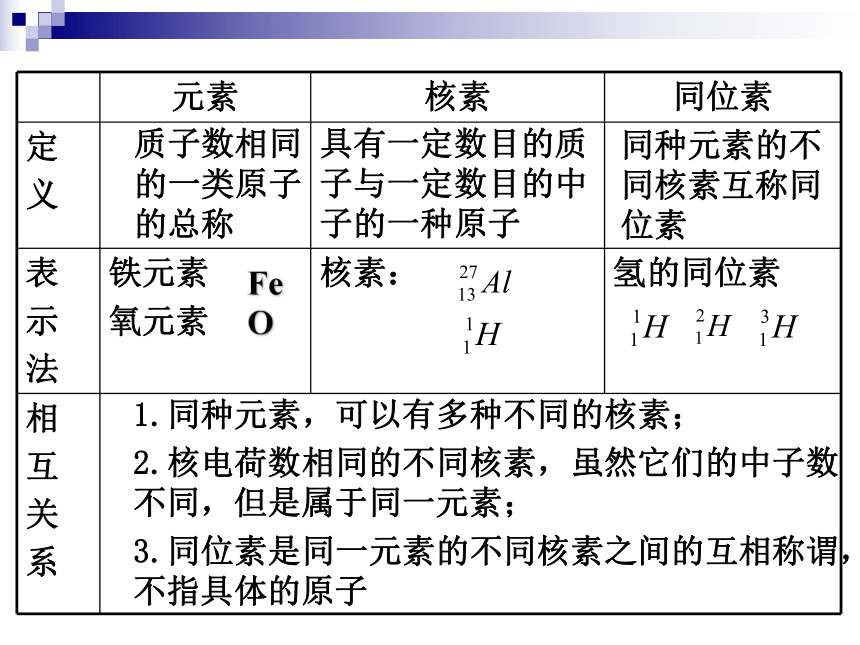
核外电子排布与周期律质子数相同的一类原子的总称具有一定数目的质子与一定数目的中子的一种原子同种元素的不同核素互称同位素
Fe O1.同种元素,可以有多种不同的核素;
2.核电荷数相同的不同核素,虽然它们的中子数不同,但是属于同一元素;
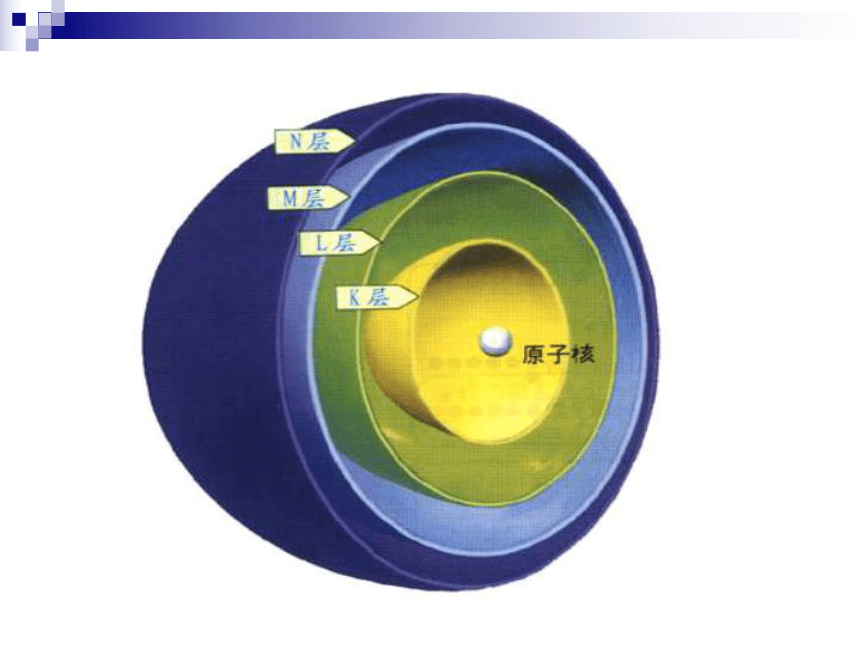
3.同位素是同一元素的不同核素之间的互相称谓,不指具体的原子一、原子核外电子的排布原子核外电子能量的高低与电子层的关系核外电子的排布规律
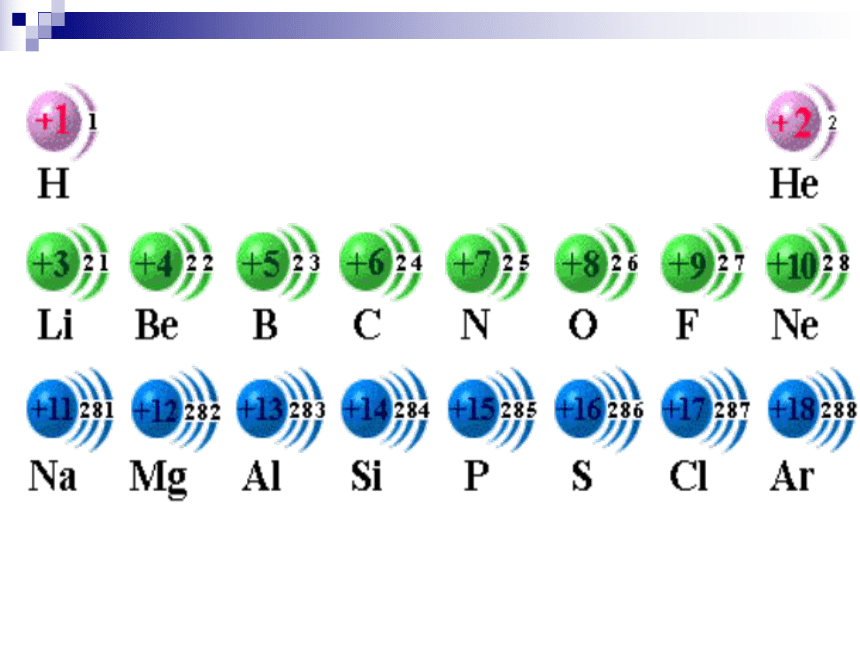
(1)各电子层最多容纳的电子数目为2n2。
(2)最外层不超过8个电子(K层不超过2)。
(3)次外层电子数目不超过18个,
倒数第三层电子数目不超过32个。
(4)核外电子总是尽先排布在能量最低电
子层里,然后由里到外,依次排布在
能量逐步升高的电子层里。
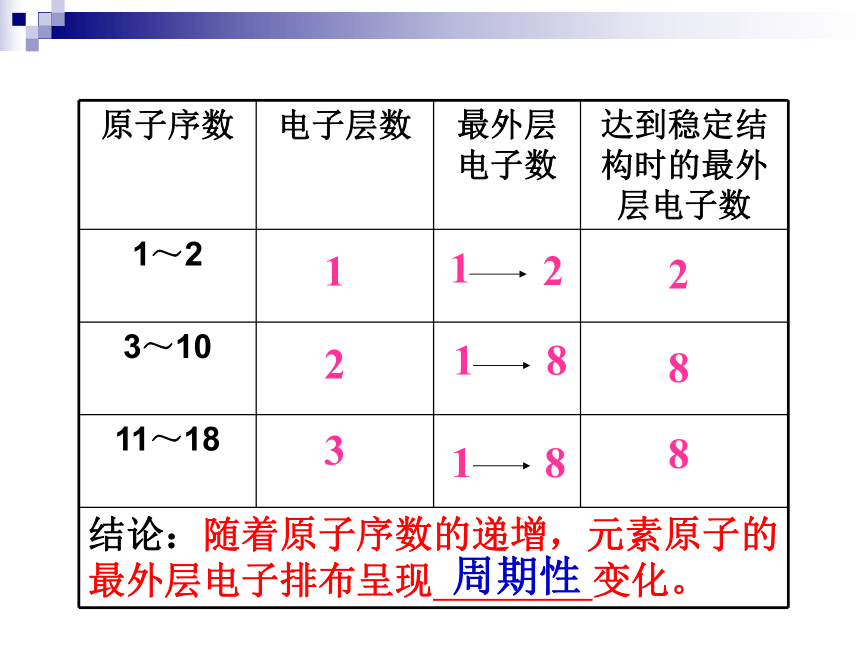
123882周期性原子半径逐渐减小逐渐减小周期性元素的化合价结论:随着原子序数的递增,元素化合价呈现 变化。
周期性冷水剧烈热水较快一般强碱中强碱 ?不反应较剧烈剧烈两性碱元素的化学性质SiO2P2O5SO3Cl2O7H4SiO4H3PO4H2SO4HClO4弱酸中强酸强酸最强酸高温加热加热点燃或光照SiH4PH3H2SHCl非金属性逐渐增强判断依据 元素金属性 元素单质与酸反应的难易 元素单质与水反应的难易元素的最高价氧化物的水化物的碱性强弱元素最高价氧化物的水化物的酸性强弱元素单质与氢气反应的难易 气态氢化物的稳定性 元素非金属性(易~强)(强~强)(易~强)(强~强)(易~强)(稳定~强)规 律
Fe O1.同种元素,可以有多种不同的核素;
2.核电荷数相同的不同核素,虽然它们的中子数不同,但是属于同一元素;
3.同位素是同一元素的不同核素之间的互相称谓,不指具体的原子一、原子核外电子的排布原子核外电子能量的高低与电子层的关系核外电子的排布规律
(1)各电子层最多容纳的电子数目为2n2。
(2)最外层不超过8个电子(K层不超过2)。
(3)次外层电子数目不超过18个,
倒数第三层电子数目不超过32个。
(4)核外电子总是尽先排布在能量最低电
子层里,然后由里到外,依次排布在
能量逐步升高的电子层里。
123882周期性原子半径逐渐减小逐渐减小周期性元素的化合价结论:随着原子序数的递增,元素化合价呈现 变化。
周期性冷水剧烈热水较快一般强碱中强碱 ?不反应较剧烈剧烈两性碱元素的化学性质SiO2P2O5SO3Cl2O7H4SiO4H3PO4H2SO4HClO4弱酸中强酸强酸最强酸高温加热加热点燃或光照SiH4PH3H2SHCl非金属性逐渐增强判断依据 元素金属性 元素单质与酸反应的难易 元素单质与水反应的难易元素的最高价氧化物的水化物的碱性强弱元素最高价氧化物的水化物的酸性强弱元素单质与氢气反应的难易 气态氢化物的稳定性 元素非金属性(易~强)(强~强)(易~强)(强~强)(易~强)(稳定~强)规 律
