离子晶体[下学期]
图片预览






文档简介
课件27张PPT。单元二 从微观结构看物质的多样性离子键
徐州高级中学 姚斌
2006.2.10思考:1.把水进行加热至1000 ℃时,只有大约不到1%的水能够分解成氢分子和氧分子;要想使氢分子分解成氢原子需要加热到温度高达2000℃,它的分解率仍不到1%,这些事实说明什么?
2.为什么水的分子式为H20而不是HO或H30?请从原子结构的角度说明为什么?化学键:物质中直接相邻的原子或离子之间强烈的相互作用,叫做化学键。直接相邻强烈按类型化学键可分为
离子键
共价键
金属键能量应大于120kJ.mol-11.离子键 因为氯化钠小颗粒悬浮在气体中呈白烟状 钠在氯气中剧烈燃烧,瓶中充满白烟。?从微观角度分析该反应
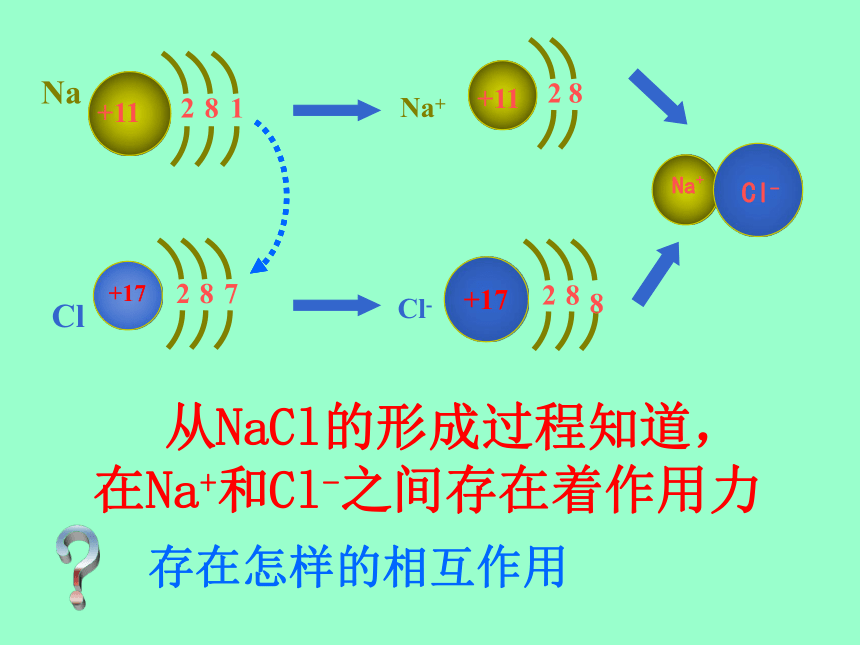
经历了怎样的变化过程 从NaCl的形成过程知道,
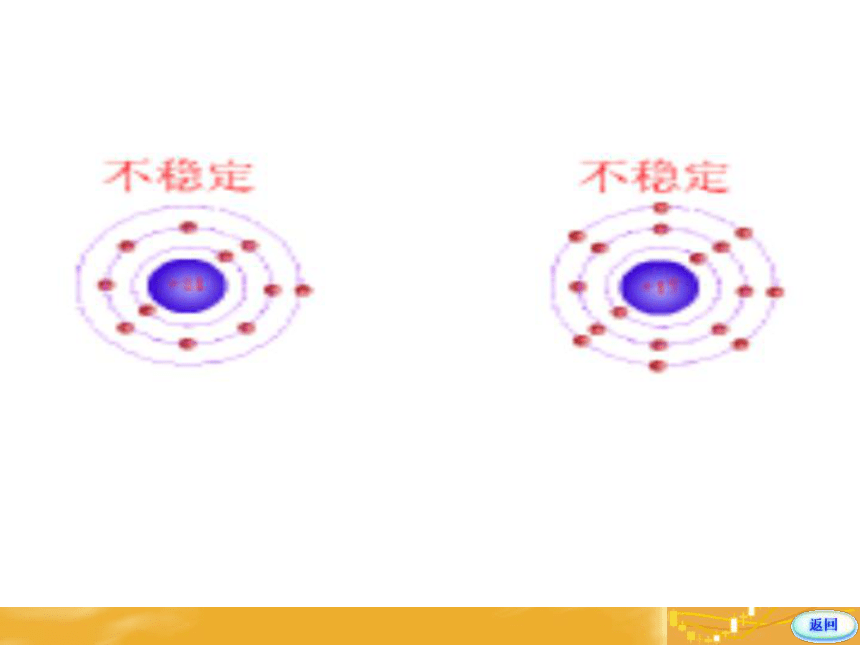
在Na+和Cl-之间存在着作用力?存在怎样的相互作用 Na和Cl发生反应,Na失去了一个电子,Cl就得到这个电子,双方都达到了8电子的稳定结构,形成了带正电荷的Na+ 和带负电荷的Cl-,Na+和Cl-之间有静电相互吸引作用;同时电子和电子之间、原子核和原子核之间有相互排斥作用。当两种离子接近到某一距离时,吸引作用和排斥作用达到平衡,于是,阴、阳离子之间就形成了稳定的键----离子键 一. 离子键
使阴、阳离子结合成化合物的静电作用。形成微粒:阴、阳离子形成本质:静电作用(吸引和排斥)4、哪些原子之间可能形成离子键?(成键元素)问题:想想,议议,说说1 、离子键形成的原因是什么?(成键条件)3、离子键中相互作用是什么?(成键作用力)2、形成离子键的微粒是什么?(成键微粒)电子得失形成阴、阳离子。阴、阳离子。静电作用。活泼金属与活泼非金属。化 学 键原 子离 子离 子
化合物二.电子式 在元素符号周围用小黑点“?”(或×)来表示原子的最外层电子 的式子。易错2、离子化合物的形成过程:化 学 键氯化钠的晶体结构三、离子晶体:化 学 键在氯化钠晶体中是否存在单个的“NaCl”分子?想一想?化 学 键 指出下列用电子式表示离子化合物的形成过程中的错误之处:正 确错! 用电子式表示粒子及离子化合物的形成过程时,注意练 习1.用电子式表示离子化合物:
CaCl2、K2O
2.用电子式表示离子化合物的形成:MgO、Na2O解:1、2、思 考 哪些元素之间能形成离子键,并进而形成离子化合物? 含有离子键的化合物一定是离子化合物思 考当离子化合物溶于水或受热熔化时,离子键是否还存在? 三.影响离子键的因素 离子半径越小,带电荷数越多,阴阳离子间的作用—离子键越强,其形成化合物的熔沸点也就越高,如:熔沸点:Na2O离子键:使阴、阳离子结合成化合物的静电作用.例课堂练习练习1、下列说法正确的是:
A.离子键就是使阴、阳离子结合成化合物的静电引力
B.所有金属与所有非金属原子之间都能形成离子键
C.在化合物CaCl2中,两个氯离子之间也存在离子键
D.钠原子与氯原子结合成氯化钠后体系能量降低 ( D )练习2、下列各数值表示有关元素的原子序数,其所表
示的各原子组中能以离子键相互结合成稳定化合物的
是:
A.10与12 B.8与17 C. 11与17 D.6与14( C )1.下列说法中正确的是( )
(A)两个原子或多个原子之间的相互作用叫做化学键。
(B)阴、阳离子通过静电引力而形成的化学键叫做离子键。
(C)只有金属元素和非金属元素化合时才能形成离子键。
(D)大多数的盐、碱和低价金属氧化物中含有离子键。
2.用电子式表示下列离子化合物的形成过程:
BaCl2 NaF MgS K2O
3.主族元素A和B可形成AB2型离子化合物,用电子式表示A2B的形成过程。 课堂练习( A )练习4、判断下列各物质的熔沸点高低:
A.MgO——NaCl B.NaF——NaCl >>课后探索与实践
(1)搜集材料,自制一个氯化钠晶体结构模型。 (2)在氯化钠晶体中Na+与Cl- 的个数比是几比几? 晶体中是否存在单个的“NaCl”分子?
(3)在氯化钠晶体中与Na+ 最近且等距离的Na+有几个? (4)已知氯化钠晶体的密度为2.2g/cm3,试计算氯化钠晶体中两个最近的钠离子之间的距离。
资料:[教材116页]在通常情况下,氯化钠是晶体。在氯化钠晶体中,每个氯离子的周围都有6个钠离子,每个钠离子的周围也有6个氯离子。钠离子和氯离子就是按照这种排列方式向空间各个方向伸展,形成氯化钠晶体。
徐州高级中学 姚斌
2006.2.10思考:1.把水进行加热至1000 ℃时,只有大约不到1%的水能够分解成氢分子和氧分子;要想使氢分子分解成氢原子需要加热到温度高达2000℃,它的分解率仍不到1%,这些事实说明什么?
2.为什么水的分子式为H20而不是HO或H30?请从原子结构的角度说明为什么?化学键:物质中直接相邻的原子或离子之间强烈的相互作用,叫做化学键。直接相邻强烈按类型化学键可分为
离子键
共价键
金属键能量应大于120kJ.mol-11.离子键 因为氯化钠小颗粒悬浮在气体中呈白烟状 钠在氯气中剧烈燃烧,瓶中充满白烟。?从微观角度分析该反应
经历了怎样的变化过程 从NaCl的形成过程知道,
在Na+和Cl-之间存在着作用力?存在怎样的相互作用 Na和Cl发生反应,Na失去了一个电子,Cl就得到这个电子,双方都达到了8电子的稳定结构,形成了带正电荷的Na+ 和带负电荷的Cl-,Na+和Cl-之间有静电相互吸引作用;同时电子和电子之间、原子核和原子核之间有相互排斥作用。当两种离子接近到某一距离时,吸引作用和排斥作用达到平衡,于是,阴、阳离子之间就形成了稳定的键----离子键 一. 离子键
使阴、阳离子结合成化合物的静电作用。形成微粒:阴、阳离子形成本质:静电作用(吸引和排斥)4、哪些原子之间可能形成离子键?(成键元素)问题:想想,议议,说说1 、离子键形成的原因是什么?(成键条件)3、离子键中相互作用是什么?(成键作用力)2、形成离子键的微粒是什么?(成键微粒)电子得失形成阴、阳离子。阴、阳离子。静电作用。活泼金属与活泼非金属。化 学 键原 子离 子离 子
化合物二.电子式 在元素符号周围用小黑点“?”(或×)来表示原子的最外层电子 的式子。易错2、离子化合物的形成过程:化 学 键氯化钠的晶体结构三、离子晶体:化 学 键在氯化钠晶体中是否存在单个的“NaCl”分子?想一想?化 学 键 指出下列用电子式表示离子化合物的形成过程中的错误之处:正 确错! 用电子式表示粒子及离子化合物的形成过程时,注意练 习1.用电子式表示离子化合物:
CaCl2、K2O
2.用电子式表示离子化合物的形成:MgO、Na2O解:1、2、思 考 哪些元素之间能形成离子键,并进而形成离子化合物? 含有离子键的化合物一定是离子化合物思 考当离子化合物溶于水或受热熔化时,离子键是否还存在? 三.影响离子键的因素 离子半径越小,带电荷数越多,阴阳离子间的作用—离子键越强,其形成化合物的熔沸点也就越高,如:熔沸点:Na2O
A.离子键就是使阴、阳离子结合成化合物的静电引力
B.所有金属与所有非金属原子之间都能形成离子键
C.在化合物CaCl2中,两个氯离子之间也存在离子键
D.钠原子与氯原子结合成氯化钠后体系能量降低 ( D )练习2、下列各数值表示有关元素的原子序数,其所表
示的各原子组中能以离子键相互结合成稳定化合物的
是:
A.10与12 B.8与17 C. 11与17 D.6与14( C )1.下列说法中正确的是( )
(A)两个原子或多个原子之间的相互作用叫做化学键。
(B)阴、阳离子通过静电引力而形成的化学键叫做离子键。
(C)只有金属元素和非金属元素化合时才能形成离子键。
(D)大多数的盐、碱和低价金属氧化物中含有离子键。
2.用电子式表示下列离子化合物的形成过程:
BaCl2 NaF MgS K2O
3.主族元素A和B可形成AB2型离子化合物,用电子式表示A2B的形成过程。 课堂练习( A )练习4、判断下列各物质的熔沸点高低:
A.MgO——NaCl B.NaF——NaCl >>课后探索与实践
(1)搜集材料,自制一个氯化钠晶体结构模型。 (2)在氯化钠晶体中Na+与Cl- 的个数比是几比几? 晶体中是否存在单个的“NaCl”分子?
(3)在氯化钠晶体中与Na+ 最近且等距离的Na+有几个? (4)已知氯化钠晶体的密度为2.2g/cm3,试计算氯化钠晶体中两个最近的钠离子之间的距离。
资料:[教材116页]在通常情况下,氯化钠是晶体。在氯化钠晶体中,每个氯离子的周围都有6个钠离子,每个钠离子的周围也有6个氯离子。钠离子和氯离子就是按照这种排列方式向空间各个方向伸展,形成氯化钠晶体。
