分子作用力[下学期]
图片预览






文档简介
课件20张PPT。分子间作用力
与氢键 水有三态变化:
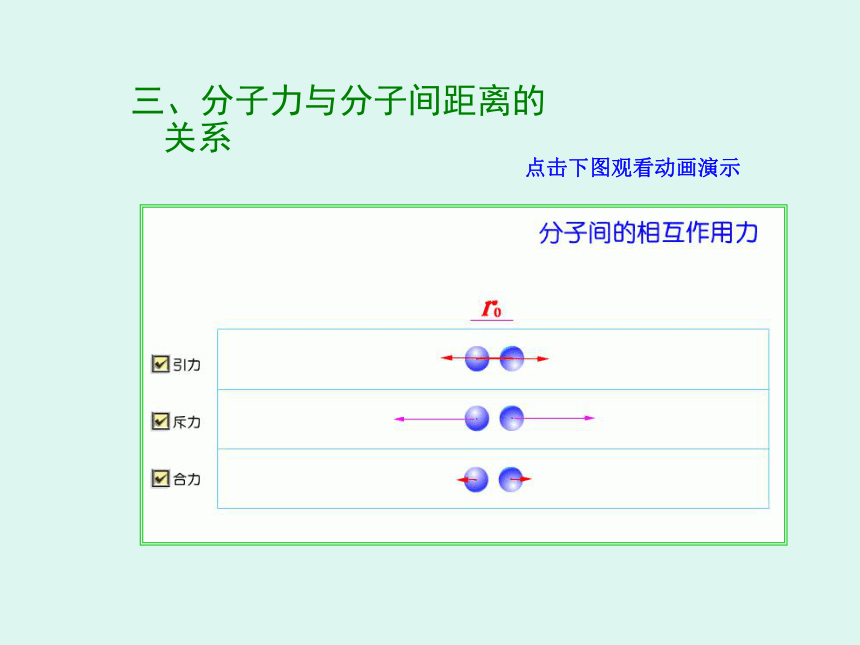
固 液 气吸热吸热放热放热0℃ 100℃ 干冰升华、硫晶体熔化、液氯汽化都要吸收能量。物质从固态转变为液态或气态,从液态转变为气态,为什么要吸收能量?在降低温度、增加压强时,C12、CO2等气体能够从气态凝结成液态或固态。这些现象给我们什么启示?三、分子力与分子间距离的关系 点击下图观看动画演示分子间力(包括色散力、诱导力、偶极力)早在1873年就已引起van der Waals的注意并首先进行研究,所以,后人就把这种分子间力也称为范德华(van der Waals)力。
大量分子聚集状态的特性主要由分子间作用力来决定,如物质的熔点、沸点、熔化热、汽化热、溶解度、表面张力、粘度等。
分子间力本质上仍属静电作用,它与分子的极性和分子的变形性有关。 1.氯化钠在熔化状态或水溶液中具有导电性,而液态氯化氢却不具有导电性。这是为什么?
2.干冰受热汽化转化为二氧化碳气体,而二氧化碳气体在加热条件下却不易被分解。这是为什么? 氯化钠为离子化合物,在熔化状态下离子键断裂后成为自由移动的阳、阴离子;或在水分子作用下能够电离成自由移动的离子,从而能导电。而液态氯化氢是共价化合物,由分子组成,无自由移动的带电粒子,因此液态氯化氢不能导电。干冰受热转化为气体,只是克服能量较低的分子间作用力,而二氧化碳分解则需要克服能量较高的共价键,因此比较困难。分子间作用力的大小判断:
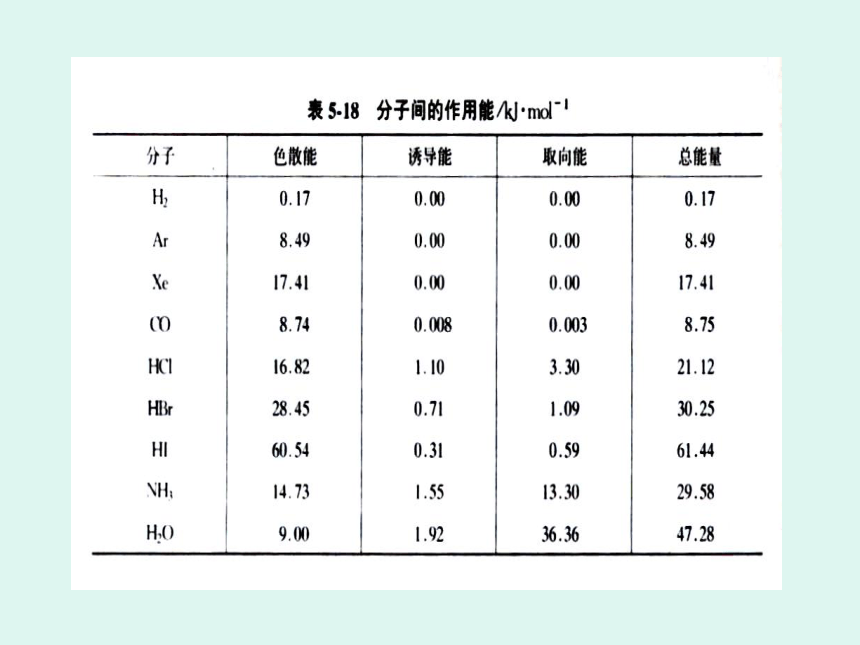
分子间作用力比化学键弱得多,约几个或数十个kJ.mol一1就能破坏这种作用力。一般来说,对于组成和结构相似的物质,相对分子质量越大,分子间作用力越大。
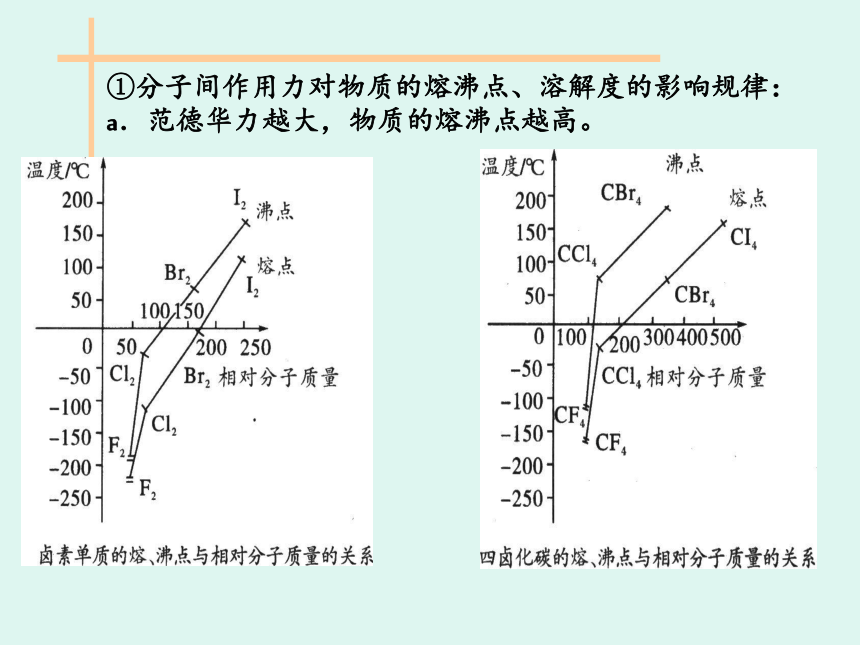
例如:F2 CF4< CCl4 a.分子间的作用力实质上是分子间的电性引力。 b.范德华为荷兰物理学家。因他首先研究了分子间作用力,故这种力称之为范德华力。 c.分子内含有共价键的分子(如Cl2、CO2、H2SO4等)或稀有气体(如He、Ne等)单原子分子之间均存在分子间作用力。 d.分子间作用力比化学键弱得多.①分子间作用力对物质的熔沸点、溶解度的影响规律:
a.范德华力越大,物质的熔沸点越高。 b.溶质分子与溶剂分子间的范德华力越大,则溶质分子的溶解度越大,如CH4和HCl在水中的溶解情况,由于CH4和H2O分子间的作用力很小,故CH4几乎不溶于水,而HCl与H2O分子间的作用力较大,故HCl极易溶于水;同理,Br2、I2与苯分子间的作用力较大,故Br2、I2易溶于苯中,而H2O与苯分子问的作用力很小,故H2O很难溶于苯中。 相似相溶原理:
由极性分子组成的溶质易溶解于极性分子的溶剂之中;非极性分子组成的溶质易溶于非极性分子组成的溶剂之中.观察右图,你发现什么?水、氟化氢和氨的沸点出现反常。 (2)氢键
①概念:分子中与氢原子形成共价键的非金属原子,如果该非金属原子(如F、O或N)吸引电子的能力很强,其原子半径又很小,则使氢原予几乎成为“裸露”的质子,带部分正电荷。这样的分子之间,氢核与带部分负电荷的非金属原子相互吸引而产生的比分子间作用力稍强的作用力,称之为氢键。水的物理性质十分特殊。水的熔沸点高,水的比热容较大,水结成冰后密度变小……注意:
a.氢键的本质还是分子间的静电吸引作用。常称为氢键的分子间作用力。 b.实例说明:以HF为例,在HF分子中,由于F原子吸引电子的能力很强,共用电子对强烈地偏向F原子,亦即H原子的电子云被F原子吸引,使H原子几乎成为“裸露”的质子。这个半径很小、带部分正电荷的H核,与另一个HF分子带部分负电荷的F原子相互吸引。这种静电吸引作用就是氢键。 c.氢键切莫理解为化学键,是一种比分子间作用力稍强的静电引力。如在水分子中,O-H键的键能为462.8lkJ·mol一1,而水分子间氢键的键能仅为18.8lkJ·mol一1。它比化学键弱得多,但比分子间作用力稍强。 d.氢键只存在于固态、液态物质中,气态时无氢键。 ②氢键形成条件
故只有部分分子之间才存在氢键,如HF、H2O、NH3分子之间存在氢键。
如H2O中,H-O中的共用电子对强烈的偏向氧原子,使氢原子几乎成为“裸露”的质子。便与另一个水分子带部分负电荷的氧原子相互吸引。这种静电吸引作用就是氢键。
③氢键的表示方法:
氢键不是化学键,为了与化学键相区别。H一X… Y—H中用“…”来表示氢键.注意三个原子(H—X… Y)要在同一条直线上(X、Y可相同或不同)。④氢键对物质性质的影响
a.氢键的存在使得物质的熔点和沸点相对较高。 例如,HF的沸点按沸点曲线下降趋势应该在-70℃以下,面实际上是20℃;H2O的沸点曲线下降趋势应该在-70℃以下,而实际上是100℃。
????为什么某些氢化物的沸点会反常呢?这是因为它们的分子之间存在着一种比分子间作用力稍强的相互作用,使得它们只能在较高的温度下才能汽化。经科学研究证明,上述物质的分子之间存在的这种相互作用,叫做氢键。 根据元素周期律,卤素氢化物的水溶液均应为强酸性,但HF表现为弱酸的性质,这是由于HF分子之间氢键的存在。 b.解释一些反常现象:如水结成冰时,为什么体积会膨胀。
氢键的大小稍大于分子间力,比键要弱得多。氢键的形成对化合物的物理和化学性质具有重要影响,在生命物质的形成及生命过程中都扮演着重要角色。在水蒸气中水以单个H2O分子形式存在;在液态水中,经常是几个水分子通过氢键结合起来,形成(H2O)n;在固态水(冰)中,水分子大范围地以氢键互相联结,形成相当疏松的晶体,从而在结构中有许多空隙,造成体积膨胀,密度减少,因此冰能浮在水面上。
与氢键 水有三态变化:
固 液 气吸热吸热放热放热0℃ 100℃ 干冰升华、硫晶体熔化、液氯汽化都要吸收能量。物质从固态转变为液态或气态,从液态转变为气态,为什么要吸收能量?在降低温度、增加压强时,C12、CO2等气体能够从气态凝结成液态或固态。这些现象给我们什么启示?三、分子力与分子间距离的关系 点击下图观看动画演示分子间力(包括色散力、诱导力、偶极力)早在1873年就已引起van der Waals的注意并首先进行研究,所以,后人就把这种分子间力也称为范德华(van der Waals)力。
大量分子聚集状态的特性主要由分子间作用力来决定,如物质的熔点、沸点、熔化热、汽化热、溶解度、表面张力、粘度等。
分子间力本质上仍属静电作用,它与分子的极性和分子的变形性有关。 1.氯化钠在熔化状态或水溶液中具有导电性,而液态氯化氢却不具有导电性。这是为什么?
2.干冰受热汽化转化为二氧化碳气体,而二氧化碳气体在加热条件下却不易被分解。这是为什么? 氯化钠为离子化合物,在熔化状态下离子键断裂后成为自由移动的阳、阴离子;或在水分子作用下能够电离成自由移动的离子,从而能导电。而液态氯化氢是共价化合物,由分子组成,无自由移动的带电粒子,因此液态氯化氢不能导电。干冰受热转化为气体,只是克服能量较低的分子间作用力,而二氧化碳分解则需要克服能量较高的共价键,因此比较困难。分子间作用力的大小判断:
分子间作用力比化学键弱得多,约几个或数十个kJ.mol一1就能破坏这种作用力。一般来说,对于组成和结构相似的物质,相对分子质量越大,分子间作用力越大。
例如:F2
a.范德华力越大,物质的熔沸点越高。 b.溶质分子与溶剂分子间的范德华力越大,则溶质分子的溶解度越大,如CH4和HCl在水中的溶解情况,由于CH4和H2O分子间的作用力很小,故CH4几乎不溶于水,而HCl与H2O分子间的作用力较大,故HCl极易溶于水;同理,Br2、I2与苯分子间的作用力较大,故Br2、I2易溶于苯中,而H2O与苯分子问的作用力很小,故H2O很难溶于苯中。 相似相溶原理:
由极性分子组成的溶质易溶解于极性分子的溶剂之中;非极性分子组成的溶质易溶于非极性分子组成的溶剂之中.观察右图,你发现什么?水、氟化氢和氨的沸点出现反常。 (2)氢键
①概念:分子中与氢原子形成共价键的非金属原子,如果该非金属原子(如F、O或N)吸引电子的能力很强,其原子半径又很小,则使氢原予几乎成为“裸露”的质子,带部分正电荷。这样的分子之间,氢核与带部分负电荷的非金属原子相互吸引而产生的比分子间作用力稍强的作用力,称之为氢键。水的物理性质十分特殊。水的熔沸点高,水的比热容较大,水结成冰后密度变小……注意:
a.氢键的本质还是分子间的静电吸引作用。常称为氢键的分子间作用力。 b.实例说明:以HF为例,在HF分子中,由于F原子吸引电子的能力很强,共用电子对强烈地偏向F原子,亦即H原子的电子云被F原子吸引,使H原子几乎成为“裸露”的质子。这个半径很小、带部分正电荷的H核,与另一个HF分子带部分负电荷的F原子相互吸引。这种静电吸引作用就是氢键。 c.氢键切莫理解为化学键,是一种比分子间作用力稍强的静电引力。如在水分子中,O-H键的键能为462.8lkJ·mol一1,而水分子间氢键的键能仅为18.8lkJ·mol一1。它比化学键弱得多,但比分子间作用力稍强。 d.氢键只存在于固态、液态物质中,气态时无氢键。 ②氢键形成条件
故只有部分分子之间才存在氢键,如HF、H2O、NH3分子之间存在氢键。
如H2O中,H-O中的共用电子对强烈的偏向氧原子,使氢原子几乎成为“裸露”的质子。便与另一个水分子带部分负电荷的氧原子相互吸引。这种静电吸引作用就是氢键。
③氢键的表示方法:
氢键不是化学键,为了与化学键相区别。H一X… Y—H中用“…”来表示氢键.注意三个原子(H—X… Y)要在同一条直线上(X、Y可相同或不同)。④氢键对物质性质的影响
a.氢键的存在使得物质的熔点和沸点相对较高。 例如,HF的沸点按沸点曲线下降趋势应该在-70℃以下,面实际上是20℃;H2O的沸点曲线下降趋势应该在-70℃以下,而实际上是100℃。
????为什么某些氢化物的沸点会反常呢?这是因为它们的分子之间存在着一种比分子间作用力稍强的相互作用,使得它们只能在较高的温度下才能汽化。经科学研究证明,上述物质的分子之间存在的这种相互作用,叫做氢键。 根据元素周期律,卤素氢化物的水溶液均应为强酸性,但HF表现为弱酸的性质,这是由于HF分子之间氢键的存在。 b.解释一些反常现象:如水结成冰时,为什么体积会膨胀。
氢键的大小稍大于分子间力,比键要弱得多。氢键的形成对化合物的物理和化学性质具有重要影响,在生命物质的形成及生命过程中都扮演着重要角色。在水蒸气中水以单个H2O分子形式存在;在液态水中,经常是几个水分子通过氢键结合起来,形成(H2O)n;在固态水(冰)中,水分子大范围地以氢键互相联结,形成相当疏松的晶体,从而在结构中有许多空隙,造成体积膨胀,密度减少,因此冰能浮在水面上。
