专题1从微观结构看物质的多样性复习课(2课时)[下学期]
文档属性
| 名称 | 专题1从微观结构看物质的多样性复习课(2课时)[下学期] |  | |
| 格式 | rar | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-03-01 22:18:00 | ||
图片预览








文档简介
课件65张PPT。专题1 微观结构与物质的多样性
复 习 课
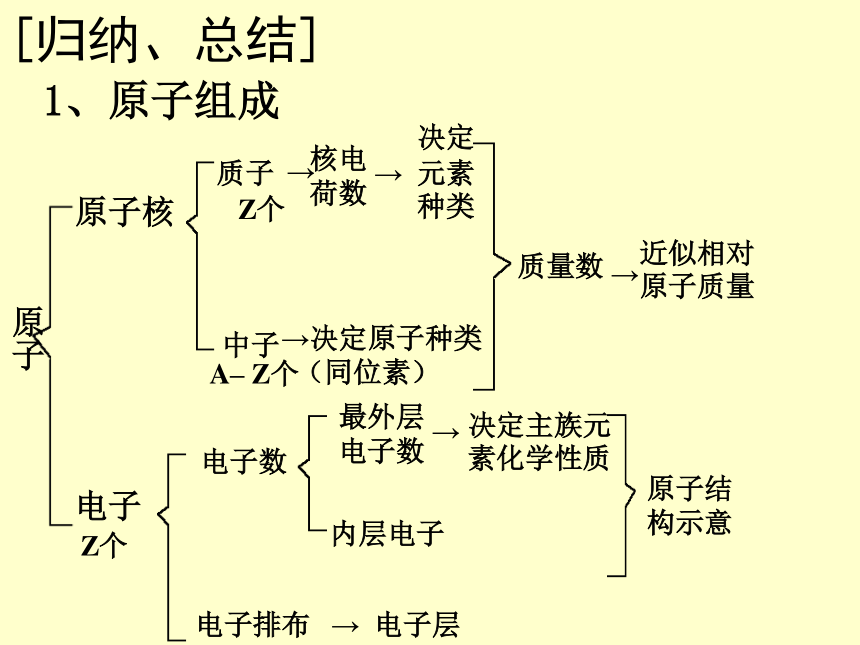
2006.2.261、原子组成[归纳、总结] 原子原子核电子质子中子核电
荷数决定
元素种类 决定原子种类
(同位素)→→→质量数→近似相对原子质量电子数最外层
电子数→决定主族元素化学性质内层电子原子结
构示意电子排布→电子层Z个A– Z个Z个 如果忽略电子的质量,将原子核内所有的质子和中子的相对质量取近似整数值加起来,所得的数值,我们称之为质量数。——元素符号质量数 —— 核电荷数 ——
(核内质子数)——元素符号质量数 —— 核电荷数 ——
(核内质子数)表示原子组成的一种方法a——代表质量数;
b——代表核电荷数;
c——代表离子的价态;
d——代表化合价a b c d各代表什么请看下列表示 Z 决定元素种类理清几个概念的区别与联系1、核数、同位素与同素异形体1. 氧原子的质量数为16,质子数为8,那么它的中子数是多少?( 8 )2. 钠原子的质量数为23,中子数为12,那么它的质子数是多少?核外电子数是多少?( 11, 11 )3. 硫的二价阴离子的核外电子数是18,中子数为17,那么它的质量数是多少?( 33 )解:因为 S2- 的核外电子数是18,即硫原子得
到 2 个电子后,是18,那么硫原子的核外
电子数是16,则16+17=33。例(97全国高考)X、Y、Z和R分别代表四种元素,如果aXm+、bYn+、cZn-、dRm-四种离子的电子层结构相同,则下列关系正确的是
A.a-c=m-n B.a-b=n-m
C.c-d=m+n D.b-d=n+mD核外电子
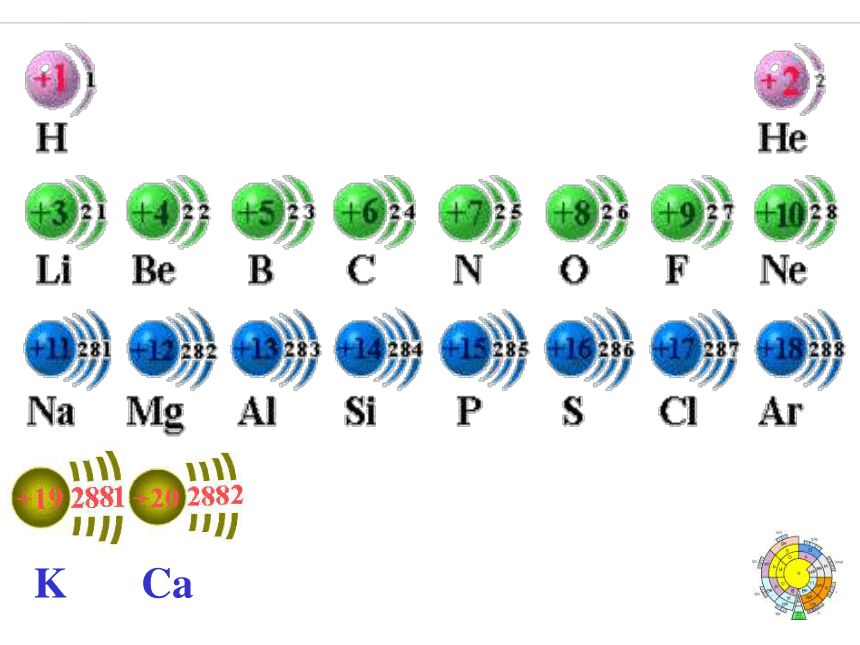
排布规律①先排布在能量低的电子表层②各电子层最多容纳2n2个电子③最外层电子数不超过8个,
次外层电子数不超过18个。
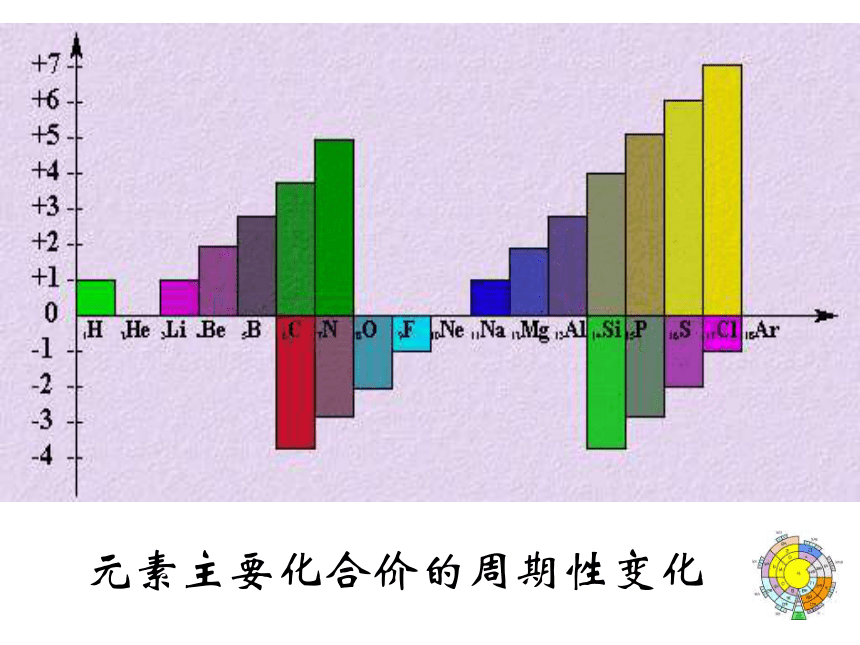
倒数第三层电子数不超过32个原子的最外层电子排布元素主要化合价的周期性变化专题2 元素周期表中元素的性质和原子结构的递变规律 短周期
short periods 长周期
long periods 不完全周期
uncompleted period 第7周期: 族
Groups
or
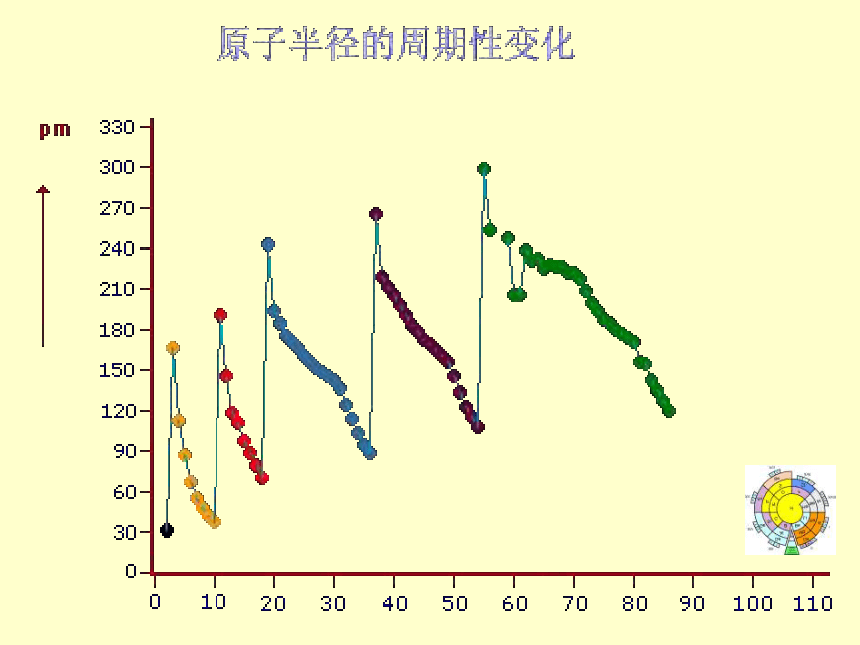
Families主族:副族:ⅠA , ⅡA , ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA 第VIII 族:稀有气体元素 零族:共七个主族ⅠB , ⅡB , ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB 共七个副族包含三列 Na Mg Al Si P S Cl 金属性逐渐减弱,非金属性逐渐增强用结构观点解释从左到右→ 电子层数相同,核电荷数增多→原子半径减小→ 失电子能力逐渐减弱 得电子能力逐渐增强思考:锂与钠的金属性强弱比较。元素性质的递变规律同周期(左→右)项 目核电荷数同主族(上→下)电子层数原子半径化 合 价 相 同 逐渐减小 最高正价:+1 →+7 逐渐增大 负化合价:- 4 → -1 增 大 增 多 逐渐增大 最高正价=族序数 负化合价= -(8-族序数)主族元素原子的最外层电子叫做价电子 1B Al SiGe As Sb Te 2 3 4 5 6 7ⅠAⅡAⅢAⅣAⅤAⅥAⅦA 0 Po At非金属性逐渐增强 金属性逐渐增强金属性逐渐增强 非金属性逐渐增强金 属 最 强判断依据3、元素在周期表中的位置与原子结构和性质变化的关系结构决定性质推导决定位置推导推导推
导原子结构表中位置元素性质原子序数= 核电荷数周期数= 电子层数主族序数=最外层电子数同位素-化学性质相同 相似性
递变性(从上至下,金属性增强,非金属性减弱)同周期同主族递变性(从左到右,金属性减弱,非金属性增强)电子层数最外层电子数金属性、非金属性强弱(主族)最外层电子数 = 最高正价 最外层电子数-8 = 负价原子结构决定元素在周期表中的位置,决定性质单质密度最小的元素 H
单质密度最小的金属元素 Li
地壳中含量最多的元素 O
自然界最活泼的金属元素 铯Cs
周期表中最活泼的金属元素 钫Fr
最活泼的非金属元素 F
最稳定的气态氢化物 HF
最不稳定的气态氢化物 SiH4自然界最强的碱 CsOH
最强的含氧酸 HClO4
常温唯一液态非金属单质 Hg
自然界最硬的元素 C
单质延展性最好的金属 Au
单质导电性最好的金属 Ag
形成化合物种类最多的元素 C
同位素最多的元素 Sn
形成氧化物种类最多的元素 N MnB特殊知识点找元素之最最活泼金属 、最活泼非金属
最轻的金属 、最轻的非金属
最高熔沸点是 、最低熔沸点是
最稳定的气态氢化物 ,含H%最大的是
最强酸 、最强碱
地壳中含量最多的金属和非金属找半导体:在“折线”附近 Si Ge Ga
找农药: 在磷附近 P As S Cl F
找催化剂、耐高温、耐腐蚀材料:
过渡元素 Fe Ni Pt Pd RhAl O练习与思考:1、推算原子序数为6、13、34、53、88的元素在周期表中的位置。23457IVAIIIAVIAVIIAIIA练习与思考:3、下列各表为周期表的一部分(表中为原子序数),其中正确的是( )
(A) (B)
(C) (D)D练习1金属性最强的元素(不包括放射性元素)是 ;
最活泼的非金属元素是 ;
最高价氧化物对应水化物的酸性最强的元素是 ;
最高价氧化物对应水化物的碱性最强的元素(不包括放射性元素)是 。CsFClCs
比较微粒半径大小的规律 ⑴ 同周期元素的原子或最高价离子(相同电荷)半径从左到右渐小 ⑵ 同主族元素的原子或离子半径从上到下渐大 ⑷ 同种元素的微粒:阳离子<中性原子<阴离子
价态越高,微粒半径越小。⑶ 核外电子排布相同的离子半径随电荷数的增加而减小 Na >Mg >Al >Si Na+ >Mg2+ >Al3+ Li < Na < K F- < Cl- < Br- O2 > F- > Na+ > Mg2+ > Al3+ (第二周期阴离子)(第三周期阳离子) Fe+3 < Fe2+ < Fe H+ < H < H-练习21、有a、b、c、d四种元素,a、b的阳离子与c、d的阴离子具有相同的电子层结构,a的阳离子的正电荷数小于b的阳离子,c的阴离子负电荷数大于d的阴离子,则它们的离子半径关系是( )
A、a>b>c>d B、b>a>d>c
C、c>a>d>b D、c>d>a>b
√元素周期律及元素周期表
的三大意义 ⑴ 学习和研究化学的规律和工具 ⑵ 研究发现新物质 ⑶ 论证了量变引起质变的规律性 预言新元素,研究新农药,寻找半导体材料、催化剂、耐高温耐腐蚀材料。练习3同一周期的X、Y、Z三元素,已知最高价氧化物对应水化物的化学式是:H3XO4、H2YO4、HZO4,则: (1)X、Y、Z的非金属性强弱顺序为_____________。(2)气态氢化物的化学式分别为________________,它们稳定性强弱为_____________________________。(3)最高价氧化物对应水化物的酸性强弱为_______ _________________________________。Z>Y>XXH3<H2Y<HZH3XO4<H2YO4<HZO4XH3、H2Y、HZ练习4X、Y、Z是主族的三种非金属元素,它们在周期表中的位置如图所示。试回答:
(1)X元素单质的化学式是________。
(2)Y元素的原子结构示意图是________
Y与钠反应的化学反应方程式为____________ ___________________________________。
(3)Z元素的名称是______,从元素原子得失电子的角度看,Z元素具有____ _______性;若从Z元素在周期表中所处位置看,它具有这种性质的原因是_________________________ _______________________________________。F2S + 2Na = Na2S砷既有金属性也有非金属它位于周期表的金属与非金属的分界线上练习51、两种短周期的元素X和Y,可组成化合物XY3,当Y的原子序数为m时,X的原子序数为(1)m-4 (2)m+4 (3)m+8 (4)m-2 (5)m+6。其中正确的组合是( )
A、(1)(2)
B、(1)(2)(3)
C、(1)(2)(5)
D、(1)(2)(3)(4)(5)
√练习题: 1.某三价金属阳离子,具有28个电子,其质量数为70,那么它的核内中子数是( )
A. 28 B. 31 C.39 D.422.某元素原子的核电荷数是电子层数的5倍,其质子数
是最外层电子数的3倍,该元素的核电荷数为( )
A.11 B. 15 C.17 D.34 3.最外层为次外层电子数的3倍的元素X,与焰色反应为黄色的Y元素形成化合物的化学式是( )
A.Y2X B.YX2 C.Y2X2 D.YXDBAC4.主族元素在周期表中的位置取决于该元素原子的( )
A.相对原子质量和核外电子数
B.电子层数和最外层电子数
C.相对原子质量和最外层电子数
D.电子层数和次外层电子数
5.下列性质递变正确的是( )
A.原子半径:C > Al > Na > K
B.离子半径:O2- > F- > Al3+ > Mg2+ > Na+
C.热稳定性:HF > NH3 > PH3 > SiH4
D.最高正价:Na < Al < Si < Cl
BCD6.A、B、C是周期表中相邻的三种元素,其中A、B
是同周期,B、C是同主族。此三种元素原子最外层
电子数之和为17,质子数总和为31,则A、B、C分别
是_____、 _____、 _____7.下列各组微粒半径大小的比较中,不正确的是( )
A.K > Na > Li B.Mg2+ > Na+ >F-
C.Na+ > Mg2+ > Al3+ D.Cl- > F- >F 8.下列各组中,判断正确的是( )
A.碱性:Ca(OH)2 > Ba(OH)2 B.酸性: HI > HCl
C.金属性: Be > Na D.非金属性: N > P
NOSBC[例1] (1997年,全国)19世纪中叶,门捷列夫的突出贡献是 ( )
(A)提出原子学说
(B)发现元素周期律
(C)提出分子学说
(D)发现氧气 B 发现电子:汤姆生(英)道尔顿(英)舍勒(瑞典) 普得斯特里(英)
拉瓦锡(法)门捷列夫(俄)阿伏加德罗(意) 研究分子间作用力:范德华(荷兰)[例2] (2000年,广东)在周期表中,第三、四、五、六周期元素的数目分别是( )
(A)8、18、32、32 (B)8、18、18、32
(C)8、18、18、18 (D)8、8、18、18
B 元素周期表有 个周期, 个族。第三周期元素:第ⅠA元素:第ⅦA元素:零族元素:七十六 Na Mg Al Si P S Cl ArH Li Na K Rb Cs FrF Cl Br I At2He 10Ne 18Ar 36Kr 54Xe 86Rn[例3] (2000年,全国)甲、乙是周期表中同一主族的两种元素,若甲的原子序数为 x,则乙的原子序数不可能是( )
(A)x + 2
(B)x + 4
(C)x + 8
(D)x + 18
B 甲为H,乙为Li甲为第二周期元素或第三周期的Na 、Mg 若甲为第六周期元素(Cs、Ba),则乙的原子序数为 x+32。甲为第三周期ⅢA~零族元素或第四周期元素或第五周期的Rb、Sr元素[例4] (1998年,全国)X、Y属短周期元素,X原子
的最外层电子数是次外层电子数的一半,Y位于X的前
一周期,且最外层只有一个电子。则X和Y形成的化合
物的化学式可表示为( )
(A)XY (B) XY2 (C) XY3 (D) X2Y3 A X原子的最外层电子数是次外层电子数的一半,则 若 X为Li,则Y为H , 能组成LiH 。X可能是Li (2,1) 或 Si ( 2,8,4 ) 若 X为Si,则Y为Li ,不可能生成题目所示的化合物。[例5] (1999年,全国)X、Y、Z为短周期元素,这
些元素原子的最外层电子数分别是1,4,6,则由这三
种元素组成的化合物的化学式不可能是( )
(A)XYZ (B) X2YZ (C) X2YZ2 (D) X2YZ3 A X为H 、Li 或Na(B) H2CO , HCHO (甲醛)Y为 C 或 SiZ为 O 或 S(C) H2CO2 , HCOOH (甲酸)(D) H2CO3 , Na2CO3 , H2SiO3, Na2SiO3 等。[例6] (1997年,全国)已知铍(Be)的原子序数为4 。下列对铍及其化合物的叙述中,正确的是( )
(A)铍的原子半径大于硼的原子半径
(B)氯化铍分子中铍原子的最外层电子数是8
(C)氢氧化铍的碱性比氢氧化钙弱
(D)单质跟冷水反应生成氢气
A C 4Be和5B同是第二周期元素,从左到右,原子半径减小铍原子最外层电子数为2 4Be和20Ca都是ⅡA元素,铍的金属性比钙弱。铍的金属性比镁弱。镁与冷水不反应,与沸水才反应。
[例7] (1995年,上海)今有A、B、C、D四种短周期元素,它们的核电荷数依次增大;A与C,B与D分别是同族元素,B、D两元素的质子数之和为A、C两元素质子数之和的两倍,这四种元素中有一种元素的单质溶解于CS2的溶剂中,则四种元素是:A B C D ,写出都含这四种元素的两种化合物反应的化学方程式H由题意可知A、B、C、D在周期表中的位置可能是第二周期 A B C D第一周期 A
第二周期 B
第三周期 C D2( 2x+8 ) = 2y+8( x,y 为正整数) 解得 x=1 , y=6 ( 不合理)若为①,设核电荷数A=x,B=y, 则 C=x+8 , D=y 8若为② ,则A为H, C为Na , 2(1+11)=2y+8 y=8 即B为OONaSNaHSO3 + NaHSO4 = Na2SO4 + H2O + SO2[例8] (1996年,全国)X元素的阳离子和Y元素的阴离子具有与氩原子相同的电子层结构,下列叙述正确的是( )
(A)X的原子序数比Y小
(B)X原子的最外层电子数比Y的大
(C)X的原子半径比Y的大
(D)X元素的最高正价比Y的小C D X元素与Y元素的相对位置是(结构相同的离子,阴上阳下,序大径小)2、元素周期表其它周期表其它周期表其它周期表其它周期表专题3 离子键和共价键的比较 用电子式表示离子化合物与共价化合物形成过程离子键与共价键(极性键与非极性键)离子化合物与共价化合物原子之间通过共用电子对形成的相互作用叫共价键。使阴、阳离子结合成化合物的静电作用叫离子键 。含有离子键的化合物叫离子化合物 只含共价键的化合物叫共价化合物 例1、下列叙述中错误的是
A、离子化合物中不可能存在非极性键
B、离子键只存在于离子化合物中,不存在 于共价化合物中
C、由极性键结合的分子不一定是极性分子
D、极性分子一定不含非极性键
E、离子化合物中不一定含有金属元素
F、非金属元素间可能形成离子化合物AD巩固练习例2、在下列各对化合物中,化学键类型相同的是
A、HCl和MgCl2 B、H2O2和CO2
C、CO2和CH4 D、NaCl和NaOHC例3、下列过程中,共价键被破坏的是
A、碘升华 B、溴蒸气被木炭吸附
C、蔗糖溶于水 D、SO2气体溶于水D巩固练习例4、下列关系式中正确的是
A、键的极性:C-N>C-O
B、沸点:F2 < I2
C、热稳定性:H-Br>H-I
D、分子的极性: H-Cl < H-BrBC巩固练习专题4 四种晶体的比较 3(2005年上海)下列说法错误的是( )
A.原子晶体中只存在非极性共价键
B.分子晶体的状态变化,只需克服分子间作用力
C.金属晶体通常具有导电性、导热性和良好的延展性
D.离子晶体在熔化状态下能导电
A(2005年江苏)A、B、C、D四种短周期元素的原子,半径依次减小,A与C的核电荷数之比为3:4,D能分别与A、B、C形成电子总数相等的分子X、Y、Z。下列叙述正确的是( )
A.X、Y、Z的稳定性逐渐减弱
B.A、B、C、D只能形成5种单质
C.X、Y、Z三种化合物的熔沸点逐渐升高
D.自然界中存在多种由A、B、C、D四种元素组成的化合物
CD四种元素分别为碳、氮、氧、氢(2004年上海)下表是元素周期表的一部分。
(1)表中元素⑩的氢化物的化学式为 ,此氢化物的还原性比元素⑨的氢化物的还原性 (填“强”或“弱”)。
(2)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质,写出元素③的氢氧化物与NaOH溶液反应的化学方程式 ,又如表中与元素⑦的性质相似的不同族元素是 (填元素符号)。 HCl弱Be(OH)2+2NaOH=Na2BeO2+2H2OLi(2005年广东)短周期元素X、Y的原子序数相差2。下列有关叙述正确的是( )
A.X与Y不可能位于同一主族
B.X与Y一定位于同一周期
C.X与Y可能形成共价化合物XY
D.X与Y可能形成离子化合物XY
CD
复 习 课
2006.2.261、原子组成[归纳、总结] 原子原子核电子质子中子核电
荷数决定
元素种类 决定原子种类
(同位素)→→→质量数→近似相对原子质量电子数最外层
电子数→决定主族元素化学性质内层电子原子结
构示意电子排布→电子层Z个A– Z个Z个 如果忽略电子的质量,将原子核内所有的质子和中子的相对质量取近似整数值加起来,所得的数值,我们称之为质量数。——元素符号质量数 —— 核电荷数 ——
(核内质子数)——元素符号质量数 —— 核电荷数 ——
(核内质子数)表示原子组成的一种方法a——代表质量数;
b——代表核电荷数;
c——代表离子的价态;
d——代表化合价a b c d各代表什么请看下列表示 Z 决定元素种类理清几个概念的区别与联系1、核数、同位素与同素异形体1. 氧原子的质量数为16,质子数为8,那么它的中子数是多少?( 8 )2. 钠原子的质量数为23,中子数为12,那么它的质子数是多少?核外电子数是多少?( 11, 11 )3. 硫的二价阴离子的核外电子数是18,中子数为17,那么它的质量数是多少?( 33 )解:因为 S2- 的核外电子数是18,即硫原子得
到 2 个电子后,是18,那么硫原子的核外
电子数是16,则16+17=33。例(97全国高考)X、Y、Z和R分别代表四种元素,如果aXm+、bYn+、cZn-、dRm-四种离子的电子层结构相同,则下列关系正确的是
A.a-c=m-n B.a-b=n-m
C.c-d=m+n D.b-d=n+mD核外电子
排布规律①先排布在能量低的电子表层②各电子层最多容纳2n2个电子③最外层电子数不超过8个,
次外层电子数不超过18个。
倒数第三层电子数不超过32个原子的最外层电子排布元素主要化合价的周期性变化专题2 元素周期表中元素的性质和原子结构的递变规律 短周期
short periods 长周期
long periods 不完全周期
uncompleted period 第7周期: 族
Groups
or
Families主族:副族:ⅠA , ⅡA , ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA 第VIII 族:稀有气体元素 零族:共七个主族ⅠB , ⅡB , ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB 共七个副族包含三列 Na Mg Al Si P S Cl 金属性逐渐减弱,非金属性逐渐增强用结构观点解释从左到右→ 电子层数相同,核电荷数增多→原子半径减小→ 失电子能力逐渐减弱 得电子能力逐渐增强思考:锂与钠的金属性强弱比较。元素性质的递变规律同周期(左→右)项 目核电荷数同主族(上→下)电子层数原子半径化 合 价 相 同 逐渐减小 最高正价:+1 →+7 逐渐增大 负化合价:- 4 → -1 增 大 增 多 逐渐增大 最高正价=族序数 负化合价= -(8-族序数)主族元素原子的最外层电子叫做价电子 1B Al SiGe As Sb Te 2 3 4 5 6 7ⅠAⅡAⅢAⅣAⅤAⅥAⅦA 0 Po At非金属性逐渐增强 金属性逐渐增强金属性逐渐增强 非金属性逐渐增强金 属 最 强判断依据3、元素在周期表中的位置与原子结构和性质变化的关系结构决定性质推导决定位置推导推导推
导原子结构表中位置元素性质原子序数= 核电荷数周期数= 电子层数主族序数=最外层电子数同位素-化学性质相同 相似性
递变性(从上至下,金属性增强,非金属性减弱)同周期同主族递变性(从左到右,金属性减弱,非金属性增强)电子层数最外层电子数金属性、非金属性强弱(主族)最外层电子数 = 最高正价 最外层电子数-8 = 负价原子结构决定元素在周期表中的位置,决定性质单质密度最小的元素 H
单质密度最小的金属元素 Li
地壳中含量最多的元素 O
自然界最活泼的金属元素 铯Cs
周期表中最活泼的金属元素 钫Fr
最活泼的非金属元素 F
最稳定的气态氢化物 HF
最不稳定的气态氢化物 SiH4自然界最强的碱 CsOH
最强的含氧酸 HClO4
常温唯一液态非金属单质 Hg
自然界最硬的元素 C
单质延展性最好的金属 Au
单质导电性最好的金属 Ag
形成化合物种类最多的元素 C
同位素最多的元素 Sn
形成氧化物种类最多的元素 N MnB特殊知识点找元素之最最活泼金属 、最活泼非金属
最轻的金属 、最轻的非金属
最高熔沸点是 、最低熔沸点是
最稳定的气态氢化物 ,含H%最大的是
最强酸 、最强碱
地壳中含量最多的金属和非金属找半导体:在“折线”附近 Si Ge Ga
找农药: 在磷附近 P As S Cl F
找催化剂、耐高温、耐腐蚀材料:
过渡元素 Fe Ni Pt Pd RhAl O练习与思考:1、推算原子序数为6、13、34、53、88的元素在周期表中的位置。23457IVAIIIAVIAVIIAIIA练习与思考:3、下列各表为周期表的一部分(表中为原子序数),其中正确的是( )
(A) (B)
(C) (D)D练习1金属性最强的元素(不包括放射性元素)是 ;
最活泼的非金属元素是 ;
最高价氧化物对应水化物的酸性最强的元素是 ;
最高价氧化物对应水化物的碱性最强的元素(不包括放射性元素)是 。CsFClCs
比较微粒半径大小的规律 ⑴ 同周期元素的原子或最高价离子(相同电荷)半径从左到右渐小 ⑵ 同主族元素的原子或离子半径从上到下渐大 ⑷ 同种元素的微粒:阳离子<中性原子<阴离子
价态越高,微粒半径越小。⑶ 核外电子排布相同的离子半径随电荷数的增加而减小 Na >Mg >Al >Si Na+ >Mg2+ >Al3+ Li < Na < K F- < Cl- < Br- O2 > F- > Na+ > Mg2+ > Al3+ (第二周期阴离子)(第三周期阳离子) Fe+3 < Fe2+ < Fe H+ < H < H-练习21、有a、b、c、d四种元素,a、b的阳离子与c、d的阴离子具有相同的电子层结构,a的阳离子的正电荷数小于b的阳离子,c的阴离子负电荷数大于d的阴离子,则它们的离子半径关系是( )
A、a>b>c>d B、b>a>d>c
C、c>a>d>b D、c>d>a>b
√元素周期律及元素周期表
的三大意义 ⑴ 学习和研究化学的规律和工具 ⑵ 研究发现新物质 ⑶ 论证了量变引起质变的规律性 预言新元素,研究新农药,寻找半导体材料、催化剂、耐高温耐腐蚀材料。练习3同一周期的X、Y、Z三元素,已知最高价氧化物对应水化物的化学式是:H3XO4、H2YO4、HZO4,则: (1)X、Y、Z的非金属性强弱顺序为_____________。(2)气态氢化物的化学式分别为________________,它们稳定性强弱为_____________________________。(3)最高价氧化物对应水化物的酸性强弱为_______ _________________________________。Z>Y>XXH3<H2Y<HZH3XO4<H2YO4<HZO4XH3、H2Y、HZ练习4X、Y、Z是主族的三种非金属元素,它们在周期表中的位置如图所示。试回答:
(1)X元素单质的化学式是________。
(2)Y元素的原子结构示意图是________
Y与钠反应的化学反应方程式为____________ ___________________________________。
(3)Z元素的名称是______,从元素原子得失电子的角度看,Z元素具有____ _______性;若从Z元素在周期表中所处位置看,它具有这种性质的原因是_________________________ _______________________________________。F2S + 2Na = Na2S砷既有金属性也有非金属它位于周期表的金属与非金属的分界线上练习51、两种短周期的元素X和Y,可组成化合物XY3,当Y的原子序数为m时,X的原子序数为(1)m-4 (2)m+4 (3)m+8 (4)m-2 (5)m+6。其中正确的组合是( )
A、(1)(2)
B、(1)(2)(3)
C、(1)(2)(5)
D、(1)(2)(3)(4)(5)
√练习题: 1.某三价金属阳离子,具有28个电子,其质量数为70,那么它的核内中子数是( )
A. 28 B. 31 C.39 D.422.某元素原子的核电荷数是电子层数的5倍,其质子数
是最外层电子数的3倍,该元素的核电荷数为( )
A.11 B. 15 C.17 D.34 3.最外层为次外层电子数的3倍的元素X,与焰色反应为黄色的Y元素形成化合物的化学式是( )
A.Y2X B.YX2 C.Y2X2 D.YXDBAC4.主族元素在周期表中的位置取决于该元素原子的( )
A.相对原子质量和核外电子数
B.电子层数和最外层电子数
C.相对原子质量和最外层电子数
D.电子层数和次外层电子数
5.下列性质递变正确的是( )
A.原子半径:C > Al > Na > K
B.离子半径:O2- > F- > Al3+ > Mg2+ > Na+
C.热稳定性:HF > NH3 > PH3 > SiH4
D.最高正价:Na < Al < Si < Cl
BCD6.A、B、C是周期表中相邻的三种元素,其中A、B
是同周期,B、C是同主族。此三种元素原子最外层
电子数之和为17,质子数总和为31,则A、B、C分别
是_____、 _____、 _____7.下列各组微粒半径大小的比较中,不正确的是( )
A.K > Na > Li B.Mg2+ > Na+ >F-
C.Na+ > Mg2+ > Al3+ D.Cl- > F- >F 8.下列各组中,判断正确的是( )
A.碱性:Ca(OH)2 > Ba(OH)2 B.酸性: HI > HCl
C.金属性: Be > Na D.非金属性: N > P
NOSBC[例1] (1997年,全国)19世纪中叶,门捷列夫的突出贡献是 ( )
(A)提出原子学说
(B)发现元素周期律
(C)提出分子学说
(D)发现氧气 B 发现电子:汤姆生(英)道尔顿(英)舍勒(瑞典) 普得斯特里(英)
拉瓦锡(法)门捷列夫(俄)阿伏加德罗(意) 研究分子间作用力:范德华(荷兰)[例2] (2000年,广东)在周期表中,第三、四、五、六周期元素的数目分别是( )
(A)8、18、32、32 (B)8、18、18、32
(C)8、18、18、18 (D)8、8、18、18
B 元素周期表有 个周期, 个族。第三周期元素:第ⅠA元素:第ⅦA元素:零族元素:七十六 Na Mg Al Si P S Cl ArH Li Na K Rb Cs FrF Cl Br I At2He 10Ne 18Ar 36Kr 54Xe 86Rn[例3] (2000年,全国)甲、乙是周期表中同一主族的两种元素,若甲的原子序数为 x,则乙的原子序数不可能是( )
(A)x + 2
(B)x + 4
(C)x + 8
(D)x + 18
B 甲为H,乙为Li甲为第二周期元素或第三周期的Na 、Mg 若甲为第六周期元素(Cs、Ba),则乙的原子序数为 x+32。甲为第三周期ⅢA~零族元素或第四周期元素或第五周期的Rb、Sr元素[例4] (1998年,全国)X、Y属短周期元素,X原子
的最外层电子数是次外层电子数的一半,Y位于X的前
一周期,且最外层只有一个电子。则X和Y形成的化合
物的化学式可表示为( )
(A)XY (B) XY2 (C) XY3 (D) X2Y3 A X原子的最外层电子数是次外层电子数的一半,则 若 X为Li,则Y为H , 能组成LiH 。X可能是Li (2,1) 或 Si ( 2,8,4 ) 若 X为Si,则Y为Li ,不可能生成题目所示的化合物。[例5] (1999年,全国)X、Y、Z为短周期元素,这
些元素原子的最外层电子数分别是1,4,6,则由这三
种元素组成的化合物的化学式不可能是( )
(A)XYZ (B) X2YZ (C) X2YZ2 (D) X2YZ3 A X为H 、Li 或Na(B) H2CO , HCHO (甲醛)Y为 C 或 SiZ为 O 或 S(C) H2CO2 , HCOOH (甲酸)(D) H2CO3 , Na2CO3 , H2SiO3, Na2SiO3 等。[例6] (1997年,全国)已知铍(Be)的原子序数为4 。下列对铍及其化合物的叙述中,正确的是( )
(A)铍的原子半径大于硼的原子半径
(B)氯化铍分子中铍原子的最外层电子数是8
(C)氢氧化铍的碱性比氢氧化钙弱
(D)单质跟冷水反应生成氢气
A C 4Be和5B同是第二周期元素,从左到右,原子半径减小铍原子最外层电子数为2 4Be和20Ca都是ⅡA元素,铍的金属性比钙弱。铍的金属性比镁弱。镁与冷水不反应,与沸水才反应。
[例7] (1995年,上海)今有A、B、C、D四种短周期元素,它们的核电荷数依次增大;A与C,B与D分别是同族元素,B、D两元素的质子数之和为A、C两元素质子数之和的两倍,这四种元素中有一种元素的单质溶解于CS2的溶剂中,则四种元素是:A B C D ,写出都含这四种元素的两种化合物反应的化学方程式H由题意可知A、B、C、D在周期表中的位置可能是第二周期 A B C D第一周期 A
第二周期 B
第三周期 C D2( 2x+8 ) = 2y+8( x,y 为正整数) 解得 x=1 , y=6 ( 不合理)若为①,设核电荷数A=x,B=y, 则 C=x+8 , D=y 8若为② ,则A为H, C为Na , 2(1+11)=2y+8 y=8 即B为OONaSNaHSO3 + NaHSO4 = Na2SO4 + H2O + SO2[例8] (1996年,全国)X元素的阳离子和Y元素的阴离子具有与氩原子相同的电子层结构,下列叙述正确的是( )
(A)X的原子序数比Y小
(B)X原子的最外层电子数比Y的大
(C)X的原子半径比Y的大
(D)X元素的最高正价比Y的小C D X元素与Y元素的相对位置是(结构相同的离子,阴上阳下,序大径小)2、元素周期表其它周期表其它周期表其它周期表其它周期表专题3 离子键和共价键的比较 用电子式表示离子化合物与共价化合物形成过程离子键与共价键(极性键与非极性键)离子化合物与共价化合物原子之间通过共用电子对形成的相互作用叫共价键。使阴、阳离子结合成化合物的静电作用叫离子键 。含有离子键的化合物叫离子化合物 只含共价键的化合物叫共价化合物 例1、下列叙述中错误的是
A、离子化合物中不可能存在非极性键
B、离子键只存在于离子化合物中,不存在 于共价化合物中
C、由极性键结合的分子不一定是极性分子
D、极性分子一定不含非极性键
E、离子化合物中不一定含有金属元素
F、非金属元素间可能形成离子化合物AD巩固练习例2、在下列各对化合物中,化学键类型相同的是
A、HCl和MgCl2 B、H2O2和CO2
C、CO2和CH4 D、NaCl和NaOHC例3、下列过程中,共价键被破坏的是
A、碘升华 B、溴蒸气被木炭吸附
C、蔗糖溶于水 D、SO2气体溶于水D巩固练习例4、下列关系式中正确的是
A、键的极性:C-N>C-O
B、沸点:F2 < I2
C、热稳定性:H-Br>H-I
D、分子的极性: H-Cl < H-BrBC巩固练习专题4 四种晶体的比较 3(2005年上海)下列说法错误的是( )
A.原子晶体中只存在非极性共价键
B.分子晶体的状态变化,只需克服分子间作用力
C.金属晶体通常具有导电性、导热性和良好的延展性
D.离子晶体在熔化状态下能导电
A(2005年江苏)A、B、C、D四种短周期元素的原子,半径依次减小,A与C的核电荷数之比为3:4,D能分别与A、B、C形成电子总数相等的分子X、Y、Z。下列叙述正确的是( )
A.X、Y、Z的稳定性逐渐减弱
B.A、B、C、D只能形成5种单质
C.X、Y、Z三种化合物的熔沸点逐渐升高
D.自然界中存在多种由A、B、C、D四种元素组成的化合物
CD四种元素分别为碳、氮、氧、氢(2004年上海)下表是元素周期表的一部分。
(1)表中元素⑩的氢化物的化学式为 ,此氢化物的还原性比元素⑨的氢化物的还原性 (填“强”或“弱”)。
(2)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质,写出元素③的氢氧化物与NaOH溶液反应的化学方程式 ,又如表中与元素⑦的性质相似的不同族元素是 (填元素符号)。 HCl弱Be(OH)2+2NaOH=Na2BeO2+2H2OLi(2005年广东)短周期元素X、Y的原子序数相差2。下列有关叙述正确的是( )
A.X与Y不可能位于同一主族
B.X与Y一定位于同一周期
C.X与Y可能形成共价化合物XY
D.X与Y可能形成离子化合物XY
CD
