原电池[下学期]
图片预览




文档简介
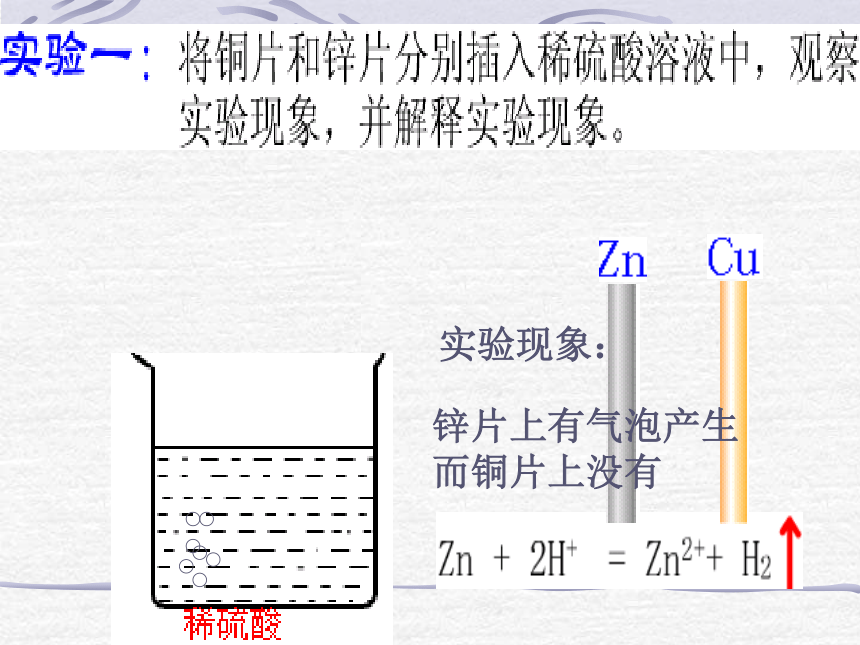
课件36张PPT。曾宪梓中学 戴家洪学习目标:1、原电池的工作原理2、构成原电池的条件 实验现象:锌片上有气泡产生
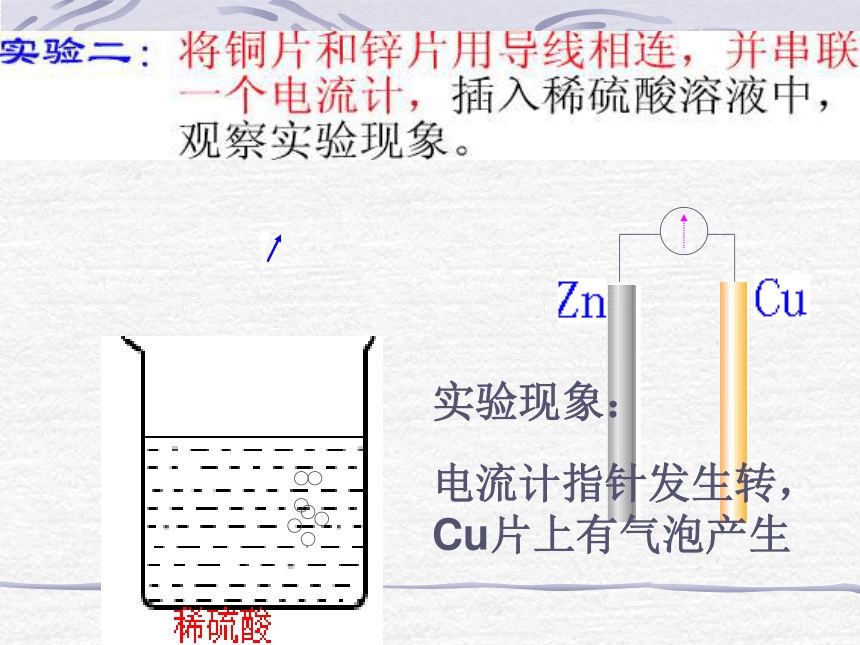
而铜片上没有实验现象:电流计指针发生转,
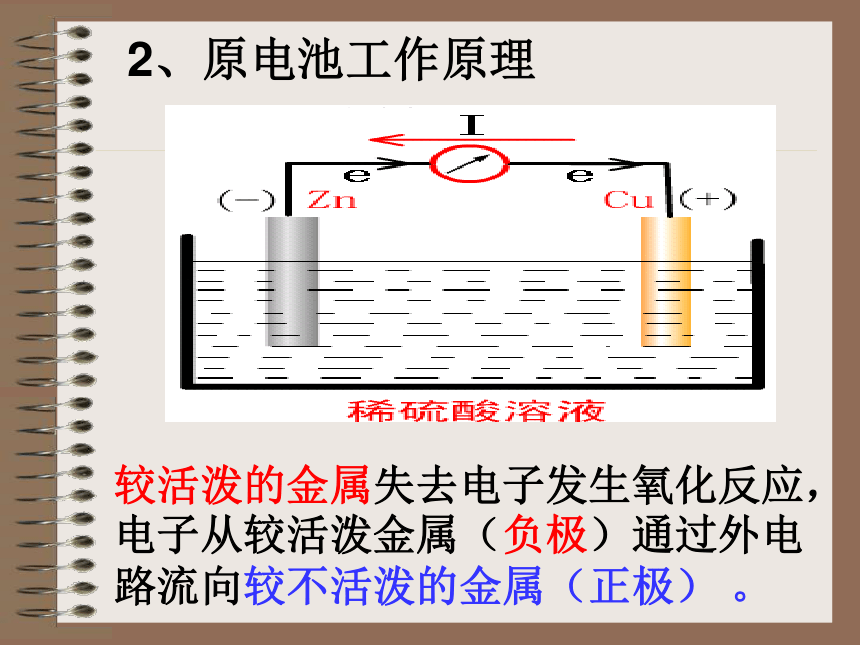
Cu片上有气泡产生原电池工作原理2、原电池工作原理较活泼的金属失去电子发生氧化反应,电子从较活泼金属(负极)通过外电
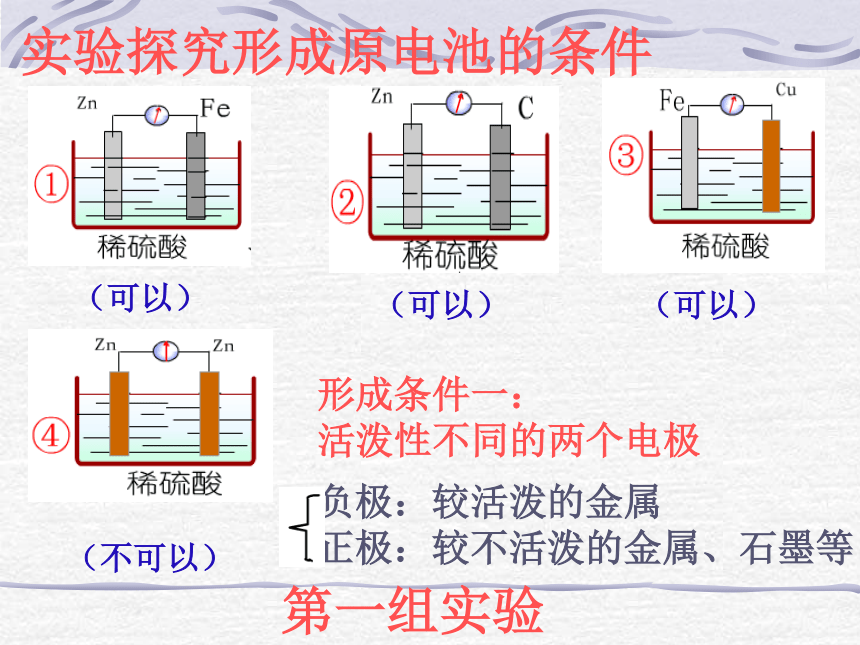
路流向较不活泼的金属(正极) 。实验探究形成原电池的条件(可以)(可以)(可以)(不可以)形成条件一:
活泼性不同的两个电极负极:较活泼的金属
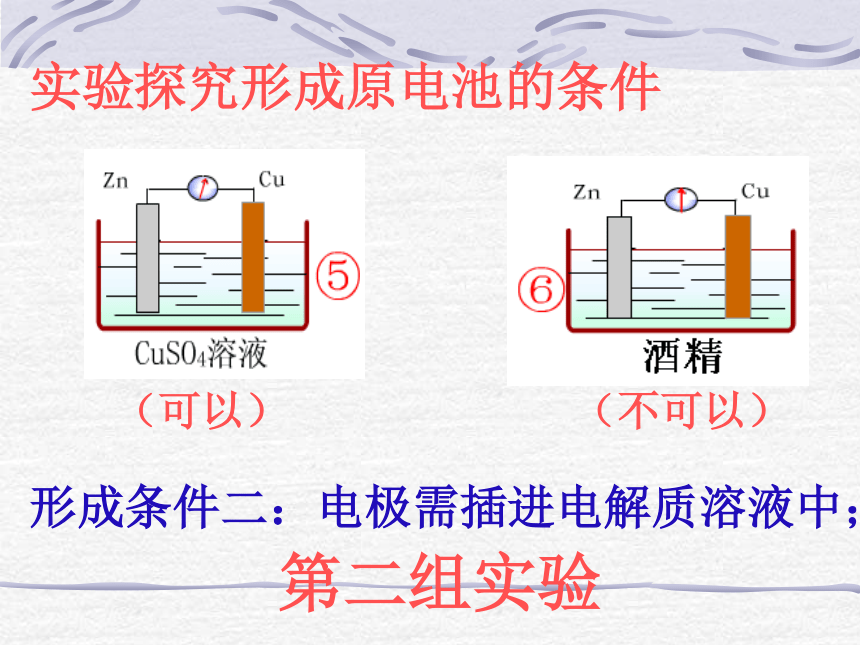
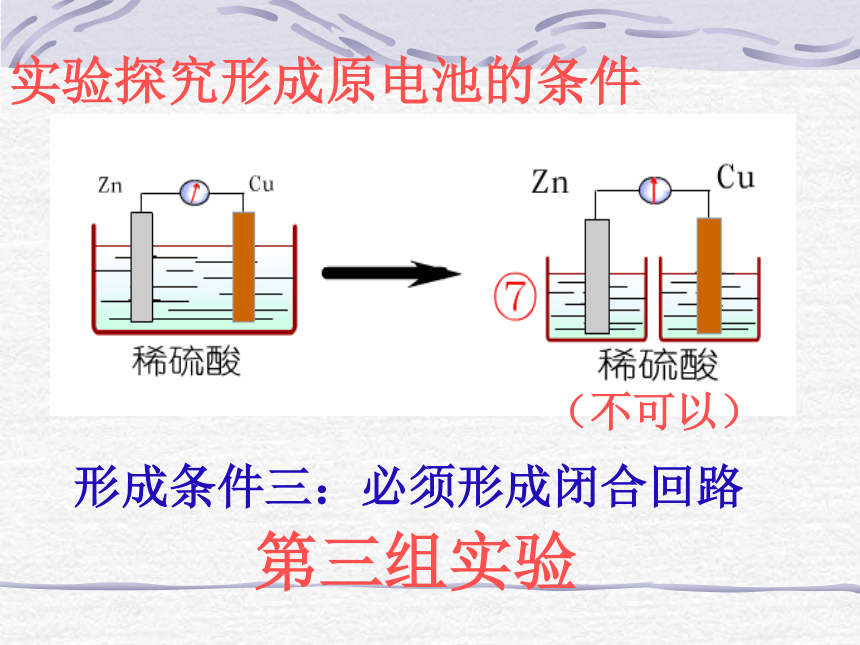
正极:较不活泼的金属、石墨等第一组实验(可以)(不可以)形成条件二:电极需插进电解质溶液中;第二组实验实验探究形成原电池的条件第三组实验实验探究形成原电池的条件形成条件三:必须形成闭合回路(不可以)你知道了吗
把a、b、c、d四块金属片浸入稀硫酸中,用
导线两两相连组成原电池。若a、b相连时,a为
负极;c、d相连时,电流由d到c;a、c相连时,
c极上产生大量气泡,b、d相连时,b上有大量气
泡产生,则四种金属的活动性顺序由强到弱的为:
( )
A.a > b > c > d B.a > c > d > b
C.c > a > b .> d D.b > d > c > a B你记住了吗?
本课时重点学习了原电池的工作原理 构成原电池的三个条件。动脑动手有下列材料:Zn片(2片)、Cu片(2片)、
导线、水果 (西红柿、苹果等)、电流计,
请设计一个装置使电流计指针发生偏转,
并画出设计草图。
Zn思考题:请根据反应 Fe + 2Fe 3+ = 3Fe 2+
设计一个原电池,画出装置图预习:1、本节 “二、化学电源”
2、“三、 金属的电化学腐蚀原电池的工作原理较活泼的金属发生氧化反应,电子从较活泼的金属(负极)通过外电路流向较不活泼的金属(正极)。 电子流向:
负极 正极导线组成原电池的条件有两种活泼性不同的金属(或一种是非金属导体)作电极
电极材料均插入电解质溶液中
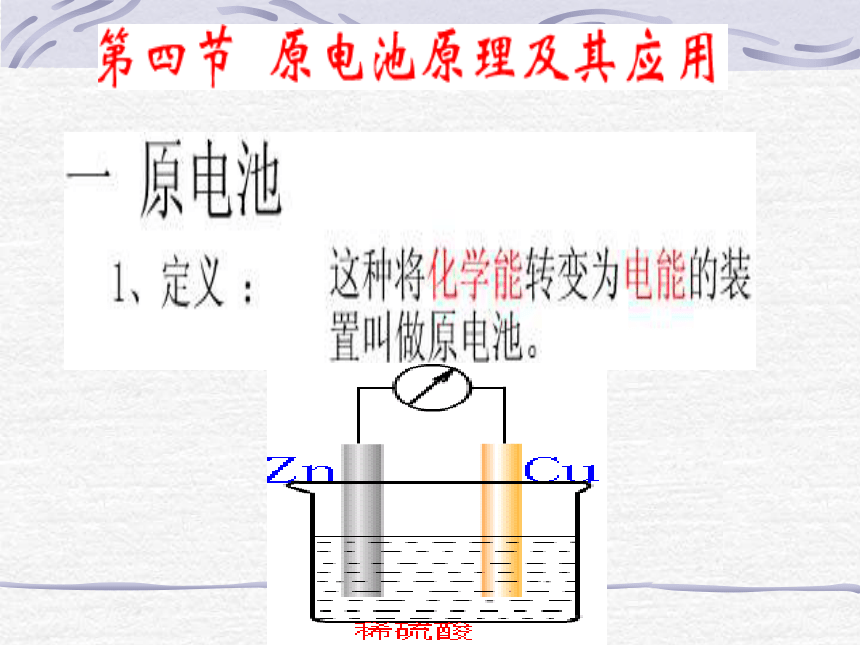
两极相连形成闭合电路 第四节 原电池原理及其应用 一、原电池 二、化学电源 什么叫原电池?构成原电池的条件是什么? 我们所学的原电池有哪些缺点? 为什么时间一长就不产生电流了呢? 怎样的电池才实用呢?产生的电压稳定且较高,使于携带、回收,对环境影响小等特点。 1.干电池负极(锌筒):Zn – 2e- = Zn2+ 正极(石墨):2NH4+ + 2e- = 2NH3↑ + H2 ↑ 总反应式:2Zn + 4NH4Cl+2MnO22MnO2 + H2 = Mn2O3 + H2O4NH3 + Zn2+=[Zn(NH3)4]2+= [Zn(NH3)4]Cl2 + ZnCl2+ Mn2O3 + H2O2.铅蓄电池正极(PbO2):
PbO2 + 4H+ + SO42- + 2e- = PbSO4 + 2H2O负极(Pb):Pb – 2e- + SO42- = PbSO4原电池反应:
PbO2 + Pb + 2H2SO4 = 2PbSO4 + 2H2O3.镍氢电池镍氢电池是近年来开发出来的可充电电池,它可以取代产生镉污染的镉镍电池。其总反应式是H2 + NiO(OH) == Ni(OH)2。试据此写出正、负两极的电极反应式。4.钮扣电池有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液是KOH,电极反应为:(-)Zn + 2OH- - 2e- = ZnO + H2O(+)Ag2O + H2O + 2e- = 2Ag + 2OH-总反应式:Ag2O + Zn = 2Ag + 2OH-某些以及病患者,主要是心博动动力不足,可以考虑给他装上起博器,那需要一个电源。此电源应该具备哪些特点?体积小、轻、高能、寿命长 5.锂电池4.新型燃料电池这种电池的优点是什么? 能量转化率很高、可持续使用、不污染环境等 (1)氢氧燃料电池示意图 负极:2H2 -4e- = 4H+ 4H+ + 4OH- = 4H2O 正极:O2 + 4H2O+ 4e- = 4OH-总反应:2H2 + O2 = 2H2O (2)铝-空气-海水电池 我国首创以铝-空气-海水电池作为能源的新型海水标志灯,它以海水为电解溶液,靠空气中的氧气使铝不断氧化而产生电流。只要把灯放入海水中数分钟,就会发出耀眼的白光。则该电源的负极材料为 ,正极材料为 ,正、负极反应分别为 、 。负极材料为铝,正极材料为石墨(一) 4Al -12e- = 4Al3+(+) 6H2O + 3O2 + 12e- = 12OH-(3)甲烷燃料电池 有人将铂丝插入KOH溶液中作电极,又在两极分别通入CH4和O2,设计成一种燃料电池,则通入CH4的铂丝为 极,发生的电极反应为 ;该电池放电反应的化学方程式 ;电池工作时,溶液的pH为 (变大、变小,不变)负;CH4 + 10OH- - 8e- = CO32- + 7H2O; CH4 + 2O2 + 2KOH = K2CO3 + 3H2O;
变小 返回
而铜片上没有实验现象:电流计指针发生转,
Cu片上有气泡产生原电池工作原理2、原电池工作原理较活泼的金属失去电子发生氧化反应,电子从较活泼金属(负极)通过外电
路流向较不活泼的金属(正极) 。实验探究形成原电池的条件(可以)(可以)(可以)(不可以)形成条件一:
活泼性不同的两个电极负极:较活泼的金属
正极:较不活泼的金属、石墨等第一组实验(可以)(不可以)形成条件二:电极需插进电解质溶液中;第二组实验实验探究形成原电池的条件第三组实验实验探究形成原电池的条件形成条件三:必须形成闭合回路(不可以)你知道了吗
把a、b、c、d四块金属片浸入稀硫酸中,用
导线两两相连组成原电池。若a、b相连时,a为
负极;c、d相连时,电流由d到c;a、c相连时,
c极上产生大量气泡,b、d相连时,b上有大量气
泡产生,则四种金属的活动性顺序由强到弱的为:
( )
A.a > b > c > d B.a > c > d > b
C.c > a > b .> d D.b > d > c > a B你记住了吗?
本课时重点学习了原电池的工作原理 构成原电池的三个条件。动脑动手有下列材料:Zn片(2片)、Cu片(2片)、
导线、水果 (西红柿、苹果等)、电流计,
请设计一个装置使电流计指针发生偏转,
并画出设计草图。
Zn思考题:请根据反应 Fe + 2Fe 3+ = 3Fe 2+
设计一个原电池,画出装置图预习:1、本节 “二、化学电源”
2、“三、 金属的电化学腐蚀原电池的工作原理较活泼的金属发生氧化反应,电子从较活泼的金属(负极)通过外电路流向较不活泼的金属(正极)。 电子流向:
负极 正极导线组成原电池的条件有两种活泼性不同的金属(或一种是非金属导体)作电极
电极材料均插入电解质溶液中
两极相连形成闭合电路 第四节 原电池原理及其应用 一、原电池 二、化学电源 什么叫原电池?构成原电池的条件是什么? 我们所学的原电池有哪些缺点? 为什么时间一长就不产生电流了呢? 怎样的电池才实用呢?产生的电压稳定且较高,使于携带、回收,对环境影响小等特点。 1.干电池负极(锌筒):Zn – 2e- = Zn2+ 正极(石墨):2NH4+ + 2e- = 2NH3↑ + H2 ↑ 总反应式:2Zn + 4NH4Cl+2MnO22MnO2 + H2 = Mn2O3 + H2O4NH3 + Zn2+=[Zn(NH3)4]2+= [Zn(NH3)4]Cl2 + ZnCl2+ Mn2O3 + H2O2.铅蓄电池正极(PbO2):
PbO2 + 4H+ + SO42- + 2e- = PbSO4 + 2H2O负极(Pb):Pb – 2e- + SO42- = PbSO4原电池反应:
PbO2 + Pb + 2H2SO4 = 2PbSO4 + 2H2O3.镍氢电池镍氢电池是近年来开发出来的可充电电池,它可以取代产生镉污染的镉镍电池。其总反应式是H2 + NiO(OH) == Ni(OH)2。试据此写出正、负两极的电极反应式。4.钮扣电池有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液是KOH,电极反应为:(-)Zn + 2OH- - 2e- = ZnO + H2O(+)Ag2O + H2O + 2e- = 2Ag + 2OH-总反应式:Ag2O + Zn = 2Ag + 2OH-某些以及病患者,主要是心博动动力不足,可以考虑给他装上起博器,那需要一个电源。此电源应该具备哪些特点?体积小、轻、高能、寿命长 5.锂电池4.新型燃料电池这种电池的优点是什么? 能量转化率很高、可持续使用、不污染环境等 (1)氢氧燃料电池示意图 负极:2H2 -4e- = 4H+ 4H+ + 4OH- = 4H2O 正极:O2 + 4H2O+ 4e- = 4OH-总反应:2H2 + O2 = 2H2O (2)铝-空气-海水电池 我国首创以铝-空气-海水电池作为能源的新型海水标志灯,它以海水为电解溶液,靠空气中的氧气使铝不断氧化而产生电流。只要把灯放入海水中数分钟,就会发出耀眼的白光。则该电源的负极材料为 ,正极材料为 ,正、负极反应分别为 、 。负极材料为铝,正极材料为石墨(一) 4Al -12e- = 4Al3+(+) 6H2O + 3O2 + 12e- = 12OH-(3)甲烷燃料电池 有人将铂丝插入KOH溶液中作电极,又在两极分别通入CH4和O2,设计成一种燃料电池,则通入CH4的铂丝为 极,发生的电极反应为 ;该电池放电反应的化学方程式 ;电池工作时,溶液的pH为 (变大、变小,不变)负;CH4 + 10OH- - 8e- = CO32- + 7H2O; CH4 + 2O2 + 2KOH = K2CO3 + 3H2O;
变小 返回
