电化学[下学期]
图片预览











文档简介
(共37张PPT)
课题:
电化学(复习)
福山一中 慕贤玲
学习目标:
运用同一电解池或串联电路中的各电极得、失电子数相等进行有关计算。
掌握原电池、电解池的有关概念;
牢记放电顺序,能准确判断电 极反应,能正确书写电极反应式及总反应式;
知识回顾
原电池 电解池 电镀池
定义
装置举例
形成条件
电极名称
电极反应
电子流向
铜锌原电池
将化学能……
电解氯化铜
将电能……
①②③④
①②③④
①②
正极、负极
阴极、阳极
阴极、阳极
负极氧化反应正极还原反应
阳极氧化反应阴极还原反应
阳极……
阴极……
由负极……
由电源……
同电解池
应用电解……
铜上镀锌
重点出击:
一、原电池、电解池、
电镀池的判断
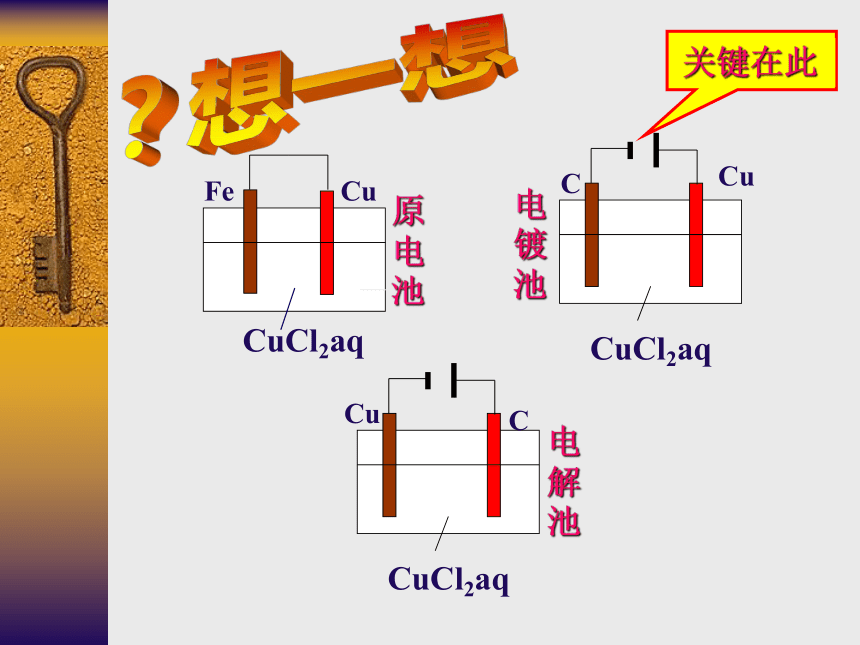
Fe
Cu
CuCl2aq
CuCl2aq
Cu
C
CuCl2aq
Cu
C
原电池
电镀池
电解池
关键在此
原电池、电解池、电镀池的判定规律:
若无外接电源,可能是原电池,然后依据原电池的形成条件分析判定;
若有外接电源,两极插入电解质溶液中,则可能是电解池或电镀池。当阳极金属与电解质溶液中的金属阳离子相同则为电镀池,其余情况为电解池。
重点出击
二、判断电极反应(定性)
电解液中含有K+、Cl-、SO42-、OH- (少 量)、Cu2+、H+(少量),
⑴用两个石墨棒作电极电解,开始时
阳极上电极反应式是______________; 阴极上电极反应式是______________
⑵改用两个铜棒作电极电解时,则阳极现象是_______________, 电极反应式是______________; 阴极上电极反应式是______________。
2Cl- - 2e - → Cl2↑
Cu2++2e- →Cu
Cu棒逐渐变细
Cu2++2e- → Cu
Cu -2e- → Cu2+
小结与反思:
⑴阳极:
关键是放电顺序:
⑵阴极:
(活性电极)>
S2— >I— >Br— >Cl—
>OH— >含氧酸根>F—
Ag+>Hg2+>Fe3+>Cu2+>
H+>Pb2+>Sn2+> Fe2+> Zn2+ >
Al3+> Mg2+> Na+> Ca2+> K+
能根据电解规律,推断阳极和阴极上所发生的电极反应。产物是什么?有何现象?能熟练地写出电极反应式和电解总的化学方程式。
必须明确该电解池的电解质溶液中存在的离子,电解池的阴、阳极的电极材料,是惰性(Pt、石墨)电极还是金属电极(尤其是阳极材料)。
水溶液中电解的几种类型(惰性电 极):
类型 物质类别
电解水型
电解电解质型
电解水和
电解质型
含氧酸、强碱、活泼金属含氧酸盐
不活泼金属无氧酸盐、无氧酸
活泼金属的无氧酸盐、
不活泼金属的含氧酸盐
应用与实践
蓄电池使用日久后,正负极标志模糊,现根据下列两种条件,如何来判别正负极:
⑴ 利用氯化铜溶液,两根带有铜导线的碳棒;
⑵ 利用硫酸铜溶液,两根铜导线.
解析:
(1)先将碳棒上的铜线分别与蓄电池两极相连,然后将碳棒插入氯化铜溶液中,经一段时间后碳棒上有红色物质析出的所连电极为负极。
(2)将铜线与蓄电池两极相连后,插入硫酸铜溶液中,经一段时间后,铜导线变粗的所连电极为负极。
重点出击
三、计算各电极产物的物 质的量(定量)
?
⑴用铂电极电解CuSO4溶液500mL,当阴极质量恰好不再增加时,标准状况下阳极产生11.2L的气体,则原溶液中CuSO4的物质的量浓度为( )
A.0.5mol/L B.1.0mol/L
C.1.5mol/L D.2mol/L
D
思维透视
阴极:2Cu2++4e- → 2Cu
阳极:4OH - - 4e- → 2H2O+O2 ↑
n(Cu2+) ×2=0.5moL × 4
n(Cu2+)=1mol
C (Cu2+)=1mol/0.5L=2mol/L
?
(2)用铂电极电解CuSO4溶液500mL,经过一段时间后,标准状况下两极均产生11.2L的气体,则原溶液中CuSO4的物质的量浓度为( )
A.0.5mol/L B.0.8mol/L
C.1.0mol/L D.1.5mol/L
C
关键在此!
思维透视
阴极:Cu2++2e- → Cu
(开始)
2H++ 2e- → H2 ↑
(Cu2+完全放电后)
阳极:4OH - - 4e- → 2H2O + O2 ↑
n(Cu2+)×2 + 0.5moL×2=0.5moL×4
n(Cu2+)= 0.5moL
C(CuSO4)= 0.5moL/0.5L=1.0moL/L
小结与反思
根据得失电子守恒各电极析出的物质的量有如下关系: O2~2Cl2~2Cu~4Ag~2H2 ~4e-
这是电化学简单计算中重要的基本关系。
福山一中 慕贤玲
原电池定义
将化学能转变成电能的装置
电解池 定义
将电能转变成化学能的装置
电镀池定义
应用电解原理在某些金属表面镀上一层其它金属的装置
原电池形成条件:
①两个电极;
②电解质溶液;
③电极形成闭合电路 ;
④能自发进行的氧化还原反应.
电解池形成条件:
①直流电源;
②两个电极;
③电解质溶液;
④形成闭合电路.
电镀池形成条件:
①镀层金属接电源正极,待镀金属接电源负极;
②电镀液必须含有镀层金属的离子。
(电镀过程浓度基本不变)
原电池电极名称:
负极:较活泼的金属
正极:较不活泼的金属或
能导电的非金属
电解池电极名称:
阳极:与电源正极相连的极
阴极:与电源负极相连的极
电镀池电极名称: (名称同电解,但有限制条件)
阳极:必须是镀层金属
阴极:镀件
原电池电极反应:
负极:氧化反应,金属失电子 (燃料电池中燃料被氧化)
正极:还原反应,溶液中的阳离子得电子或氧气得电子(吸氧腐蚀)
电解池电极反应:
阳极:氧化反应,溶液中的阴离子或电极金属失电子
阴极:还原反应,溶液中的阳离子得电子
电镀池电极反应:
阳极:金属电极失电子(溶解)
阴极:电镀液中阳离子得电子 ( 控制条件,H+不放电)
原电池中电子流向:
由负极沿导线流向正极
电解池中电子流向:
由电源负极流入阴极,
再由阳极流向电源正极.
镀件
ZnSO4aq
Zn
电
镀
池
课题:
电化学(复习)
福山一中 慕贤玲
学习目标:
运用同一电解池或串联电路中的各电极得、失电子数相等进行有关计算。
掌握原电池、电解池的有关概念;
牢记放电顺序,能准确判断电 极反应,能正确书写电极反应式及总反应式;
知识回顾
原电池 电解池 电镀池
定义
装置举例
形成条件
电极名称
电极反应
电子流向
铜锌原电池
将化学能……
电解氯化铜
将电能……
①②③④
①②③④
①②
正极、负极
阴极、阳极
阴极、阳极
负极氧化反应正极还原反应
阳极氧化反应阴极还原反应
阳极……
阴极……
由负极……
由电源……
同电解池
应用电解……
铜上镀锌
重点出击:
一、原电池、电解池、
电镀池的判断
Fe
Cu
CuCl2aq
CuCl2aq
Cu
C
CuCl2aq
Cu
C
原电池
电镀池
电解池
关键在此
原电池、电解池、电镀池的判定规律:
若无外接电源,可能是原电池,然后依据原电池的形成条件分析判定;
若有外接电源,两极插入电解质溶液中,则可能是电解池或电镀池。当阳极金属与电解质溶液中的金属阳离子相同则为电镀池,其余情况为电解池。
重点出击
二、判断电极反应(定性)
电解液中含有K+、Cl-、SO42-、OH- (少 量)、Cu2+、H+(少量),
⑴用两个石墨棒作电极电解,开始时
阳极上电极反应式是______________; 阴极上电极反应式是______________
⑵改用两个铜棒作电极电解时,则阳极现象是_______________, 电极反应式是______________; 阴极上电极反应式是______________。
2Cl- - 2e - → Cl2↑
Cu2++2e- →Cu
Cu棒逐渐变细
Cu2++2e- → Cu
Cu -2e- → Cu2+
小结与反思:
⑴阳极:
关键是放电顺序:
⑵阴极:
(活性电极)>
S2— >I— >Br— >Cl—
>OH— >含氧酸根>F—
Ag+>Hg2+>Fe3+>Cu2+>
H+>Pb2+>Sn2+> Fe2+> Zn2+ >
Al3+> Mg2+> Na+> Ca2+> K+
能根据电解规律,推断阳极和阴极上所发生的电极反应。产物是什么?有何现象?能熟练地写出电极反应式和电解总的化学方程式。
必须明确该电解池的电解质溶液中存在的离子,电解池的阴、阳极的电极材料,是惰性(Pt、石墨)电极还是金属电极(尤其是阳极材料)。
水溶液中电解的几种类型(惰性电 极):
类型 物质类别
电解水型
电解电解质型
电解水和
电解质型
含氧酸、强碱、活泼金属含氧酸盐
不活泼金属无氧酸盐、无氧酸
活泼金属的无氧酸盐、
不活泼金属的含氧酸盐
应用与实践
蓄电池使用日久后,正负极标志模糊,现根据下列两种条件,如何来判别正负极:
⑴ 利用氯化铜溶液,两根带有铜导线的碳棒;
⑵ 利用硫酸铜溶液,两根铜导线.
解析:
(1)先将碳棒上的铜线分别与蓄电池两极相连,然后将碳棒插入氯化铜溶液中,经一段时间后碳棒上有红色物质析出的所连电极为负极。
(2)将铜线与蓄电池两极相连后,插入硫酸铜溶液中,经一段时间后,铜导线变粗的所连电极为负极。
重点出击
三、计算各电极产物的物 质的量(定量)
?
⑴用铂电极电解CuSO4溶液500mL,当阴极质量恰好不再增加时,标准状况下阳极产生11.2L的气体,则原溶液中CuSO4的物质的量浓度为( )
A.0.5mol/L B.1.0mol/L
C.1.5mol/L D.2mol/L
D
思维透视
阴极:2Cu2++4e- → 2Cu
阳极:4OH - - 4e- → 2H2O+O2 ↑
n(Cu2+) ×2=0.5moL × 4
n(Cu2+)=1mol
C (Cu2+)=1mol/0.5L=2mol/L
?
(2)用铂电极电解CuSO4溶液500mL,经过一段时间后,标准状况下两极均产生11.2L的气体,则原溶液中CuSO4的物质的量浓度为( )
A.0.5mol/L B.0.8mol/L
C.1.0mol/L D.1.5mol/L
C
关键在此!
思维透视
阴极:Cu2++2e- → Cu
(开始)
2H++ 2e- → H2 ↑
(Cu2+完全放电后)
阳极:4OH - - 4e- → 2H2O + O2 ↑
n(Cu2+)×2 + 0.5moL×2=0.5moL×4
n(Cu2+)= 0.5moL
C(CuSO4)= 0.5moL/0.5L=1.0moL/L
小结与反思
根据得失电子守恒各电极析出的物质的量有如下关系: O2~2Cl2~2Cu~4Ag~2H2 ~4e-
这是电化学简单计算中重要的基本关系。
福山一中 慕贤玲
原电池定义
将化学能转变成电能的装置
电解池 定义
将电能转变成化学能的装置
电镀池定义
应用电解原理在某些金属表面镀上一层其它金属的装置
原电池形成条件:
①两个电极;
②电解质溶液;
③电极形成闭合电路 ;
④能自发进行的氧化还原反应.
电解池形成条件:
①直流电源;
②两个电极;
③电解质溶液;
④形成闭合电路.
电镀池形成条件:
①镀层金属接电源正极,待镀金属接电源负极;
②电镀液必须含有镀层金属的离子。
(电镀过程浓度基本不变)
原电池电极名称:
负极:较活泼的金属
正极:较不活泼的金属或
能导电的非金属
电解池电极名称:
阳极:与电源正极相连的极
阴极:与电源负极相连的极
电镀池电极名称: (名称同电解,但有限制条件)
阳极:必须是镀层金属
阴极:镀件
原电池电极反应:
负极:氧化反应,金属失电子 (燃料电池中燃料被氧化)
正极:还原反应,溶液中的阳离子得电子或氧气得电子(吸氧腐蚀)
电解池电极反应:
阳极:氧化反应,溶液中的阴离子或电极金属失电子
阴极:还原反应,溶液中的阳离子得电子
电镀池电极反应:
阳极:金属电极失电子(溶解)
阴极:电镀液中阳离子得电子 ( 控制条件,H+不放电)
原电池中电子流向:
由负极沿导线流向正极
电解池中电子流向:
由电源负极流入阴极,
再由阳极流向电源正极.
镀件
ZnSO4aq
Zn
电
镀
池
同课章节目录
