江苏版必修1专题2第二单元复习课件离子反应[上学期]
文档属性
| 名称 | 江苏版必修1专题2第二单元复习课件离子反应[上学期] |

|
|
| 格式 | rar | ||
| 文件大小 | 209.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-04-18 00:00:00 | ||
图片预览





文档简介
课件19张PPT。一、电解质与非电解质1、电解质:凡是在水溶液里或熔化状态下能导电的化合物。如:酸、碱、盐等
非电解质:凡是在水溶液里和熔化状态下都不能导电的化合物。如:蔗糖、酒精等电解质练习1
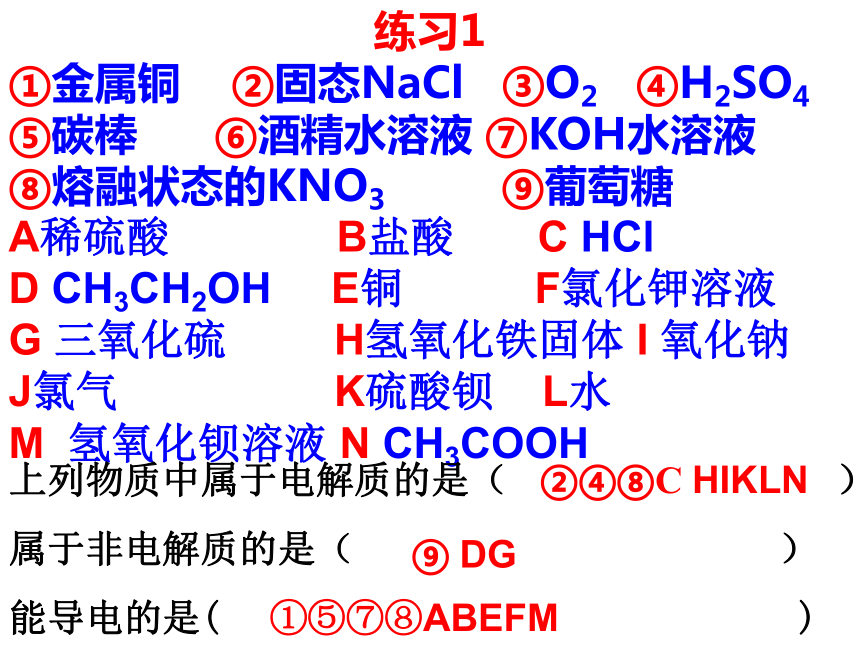
①金属铜 ②固态NaCl ③O2 ④H2SO4
⑤碳棒 ⑥酒精水溶液 ⑦KOH水溶液
⑧熔融状态的KNO3 ⑨葡萄糖
A稀硫酸 B盐酸 C HCl
D CH3CH2OH E铜 F氯化钾溶液
G 三氧化硫 H氢氧化铁固体 I 氧化钠
J氯气 K硫酸钡 L水
M 氢氧化钡溶液 N CH3COOH②④⑧C HIKLN⑨ DG上列物质中属于电解质的是( )
属于非电解质的是( )
能导电的是( )①⑤⑦⑧ABEFM 注意几个方面:
⑴电解质、非电解质均为化合物; 单质既不是电解质也不是非电解质;
⑵电解质不一定直接能导电, 如食盐晶体、氯化氢气体等不导电;
电解质必须在水溶液里或熔化状态下才能电离产生自由移动的离子。 如:碳酸钙虽然其水溶液几乎不导电,但在熔融状态下导电,因此它是电解质。
⑶能够导电的物质不一定全是电解质
电解质导电必须是用化合物本身能电离出自由移动的离子而导电,不能是发生化学反应生成的物质导电。如:CO2、SO2溶于水能导电,是由于它们与水反应生成的H2CO3、H2SO3能导电,所以CO2、SO2不是电解质,而是非电解质,SO2、CO2、SO3尽管它们的水溶液能导电,自身却不能直接电离因而是非电解质。
(4)某些难溶于水的化合物。如:BaSO4、AgCl等,由于它们溶解度太小,测不出其水溶液的导电性,但它们溶解的部分是完全电离的,所以是电解质。
(5)酸、碱、盐、水是电解质,蔗糖、酒精等是非电解质。 练习2 判断正误:
1、铜和石墨都能导电,它们都是电解质;Cl2不能导电,故Cl2是非电解质
2、液态HCl不导电,则液态HCl为非电解质;盐酸能导电,所以盐酸是电解质
3、硝酸钾晶体不导电,硝酸钾溶液能导电,所以硝酸钾溶液是电解质,硝酸钾晶体是非电解质
4、把SO3溶于水所得的溶液能导电,所以SO3是电解质
5、BaSO4难溶于水,所以BaSO4是非电解质
6、电解质都能够导电,能导电的物质都是电解质
7、非电解质都不能导电,不能导电的物质不一定是非电解质。√XXXXXX溶液导电性的不同说明什么问题?强电解质:在水溶液里全部电离为离子的电解质。
弱电解质:在水溶液里只有部分电离为离子的电解质。强电解质
弱电解质
非电解质2二.强弱电解质练习3.下列物质中哪些属于弱电解质( )A稀硫酸 B盐酸 C氯化钠
D酒精 E铜 F氯化钾溶液
G 三氧化硫 H氢氧化铁固体 I 氧化钠
J 氯气 K 硫酸钡 L 水
M 氢氧化钡溶液 N CH3COOH 练习4:下列叙述中,能证明某物质是弱电解质的是:( )
A 溶化时不导电
B 水溶液的能导电
C 水溶液的导电能力很差
D 溶液中已电离的离子和未电离的分子共存 HLND注意:在其它条件相同的情况下,溶液的导电性与溶液中自由移动的离子浓度有关。⑴两者主要区别是在溶液里能不能完全电离, 而不是溶液的导电能力的强弱。强电解质溶液导电性不一定强。强电解质(全部电离)
强酸:HCl、HNO3、H2SO4、HBr、HI、HClO4
强碱:KOH、NaOH、Ca(OH)2、Ba(OH)2
绝大多数盐类:CaCl2、CuSO4、AgCl、BaSO4、 CaCO3弱电解质(部分电离)
弱酸: H2S、H2CO3、CH3COOH、HF、HClO、H2SO3、等
弱碱:NH3·H2O、Cu(OH)2、Al(OH)3、 Fe(OH)3等
其它:水⑵有些化合物(如BaSO4、AgCl)虽溶解度小,但属强电解质,因溶解的部分能完全电离。三、表示电解质电离的式子叫电离方程式,简称电离式 MgCl2=Mg2++2Cl-NaOH=Na++OH-H2SO4=2H++SO42—NaHSO4=Na++H++SO42—NaHCO3的电离方程式_______________________________ ,
NaHSO4的电离方程式_______________________________。NaHCO3=Na++HCO3-(1)易溶于水的强电解质全电离
注意:NH4CH3COOH、 NH4CO3、 NH4HCO3等(属强电解质)弱酸弱碱盐全电离。
(2)弱酸的电离方程式:
如:HF≒H++F-例: 离子反应1.定义: 有离子参加或生成的反应电解质在水溶液中的反应属于离子反应2.离子反应发生的条件(1)生成难溶物质,如Cu(OH)2、BaSO4、AgCl等。 CuSO4+BaCl2=BaSO4↓+CuCl2(2)生成气态物质,如:CO2、SO2等。 CaCO3+2HCl=CaCl2+H2O +CO2↑(3)生成难电离物质,如弱酸、弱碱、水等。
NaOH+HCl=NaCl+H2O离子方程式定义:用实际参加反应的离子符号表示离子反应的式子。 (2)怎样书写离子方程式CuSO4溶液与BaCl2溶液进行离子反应的实质是:SO42- + Ba2+ == BaSO4↓1、写出化学方程式:例:2AgNO3 + CuCl2 == 2AgCl↓+ Cu(NO3)22、把易溶于水、易电离的物质写成离子形式,难溶或难电离的物质以及气体等仍用化学式表示。 2Ag++2NO3-+Cu2++2Cl- == 2AgCl↓+Cu2++2NO3-3、删去方程式两边形式相同的离子:2Ag++2NO3-+Cu2++2Cl- == 2AgCl↓+Cu2++2NO3-4、整理方程式并检查两边各元素的原子个数和电荷总数是否相等: 2Ag+ + 2Cl- == 2AgCl↓Ag+ + Cl- == AgCl↓离子反应的实质是:离子浓度减少的过程改写的规则:(1)可写成离子的物质:易溶于水、易电离的物质。A.强酸:H2SO4、HCl、HNO3
B.强碱:NaOH、KOH、Ba(OH)2
[说明:Ca(OH)2微溶于水,溶液中一般写离子,
悬浊液则写化学式]
C .可溶性盐(注意记忆课本后的溶解性表)(2)仍用化学式表示的物质A.难溶物质:BaSO4、Cu(OH)2等
B.难电离物质:水、CH3COOH、HF、CH3CH2OH等(弱酸、弱碱等一些弱电解质,非电解质)
C.气体:CO2、H2、SO2等
D.单质:H2、Na、I2 、O2等
E.氧化物:Na2O、Fe2O3等溶液中常见的离子反应:离子互换的非氧化还原反应:——有难溶物、难电离物及挥发性物质 离子间的氧化还原反应:——氧化剂、还原剂越强,离子反应越完全 书写离子方程式应注意的问题:⑴ 凡非溶液中进行的反应一般不能写离子方程式。如:NH4Cl固体与Ca(OH)2固体混合加热,只能写化学方程式。即: 2NH4Cl(固)+Ca(OH)2(固)=CaCl2+2NH3↑+2H2O⑵单质、氧化物在离子方程式中一律写化学式;弱酸(HF 、H2S、HClO、 H2SO3等)、弱碱(NH3·H2O)等难电离物质写化学式;难溶于水的物质(如CaCO3 、 BaSO3、FeS、BaSO4、Fe(OH)3等)写化学式。 1、SO2气体溶于足量氢氧化钠溶液SO2 + 2OH- == SO32- +H2O2、向氨水中加入稀盐酸NH3·H2O+H+==NH4++H2O3、碳酸氢钙溶液与盐酸反应HCO3-+H+==H2O+CO2↑⑶多元弱酸的酸式盐的酸根离子在离子方程式中不能拆开
写。例:1、NaHCO3与盐酸反应:HCO3-+H+==H2O+CO2↑2、KHSO4与BaCl2反应:SO42-+Ba2+==BaSO4↓(4) 操作顺序或反应物相对量不同时
离子方程式不同。例:1、少量烧碱滴入Ca(HCO3)2溶液Ca2++HCO3-+OH-==CaCO3↓+H2O2、足量烧碱滴入Ca(HCO3)2溶液Ca2++2HCO3-+2OH-==CaCO3↓+CO32-+2H2O 附: 离子方程式不仅可表示一定物质间的某个反应,而且可表示所有同一类型的离子反应。练习:
1.请指出下列离子方程式是否正确?如不正确,请加以改正。
(1)碳酸钠与足量盐酸反应
CO32-+2H+=H2O+CO2↑
(2)碳酸钙与盐酸反应
CO32-+2H+=H2O+CO2↑ 对 错 正确写法: CaCO3+2H+=Ca2++H2O+CO2↑2.判断下列离子方程式是否正确?对不正确的指明原因.
A、硫酸铜溶液与硫化钾溶液反应:CuSO4 +S2— = CuS↓+SO42—
B、硝酸银溶液与氯化钠溶液反应:Ag+ +Cl— = AgCl
C、碳酸钡放入稀盐酸中:BaCO3+2H+ = Ba2+ +H2O +CO2↑
D、铁片放入稀盐酸中:2Fe +6H+ = 2Fe3+ +3H2↑
E、醋酸与氢氧化钠溶液反应:H+ + OH— = H2O4思考:
A.NaHCO3溶液与Ca(OH)2溶液混合? ⑴NaHCO3少量时:Ca2++HCO3-+OH-==CaCO3↓+H2O⑵ NaHCO3过量时:Ca2++2HCO3-+2OH-==CaCO3↓+CO32-+2H2O⑴KHSO4少量时:Ba2++SO42-+H++OH-==BaSO4 ↓ +H2O⑵ KHSO4过量时:Ba2++SO42-+2H++2OH-==BaSO4↓+2H2OB.KHSO4溶液与Ba(OH)2溶液混合?3.写出下列反应的离子方程式。
(1)少量二氧化碳通入澄清石灰水中
(2)过量二氧化碳通入澄清石灰水中 CO2+Ca2++2OH-=CaCO3↓+H2OCO2+OH-=HCO3-离子共存问题:1. 同一溶液中若离子间符合下列任意一个条件就会发生离子反应,离子之间便不能在溶液中大量共存。⑴生成难溶物或微溶物 (熟记溶解度表)如:Ba2+与CO32-;Ag+与Br-;Ca2+与SO42-;H+与SiO32-或 AlO2- ;OH-与Ag+、Fe3+、Cu2+、Al3+等;Al3+与AlO2-;等等⑵生成气体、挥发性或难电离物质:如:H+与CO32-、 HCO3- 、S2-、SO32- 、HS-、HSO3-、F-、ClO-、CH3COO-、等生成弱酸;OH-与NH4+、 HCO3- 、H+等。
附: HCO3- 、HS-、 HSO3-等在酸性、碱性中都不能共存。(3)发生氧化还原反应:氧化性离子[如Fe3+、NO3-(H+)、ClO-、MnO4-等]与还原性离子(如S2-、I-、 Fe2+、SO32-等)不能大量共存。2、附加隐含条件的应用规律:⑴溶液无色透明时,则溶液中一定没有色离子。 常见的有色离子:Cu2+(蓝)、Fe3+(橙黄)、Fe2+(绿)、MnO4-(紫红)等⑵强碱性(PH>7)溶液中肯定不存在与OH-反应的离子。 ⑶强酸性(PH<7)溶液中肯定不存在与H+反应的离子。 (4)若只说水电离出的H+(或OH-)为10-1mol·L-1或其它数值时,则溶液酸性、碱性都有可能。(4)发生双水解生成气体和沉淀
如Fe3+、Al3+与HCO3-、CO32-、S2-等
附:S2-与SO3-在中性和碱性中能共存,但在酸性中能反生氧化还原反应;S2O32-在酸性中能发生氧化还原反应: S2O32-+2H+=S↓+SO2↑+H2O 离子反应
1B 2D 3D 4B 5 C
6D 7B 8C 9B 10C
11B 12B 13B 14B 15D
16 D 17 D 18B 19A 20 D
21B 22C 23A 24 C 25A
26A 27B 28A 29D 30A
31D 32D 33 A
34 BD 35CD 36CD 37BD 38B 39AD 40AB 41AD 42BC 43C
非电解质:凡是在水溶液里和熔化状态下都不能导电的化合物。如:蔗糖、酒精等电解质练习1
①金属铜 ②固态NaCl ③O2 ④H2SO4
⑤碳棒 ⑥酒精水溶液 ⑦KOH水溶液
⑧熔融状态的KNO3 ⑨葡萄糖
A稀硫酸 B盐酸 C HCl
D CH3CH2OH E铜 F氯化钾溶液
G 三氧化硫 H氢氧化铁固体 I 氧化钠
J氯气 K硫酸钡 L水
M 氢氧化钡溶液 N CH3COOH②④⑧C HIKLN⑨ DG上列物质中属于电解质的是( )
属于非电解质的是( )
能导电的是( )①⑤⑦⑧ABEFM 注意几个方面:
⑴电解质、非电解质均为化合物; 单质既不是电解质也不是非电解质;
⑵电解质不一定直接能导电, 如食盐晶体、氯化氢气体等不导电;
电解质必须在水溶液里或熔化状态下才能电离产生自由移动的离子。 如:碳酸钙虽然其水溶液几乎不导电,但在熔融状态下导电,因此它是电解质。
⑶能够导电的物质不一定全是电解质
电解质导电必须是用化合物本身能电离出自由移动的离子而导电,不能是发生化学反应生成的物质导电。如:CO2、SO2溶于水能导电,是由于它们与水反应生成的H2CO3、H2SO3能导电,所以CO2、SO2不是电解质,而是非电解质,SO2、CO2、SO3尽管它们的水溶液能导电,自身却不能直接电离因而是非电解质。
(4)某些难溶于水的化合物。如:BaSO4、AgCl等,由于它们溶解度太小,测不出其水溶液的导电性,但它们溶解的部分是完全电离的,所以是电解质。
(5)酸、碱、盐、水是电解质,蔗糖、酒精等是非电解质。 练习2 判断正误:
1、铜和石墨都能导电,它们都是电解质;Cl2不能导电,故Cl2是非电解质
2、液态HCl不导电,则液态HCl为非电解质;盐酸能导电,所以盐酸是电解质
3、硝酸钾晶体不导电,硝酸钾溶液能导电,所以硝酸钾溶液是电解质,硝酸钾晶体是非电解质
4、把SO3溶于水所得的溶液能导电,所以SO3是电解质
5、BaSO4难溶于水,所以BaSO4是非电解质
6、电解质都能够导电,能导电的物质都是电解质
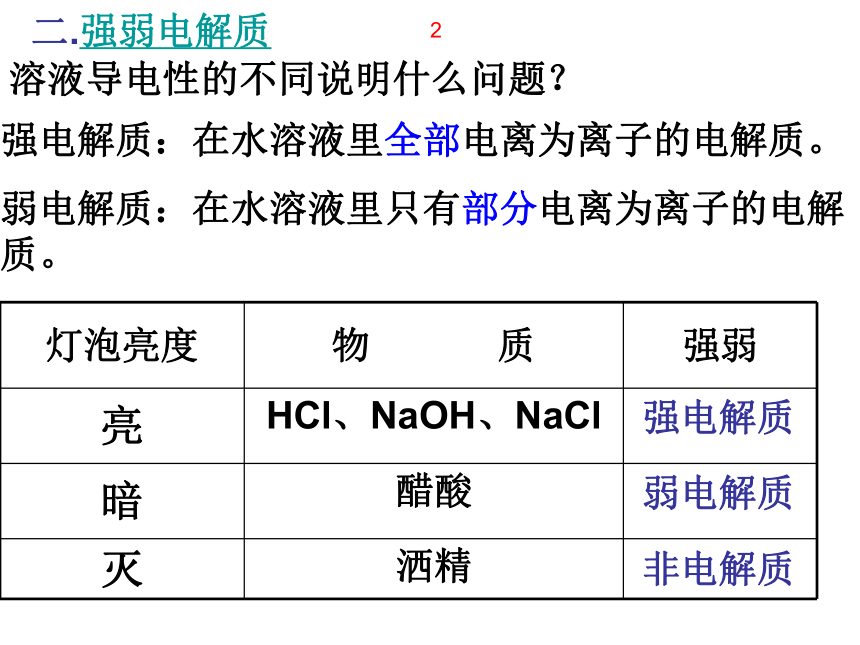
7、非电解质都不能导电,不能导电的物质不一定是非电解质。√XXXXXX溶液导电性的不同说明什么问题?强电解质:在水溶液里全部电离为离子的电解质。
弱电解质:在水溶液里只有部分电离为离子的电解质。强电解质
弱电解质
非电解质2二.强弱电解质练习3.下列物质中哪些属于弱电解质( )A稀硫酸 B盐酸 C氯化钠
D酒精 E铜 F氯化钾溶液
G 三氧化硫 H氢氧化铁固体 I 氧化钠
J 氯气 K 硫酸钡 L 水
M 氢氧化钡溶液 N CH3COOH 练习4:下列叙述中,能证明某物质是弱电解质的是:( )
A 溶化时不导电
B 水溶液的能导电
C 水溶液的导电能力很差
D 溶液中已电离的离子和未电离的分子共存 HLND注意:在其它条件相同的情况下,溶液的导电性与溶液中自由移动的离子浓度有关。⑴两者主要区别是在溶液里能不能完全电离, 而不是溶液的导电能力的强弱。强电解质溶液导电性不一定强。强电解质(全部电离)
强酸:HCl、HNO3、H2SO4、HBr、HI、HClO4
强碱:KOH、NaOH、Ca(OH)2、Ba(OH)2
绝大多数盐类:CaCl2、CuSO4、AgCl、BaSO4、 CaCO3弱电解质(部分电离)
弱酸: H2S、H2CO3、CH3COOH、HF、HClO、H2SO3、等
弱碱:NH3·H2O、Cu(OH)2、Al(OH)3、 Fe(OH)3等
其它:水⑵有些化合物(如BaSO4、AgCl)虽溶解度小,但属强电解质,因溶解的部分能完全电离。三、表示电解质电离的式子叫电离方程式,简称电离式 MgCl2=Mg2++2Cl-NaOH=Na++OH-H2SO4=2H++SO42—NaHSO4=Na++H++SO42—NaHCO3的电离方程式_______________________________ ,
NaHSO4的电离方程式_______________________________。NaHCO3=Na++HCO3-(1)易溶于水的强电解质全电离
注意:NH4CH3COOH、 NH4CO3、 NH4HCO3等(属强电解质)弱酸弱碱盐全电离。
(2)弱酸的电离方程式:
如:HF≒H++F-例: 离子反应1.定义: 有离子参加或生成的反应电解质在水溶液中的反应属于离子反应2.离子反应发生的条件(1)生成难溶物质,如Cu(OH)2、BaSO4、AgCl等。 CuSO4+BaCl2=BaSO4↓+CuCl2(2)生成气态物质,如:CO2、SO2等。 CaCO3+2HCl=CaCl2+H2O +CO2↑(3)生成难电离物质,如弱酸、弱碱、水等。
NaOH+HCl=NaCl+H2O离子方程式定义:用实际参加反应的离子符号表示离子反应的式子。 (2)怎样书写离子方程式CuSO4溶液与BaCl2溶液进行离子反应的实质是:SO42- + Ba2+ == BaSO4↓1、写出化学方程式:例:2AgNO3 + CuCl2 == 2AgCl↓+ Cu(NO3)22、把易溶于水、易电离的物质写成离子形式,难溶或难电离的物质以及气体等仍用化学式表示。 2Ag++2NO3-+Cu2++2Cl- == 2AgCl↓+Cu2++2NO3-3、删去方程式两边形式相同的离子:2Ag++2NO3-+Cu2++2Cl- == 2AgCl↓+Cu2++2NO3-4、整理方程式并检查两边各元素的原子个数和电荷总数是否相等: 2Ag+ + 2Cl- == 2AgCl↓Ag+ + Cl- == AgCl↓离子反应的实质是:离子浓度减少的过程改写的规则:(1)可写成离子的物质:易溶于水、易电离的物质。A.强酸:H2SO4、HCl、HNO3
B.强碱:NaOH、KOH、Ba(OH)2
[说明:Ca(OH)2微溶于水,溶液中一般写离子,
悬浊液则写化学式]
C .可溶性盐(注意记忆课本后的溶解性表)(2)仍用化学式表示的物质A.难溶物质:BaSO4、Cu(OH)2等
B.难电离物质:水、CH3COOH、HF、CH3CH2OH等(弱酸、弱碱等一些弱电解质,非电解质)
C.气体:CO2、H2、SO2等
D.单质:H2、Na、I2 、O2等
E.氧化物:Na2O、Fe2O3等溶液中常见的离子反应:离子互换的非氧化还原反应:——有难溶物、难电离物及挥发性物质 离子间的氧化还原反应:——氧化剂、还原剂越强,离子反应越完全 书写离子方程式应注意的问题:⑴ 凡非溶液中进行的反应一般不能写离子方程式。如:NH4Cl固体与Ca(OH)2固体混合加热,只能写化学方程式。即: 2NH4Cl(固)+Ca(OH)2(固)=CaCl2+2NH3↑+2H2O⑵单质、氧化物在离子方程式中一律写化学式;弱酸(HF 、H2S、HClO、 H2SO3等)、弱碱(NH3·H2O)等难电离物质写化学式;难溶于水的物质(如CaCO3 、 BaSO3、FeS、BaSO4、Fe(OH)3等)写化学式。 1、SO2气体溶于足量氢氧化钠溶液SO2 + 2OH- == SO32- +H2O2、向氨水中加入稀盐酸NH3·H2O+H+==NH4++H2O3、碳酸氢钙溶液与盐酸反应HCO3-+H+==H2O+CO2↑⑶多元弱酸的酸式盐的酸根离子在离子方程式中不能拆开
写。例:1、NaHCO3与盐酸反应:HCO3-+H+==H2O+CO2↑2、KHSO4与BaCl2反应:SO42-+Ba2+==BaSO4↓(4) 操作顺序或反应物相对量不同时
离子方程式不同。例:1、少量烧碱滴入Ca(HCO3)2溶液Ca2++HCO3-+OH-==CaCO3↓+H2O2、足量烧碱滴入Ca(HCO3)2溶液Ca2++2HCO3-+2OH-==CaCO3↓+CO32-+2H2O 附: 离子方程式不仅可表示一定物质间的某个反应,而且可表示所有同一类型的离子反应。练习:
1.请指出下列离子方程式是否正确?如不正确,请加以改正。
(1)碳酸钠与足量盐酸反应
CO32-+2H+=H2O+CO2↑
(2)碳酸钙与盐酸反应
CO32-+2H+=H2O+CO2↑ 对 错 正确写法: CaCO3+2H+=Ca2++H2O+CO2↑2.判断下列离子方程式是否正确?对不正确的指明原因.
A、硫酸铜溶液与硫化钾溶液反应:CuSO4 +S2— = CuS↓+SO42—
B、硝酸银溶液与氯化钠溶液反应:Ag+ +Cl— = AgCl
C、碳酸钡放入稀盐酸中:BaCO3+2H+ = Ba2+ +H2O +CO2↑
D、铁片放入稀盐酸中:2Fe +6H+ = 2Fe3+ +3H2↑
E、醋酸与氢氧化钠溶液反应:H+ + OH— = H2O4思考:
A.NaHCO3溶液与Ca(OH)2溶液混合? ⑴NaHCO3少量时:Ca2++HCO3-+OH-==CaCO3↓+H2O⑵ NaHCO3过量时:Ca2++2HCO3-+2OH-==CaCO3↓+CO32-+2H2O⑴KHSO4少量时:Ba2++SO42-+H++OH-==BaSO4 ↓ +H2O⑵ KHSO4过量时:Ba2++SO42-+2H++2OH-==BaSO4↓+2H2OB.KHSO4溶液与Ba(OH)2溶液混合?3.写出下列反应的离子方程式。
(1)少量二氧化碳通入澄清石灰水中
(2)过量二氧化碳通入澄清石灰水中 CO2+Ca2++2OH-=CaCO3↓+H2OCO2+OH-=HCO3-离子共存问题:1. 同一溶液中若离子间符合下列任意一个条件就会发生离子反应,离子之间便不能在溶液中大量共存。⑴生成难溶物或微溶物 (熟记溶解度表)如:Ba2+与CO32-;Ag+与Br-;Ca2+与SO42-;H+与SiO32-或 AlO2- ;OH-与Ag+、Fe3+、Cu2+、Al3+等;Al3+与AlO2-;等等⑵生成气体、挥发性或难电离物质:如:H+与CO32-、 HCO3- 、S2-、SO32- 、HS-、HSO3-、F-、ClO-、CH3COO-、等生成弱酸;OH-与NH4+、 HCO3- 、H+等。
附: HCO3- 、HS-、 HSO3-等在酸性、碱性中都不能共存。(3)发生氧化还原反应:氧化性离子[如Fe3+、NO3-(H+)、ClO-、MnO4-等]与还原性离子(如S2-、I-、 Fe2+、SO32-等)不能大量共存。2、附加隐含条件的应用规律:⑴溶液无色透明时,则溶液中一定没有色离子。 常见的有色离子:Cu2+(蓝)、Fe3+(橙黄)、Fe2+(绿)、MnO4-(紫红)等⑵强碱性(PH>7)溶液中肯定不存在与OH-反应的离子。 ⑶强酸性(PH<7)溶液中肯定不存在与H+反应的离子。 (4)若只说水电离出的H+(或OH-)为10-1mol·L-1或其它数值时,则溶液酸性、碱性都有可能。(4)发生双水解生成气体和沉淀
如Fe3+、Al3+与HCO3-、CO32-、S2-等
附:S2-与SO3-在中性和碱性中能共存,但在酸性中能反生氧化还原反应;S2O32-在酸性中能发生氧化还原反应: S2O32-+2H+=S↓+SO2↑+H2O 离子反应
1B 2D 3D 4B 5 C
6D 7B 8C 9B 10C
11B 12B 13B 14B 15D
16 D 17 D 18B 19A 20 D
21B 22C 23A 24 C 25A
26A 27B 28A 29D 30A
31D 32D 33 A
34 BD 35CD 36CD 37BD 38B 39AD 40AB 41AD 42BC 43C
