人教版高中化学选修三 3.1 晶体的常识 课件(37张PPT)
文档属性
| 名称 | 人教版高中化学选修三 3.1 晶体的常识 课件(37张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-11-17 20:31:31 | ||
图片预览










文档简介
课件37张PPT。第三章 晶体结构与性质第一节 晶体的常识第 一 课 时
水晶自然界中美丽的雪花 观察图片,下列固体在外形上有什么区别?明
矾
玛瑙 1.定义:晶体——具有规则几何外形的固体 非晶体——没有规则几何外形的固体
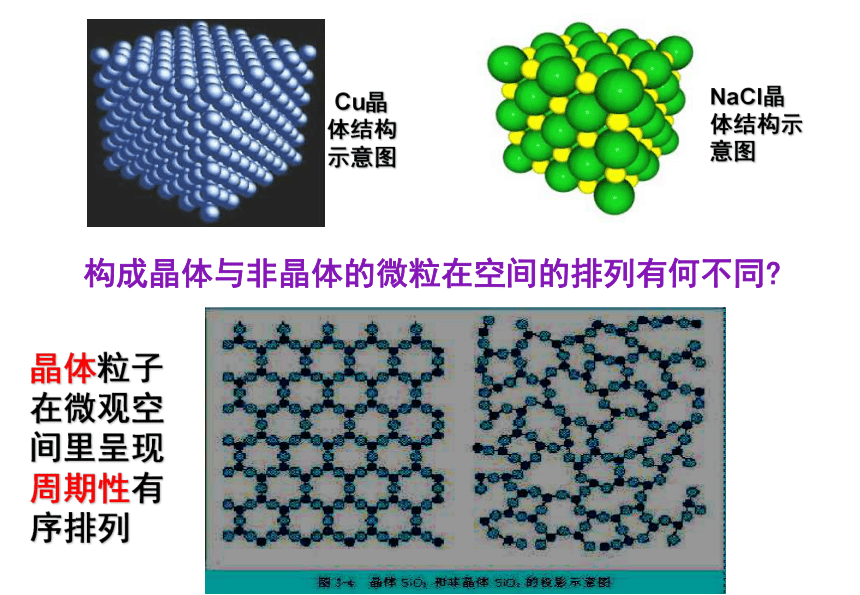
又称玻璃体一、晶体和非晶体思考: 为什么晶体呈现规则的几何外形,而非晶体没有规则的几何外形呢?你认为可能和什么因素有关?2.分类Cu晶体结构示意图构成晶体与非晶体的微粒在空间的排列有何不同?NaCl晶体结构示意图晶体粒子在微观空间里呈现周期性有序排列3.特点和性质:
(1)自范性(P60表):晶体能自发地呈现多面体外形的性质——是晶体中粒子在微观空间里呈现周期性有序排列的宏观表现。(2)物理性质(P61)表现各向异性(强度、导热性、光学性质)——同样反映了晶体内部粒子排列的有序性(3)晶体具有固定的熔点玻璃板云母片4. 晶体自范性的条件之一是生长的速率适当(P60)天然水晶球里的玛瑙和水晶思考:得到晶体的途径,除了冷却的方法,还有没有其它途径?你能列举哪些?5. 晶体形成的途径(P61)(1)熔融态物质凝固
(2)气态物质冷却不经液态直接凝固(凝华)
(3)溶质从溶液中析出许多固体粉末用肉眼看不到晶体外形,但在光学显微镜下可观察到规则的晶体外形玻璃的结构示意图2.根据晶体的物理性质的各向异性的特点,人们很容易识别用玻璃仿造的假宝石。你能列举一些可能有效的方法鉴别假宝石吗?1.(P62学与问)某同学在网站上找到一张玻璃的结构示意图,如右图,这张图说明玻璃是不是晶体?为什么?非晶体观察对称性、刻划玻璃、加热、X—射线衍射(1)物理性质差异
如:外形、硬度、熔点、折光率
(2)区分晶体和非晶体最科学的方法是对固体进行X-射线衍射实验。6.鉴别晶体和非晶体具有规则的几何外形有粒子在三维空间周期性有序排列各向异性固定不具有规则的几何外形没有粒子排列相对无序各向同性不固定微观粒子在三维空间是否呈现周期性有序排列1.下列关于晶体与非晶体的说法正确的是
A.晶体一定比非晶体的熔点高
B.晶体有自范性但排列无序
C.非晶体无自范性而且排列无序
D.固体SiO2一定是晶体
2. 区别晶体与非晶体最可靠的科学方法是
A.熔沸点 B.硬度
C.颜色 D.x-射线衍射实验CD[课堂练习]二﹑晶胞1. 晶胞:描述晶体结构的基本单元蜂巢与蜂室铜晶体铜晶胞 晶体与晶胞的关系可用蜂巢与峰室的关系比喻,然而蜂巢是有形的,晶胞是无形的,是人为划定的。铜晶体铜晶胞面心立方:
Cu在立方体顶点和面心晶体结构晶胞示意图碳
在立方体顶点和面心,
8个小立方体,其中4个立方体各有一个碳NaCl晶体结构和晶胞思考与交流:
1.上述铜晶体、金刚石、CO2晶体、NaCl晶体的晶胞的空间构形呈什么形状?
2.在上述晶体中,晶胞是如何排列的?晶胞之间是否存在空隙?CO2晶胞CO2在立方体顶点和面心NaCl 中: A顶点和面心
B棱和体心立方体P64无隙并置平行六面体无隙并置2、P63特点:常见的晶胞大都是平行六面体.晶胞在晶体中“无隙并置”.是晶胞不是晶胞面心立方:
在立方体顶点和面心NaCl 中:
A顶点和面心
B棱和体心CsCl 中:
A顶点,B体心金刚石:
立方体顶点和面心,8个小立方体,其中4个立方体各有一个碳石墨:层状结构,每层每个碳原子与三个碳原子成键,留下一个单电子,每层六个碳原子成六圆环3.三种典型立方晶体结构体心立方简单立方面心立方顶点顶点和体心顶点和面心顶点:4.晶胞中原子个数的计算X1/8 棱边:X1/4 面心:X1/2 体内:X1 体内:1面心:1/2顶点:1/8棱边:1/4分摊法:晶胞任意位置上的一个原子如果是被x个晶胞所共有,那么,每个晶胞对这个原子分得的份额就是1/x一个立方晶胞含有原子总个数:顶点数× 1/8 + 棱边数× 1/4
+ 面心数× 1/2 + 体内数× 1探究:
下图依次是金属钠(Na)、金属锌(Zn)、碘(12)、金刚石(C)晶胞的示意图,数一数,它们分别平均含几个原子?
钠、锌晶胞都是:8×1/8+1=2;
碘:(8×1/8+6×1/2)×2=8;
金刚石:8×1/8+6×1/2+4=8。NaZnI2金刚石1、现有甲、乙、丙、丁四种晶胞,可推知:甲晶体中A与B的离子个数比为 ;乙晶体的化学式为 ;丙晶体的化学式为______;丁晶体的化学式为______。1:1C2DEFXY3Z2.钙-钛矿晶胞结构如图所示。观察钙-钛矿晶胞结构,求该晶体中,钙、钛、氧的微粒个数比为多少?8× + 6 × =43. 下图是CO2分子晶体的晶胞结构示意图,其中有多少个分子?4.如图所示晶体中每个阳离子A或阴离子B,均可被另一种离子以四面体形式包围着,则该晶体对应的化学式为
A.AB B.A2B
C.AB3 D.A2B35. 最近发现一种由钛原子和碳原子构成的气态团簇分子,如下图所示,顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式是 。解析:由于本题团簇分子指的是一个分子的具体结构,并不是晶体中的最小的一个重复单位,不能采用均摊法分析,所以只需数出该结构内两种原子的数目就可以了。答案为:Ti14C136. 下列是NaCl晶胞示意图,晶胞中Na+和Clˉ的个数比是 ,与每个Cl- 距离最近且相等的Na+有 个 个,与每个Cl-距离最近且相等的Cl-有 个。1:16127.NiO晶体结构如图,Ni2+与邻近的O2-核间距为a×10-8 ㎝,计算NiO晶体密度(已知NiO摩尔质量为74.7g·mol-1)体内:1面心:1/2顶点:1/8棱边:1/4分摊法:晶胞任意位置上的一个原子如果是被x个晶胞所共有,那么,每个晶胞对这个原子分得的份额就是1/x一个立方晶胞含有原子总个数:顶点数× 1/8 + 棱边数× 1/4
+ 面心数× 1/2 + 体内数× 1六棱柱形晶胞三棱柱形晶胞顶点:X1/12
棱:
上下面棱:X1/4
侧棱:X1/6
面心:X1/2
体内:X1顶点:X1/6
棱:
上下面棱:X1/4
侧棱:X1/3
面心:X1/2
体内:X1
矾
玛瑙 1.定义:晶体——具有规则几何外形的固体 非晶体——没有规则几何外形的固体
又称玻璃体一、晶体和非晶体思考: 为什么晶体呈现规则的几何外形,而非晶体没有规则的几何外形呢?你认为可能和什么因素有关?2.分类Cu晶体结构示意图构成晶体与非晶体的微粒在空间的排列有何不同?NaCl晶体结构示意图晶体粒子在微观空间里呈现周期性有序排列3.特点和性质:
(1)自范性(P60表):晶体能自发地呈现多面体外形的性质——是晶体中粒子在微观空间里呈现周期性有序排列的宏观表现。(2)物理性质(P61)表现各向异性(强度、导热性、光学性质)——同样反映了晶体内部粒子排列的有序性(3)晶体具有固定的熔点玻璃板云母片4. 晶体自范性的条件之一是生长的速率适当(P60)天然水晶球里的玛瑙和水晶思考:得到晶体的途径,除了冷却的方法,还有没有其它途径?你能列举哪些?5. 晶体形成的途径(P61)(1)熔融态物质凝固
(2)气态物质冷却不经液态直接凝固(凝华)
(3)溶质从溶液中析出许多固体粉末用肉眼看不到晶体外形,但在光学显微镜下可观察到规则的晶体外形玻璃的结构示意图2.根据晶体的物理性质的各向异性的特点,人们很容易识别用玻璃仿造的假宝石。你能列举一些可能有效的方法鉴别假宝石吗?1.(P62学与问)某同学在网站上找到一张玻璃的结构示意图,如右图,这张图说明玻璃是不是晶体?为什么?非晶体观察对称性、刻划玻璃、加热、X—射线衍射(1)物理性质差异
如:外形、硬度、熔点、折光率
(2)区分晶体和非晶体最科学的方法是对固体进行X-射线衍射实验。6.鉴别晶体和非晶体具有规则的几何外形有粒子在三维空间周期性有序排列各向异性固定不具有规则的几何外形没有粒子排列相对无序各向同性不固定微观粒子在三维空间是否呈现周期性有序排列1.下列关于晶体与非晶体的说法正确的是
A.晶体一定比非晶体的熔点高
B.晶体有自范性但排列无序
C.非晶体无自范性而且排列无序
D.固体SiO2一定是晶体
2. 区别晶体与非晶体最可靠的科学方法是
A.熔沸点 B.硬度
C.颜色 D.x-射线衍射实验CD[课堂练习]二﹑晶胞1. 晶胞:描述晶体结构的基本单元蜂巢与蜂室铜晶体铜晶胞 晶体与晶胞的关系可用蜂巢与峰室的关系比喻,然而蜂巢是有形的,晶胞是无形的,是人为划定的。铜晶体铜晶胞面心立方:
Cu在立方体顶点和面心晶体结构晶胞示意图碳
在立方体顶点和面心,
8个小立方体,其中4个立方体各有一个碳NaCl晶体结构和晶胞思考与交流:
1.上述铜晶体、金刚石、CO2晶体、NaCl晶体的晶胞的空间构形呈什么形状?
2.在上述晶体中,晶胞是如何排列的?晶胞之间是否存在空隙?CO2晶胞CO2在立方体顶点和面心NaCl 中: A顶点和面心
B棱和体心立方体P64无隙并置平行六面体无隙并置2、P63特点:常见的晶胞大都是平行六面体.晶胞在晶体中“无隙并置”.是晶胞不是晶胞面心立方:
在立方体顶点和面心NaCl 中:
A顶点和面心
B棱和体心CsCl 中:
A顶点,B体心金刚石:
立方体顶点和面心,8个小立方体,其中4个立方体各有一个碳石墨:层状结构,每层每个碳原子与三个碳原子成键,留下一个单电子,每层六个碳原子成六圆环3.三种典型立方晶体结构体心立方简单立方面心立方顶点顶点和体心顶点和面心顶点:4.晶胞中原子个数的计算X1/8 棱边:X1/4 面心:X1/2 体内:X1 体内:1面心:1/2顶点:1/8棱边:1/4分摊法:晶胞任意位置上的一个原子如果是被x个晶胞所共有,那么,每个晶胞对这个原子分得的份额就是1/x一个立方晶胞含有原子总个数:顶点数× 1/8 + 棱边数× 1/4
+ 面心数× 1/2 + 体内数× 1探究:
下图依次是金属钠(Na)、金属锌(Zn)、碘(12)、金刚石(C)晶胞的示意图,数一数,它们分别平均含几个原子?
钠、锌晶胞都是:8×1/8+1=2;
碘:(8×1/8+6×1/2)×2=8;
金刚石:8×1/8+6×1/2+4=8。NaZnI2金刚石1、现有甲、乙、丙、丁四种晶胞,可推知:甲晶体中A与B的离子个数比为 ;乙晶体的化学式为 ;丙晶体的化学式为______;丁晶体的化学式为______。1:1C2DEFXY3Z2.钙-钛矿晶胞结构如图所示。观察钙-钛矿晶胞结构,求该晶体中,钙、钛、氧的微粒个数比为多少?8× + 6 × =43. 下图是CO2分子晶体的晶胞结构示意图,其中有多少个分子?4.如图所示晶体中每个阳离子A或阴离子B,均可被另一种离子以四面体形式包围着,则该晶体对应的化学式为
A.AB B.A2B
C.AB3 D.A2B35. 最近发现一种由钛原子和碳原子构成的气态团簇分子,如下图所示,顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式是 。解析:由于本题团簇分子指的是一个分子的具体结构,并不是晶体中的最小的一个重复单位,不能采用均摊法分析,所以只需数出该结构内两种原子的数目就可以了。答案为:Ti14C136. 下列是NaCl晶胞示意图,晶胞中Na+和Clˉ的个数比是 ,与每个Cl- 距离最近且相等的Na+有 个 个,与每个Cl-距离最近且相等的Cl-有 个。1:16127.NiO晶体结构如图,Ni2+与邻近的O2-核间距为a×10-8 ㎝,计算NiO晶体密度(已知NiO摩尔质量为74.7g·mol-1)体内:1面心:1/2顶点:1/8棱边:1/4分摊法:晶胞任意位置上的一个原子如果是被x个晶胞所共有,那么,每个晶胞对这个原子分得的份额就是1/x一个立方晶胞含有原子总个数:顶点数× 1/8 + 棱边数× 1/4
+ 面心数× 1/2 + 体内数× 1六棱柱形晶胞三棱柱形晶胞顶点:X1/12
棱:
上下面棱:X1/4
侧棱:X1/6
面心:X1/2
体内:X1顶点:X1/6
棱:
上下面棱:X1/4
侧棱:X1/3
面心:X1/2
体内:X1
