人教版高中化学选修三2.1共价键 课件(39张PPT)
文档属性
| 名称 | 人教版高中化学选修三2.1共价键 课件(39张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 4.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-11-17 20:36:46 | ||
图片预览






文档简介
课件39张PPT。第二章
分子结构与性质化学键:物质中相邻原子之间强烈的相互作用。
离子键:阴、阳离子之间通过静电作用形成的化学键。
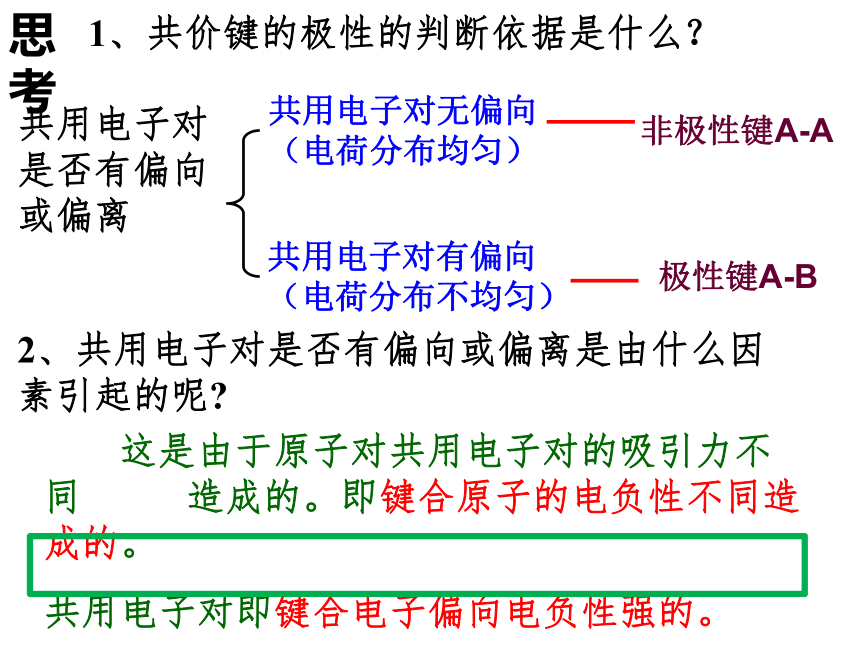
共价键:原子间通过共用电子对形成的化学键。 物质中相邻原子之间是靠什么作用而结合在一起?极性键A-B
非极性键A-A2、共价键的分类共用电子对的偏移1、共价键的定义原子间通过共用电子对形成的化学键共用电子对无偏向(电荷分布均匀)共用电子对有偏向(电荷分布不均匀)练习:指出下列微粒中的共价键类型1、O2
2 、HCl
3 、CO2
4、 H2O2
5 、Cl2
6 、N2非极性键极性键极性键(H-O-O-H)极性键 非极性键非极性键非极性键2、共用电子对是否有偏向或偏离是由什么因素引起的呢? 这是由于原子对共用电子对的吸引力不同 造成的。即键合原子的电负性不同造成的。
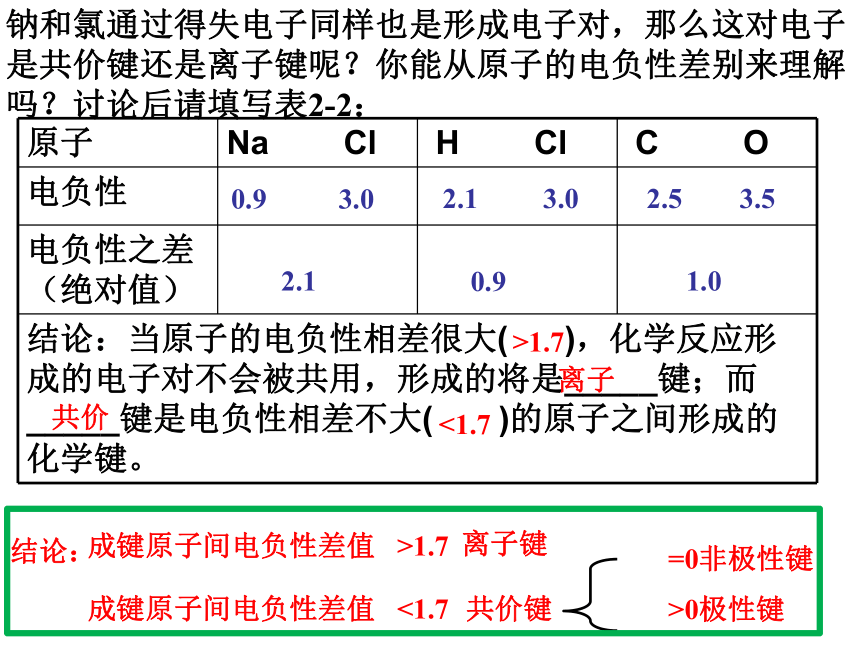
共用电子对即键合电子偏向电负性强的。1、共价键的极性的判断依据是什么?共用电子对是否有偏向或偏离思 考共用电子对有偏向(电荷分布不均匀)共用电子对无偏向(电荷分布均匀)非极性键A-A极性键A-B钠和氯通过得失电子同样也是形成电子对,那么这对电子是共价键还是离子键呢?你能从原子的电负性差别来理解吗?讨论后请填写表2-2:0.9 3.02.1 3.02.5 3.52.10.91.0离子共价 >1.7 <1.7结论: 成键原子间电负性差值 >1.7 离子键 成键原子间电负性差值 <1.7共价键=0非极性键>0极性键极性键
非极性键单键双键叁键2、共价键的分类共用电子对的偏移共用电子对的数目1、共价键的定义原子间通过共用电子对形成的化学键复习回忆第一节
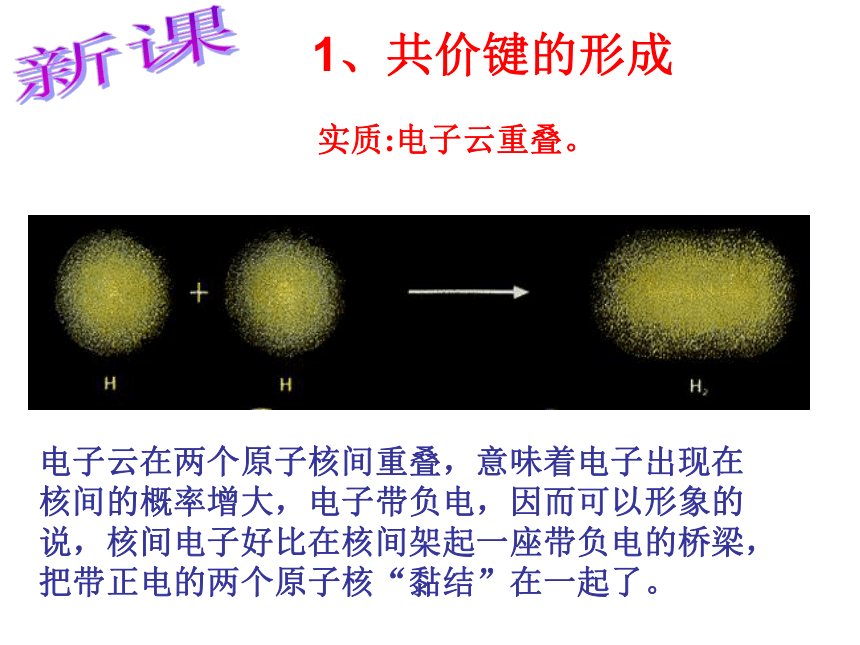
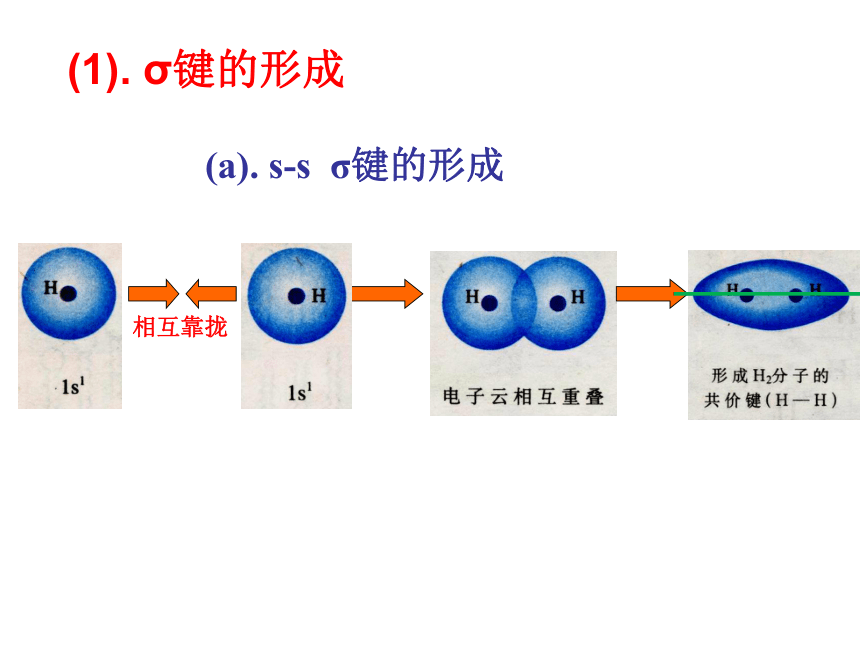
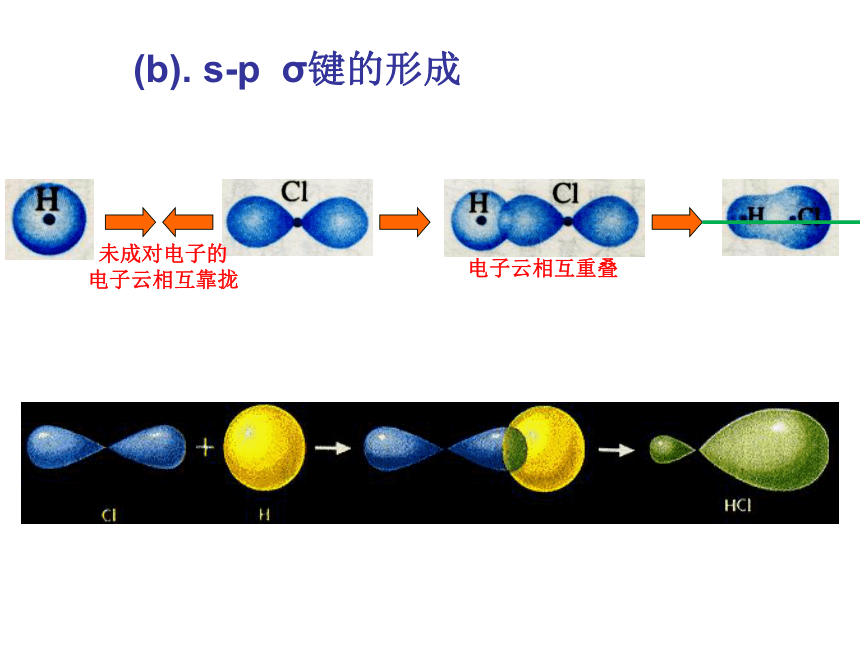
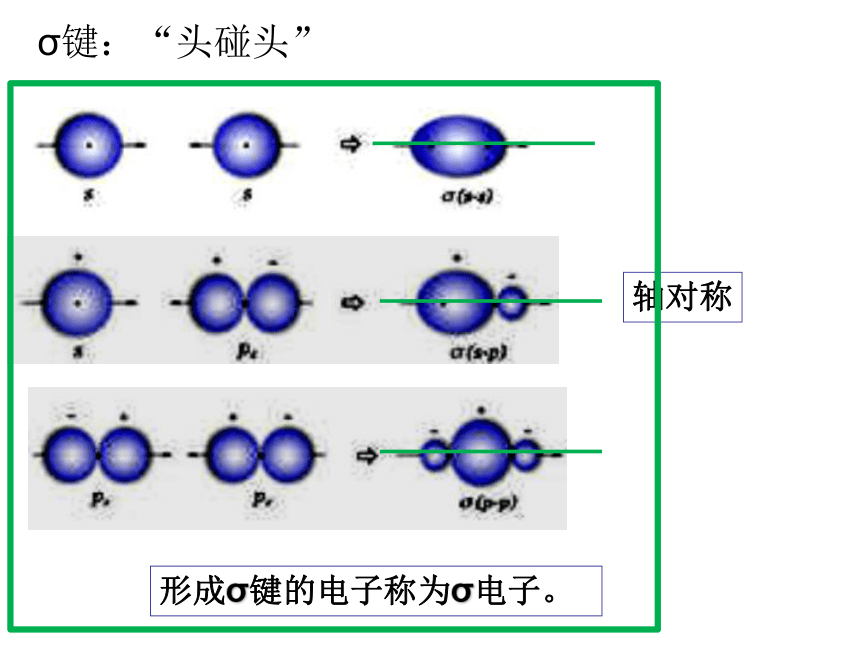
共价键第二章 分子结构与性质电子云在两个原子核间重叠,意味着电子出现在核间的概率增大,电子带负电,因而可以形象的说,核间电子好比在核间架起一座带负电的桥梁,把带正电的两个原子核“黏结”在一起了。1、共价键的形成实质:电子云重叠。新课(a). s-s σ键的形成(1). σ键的形成(b). s-p σ键的形成(c)、p-p σ键的形成σ键:“头碰头”轴对称形成σ键的电子称为σ电子。(2).π键的形成XZZpZ—pZ镜像对称形成π键的电子称为π电子。 π键:“肩并肩” 由原子轨道相互重叠形成的σ键和π键总称价键轨道科学探究1、已知氮分子的共价键是三键,你能模仿图2-1、图2-2、图2-3,通过画图来描述吗?(提示:氮原子各自 用三个p轨道分别跟另一个氮原子形成一个σ键和两个π键。2.乙烷、乙烯和乙炔分子中的共价键分别有几个σ键和几个π键组成?共价单键是σ键;
共价双键中有一个σ键,另一个是π键;
共价三键中有一个σ键和两个π键。 乙烷分子中由7个σ键组成;
乙烯分子中由5个σ键和1个π键组成;
乙炔分子中由3个σ键和2个π键组成。小 结沿轴方向“头碰头”平行方向“肩并肩”轴对称镜像对称重叠大,较难断裂重叠小,较易断裂共价单键是σ键,
共价双键中一个是 σ键,另一个是π键,共价三键中一个是σ键,另两个为π键。①、σ键:以形成化学键的两原子核的连线为轴作旋转操作,共价键电子云的图形不变,这种特征称为轴对称。如H-H键。类型:s—sσ、s—pσ、p—pσ等。实质:电子云重叠。④、判断共价键类型规律:
共价单键是σ键;
共价双键中有一个σ键,另一个是π键;
共价三键由一个σ键和两个π键组成。③、由原子轨道相互重叠形成的σ键和π键总称价键轨道。②、π键:由两个原子的p电子“肩并肩”重叠形成。特点:
特点:肩并肩、两块组成、镜像对称、容易断裂。1、共价键的形成σ键:类型:s—sσ、s—pσ、p—pσ等。
π键:
极性键
非极性键单键双键叁键2、共价键的分类电子云的重叠方向共用电子对的偏移共用电子对的数目1、下列说法正确的是( )
A、含有共价键的化合物一定是共价化合物
B、分子中只有共价键的化合物一定是共价化合物
C、由共价键形成的分子一定是共价化合物
D、只有非金属原子间才能形成共价键
2、氮分子中的化学键是( ) A、3个σ键 B、1个σ键,2个π键 C、3个π键 D、2个σ键,1个π键
3、下列说法中正确的是( )
A、p轨道之间以“肩并肩”重叠可形成σ键
B、p轨道之间以“头对头”重叠可形成π键
C、s和p轨道以“头对头”重叠可形成σ键
D、共价键是两个原子轨道以“头对头”重叠形成的 B B练习C4.在氯化氢分子中,形成共价键的原子轨道是 A、 氯原子的2p轨道和氢原子的1s轨道
B、 氯原子的2p轨道和氢原子的2p轨道
C、氯原子的3p轨道和氢原子的1s轨道
D、氯原子的3p轨道和氢原子的3p轨道C 73学与问 你能用电子式表示H2、HCl、Cl2
分子的形成过程吗? 为什么不可能有H3、H2Cl、Cl3
分子的形成?一、共价键(1)共价键具有饱和性按照共价键的共用电子对理论,一个原子有几个未成对电子,便可和几个自旋相反的电子配对成键,这就是共价键的“饱和性”。
H 原子、Cl原子都只有一个未成对电子,因而只能形成H2、HCl、Cl2分子,不能形成H3、H2Cl、Cl3分子3、共价键的特征spyσ (S-py )例如:H2O中共价键的形成一、共价键(2)共价键具有方向性当两个原子自旋相反的单电子配对形成共价键时,原子轨道重叠,原子轨道重叠愈多,核间电子云愈密集,共价键愈牢固,称为原子轨道最大重叠原理。因此原子轨道将沿最大程度方向重叠,决定了共价键的方向性。3、共价键的特征1、键能:
气态基态原子形成l mol化学键释放的最低能量。通常取正值。
单位:kJ/mol
如,形成l mol H—H键释放的最低能量为436.0 kJ,则 H—H键能为436.0 kJ/mol
形成1 molN三N键释放的最低能量为946 kJ
则 N三N键能为946 kJ/mol二、键参数—键能、键长、键角某些共价键的键能[观察分析]键能大小与化学键稳定性的关系?键能越大,化学键越稳定某些共价键键长形成共价键的两个原子之间的核间距1pm=10-12 m[观察分析]键长与键能的关系?键长越短,键能越大,共价键越稳定。2、键长:共价半径:相同原子的共价键键长的一半称为共价半径。1、试利用表2—l的数据进行计算,1 mo1 H2分别跟l molCl2、lmolBr2(蒸气)反应,分别形成2 mo1HCl分子和2molHBr分子,哪一个反应释放的能量更多?如何用计算的结果说明氯化氢分子和溴化氢分子哪个更容易发生热分解生成相应的单质?
2.N2、02、F2跟H2的反应能力依次增强,从键能的角度应如何理解这一化学事实?
3.通过上述例子,你认为键长、键能对分子的化学性质有什么影响?
思考与交流1、形成2 mo1HCl释放能量:2×431.8 kJ -(436.0kJ+242.7kJ)= 184.9 kJ
形成2 mo1HBr释放能量:2×366kJ -(436.0kJ+193.7kJ)= 102.97kJ
HCl释放能量比HBr释放能量多,因而生成的HCl更稳定,即HBr更容易发生热分解生成相应的单质.
2、键能大小是:F-H>O-H>N-H
3、键长越长,键能越小,键越易断裂,化学性质越活泼。
汇报两个共价键之间的夹角称为键角。 分子的形状有共价键之间的夹角决定。如:三原子分子H2S的H—S—H键角为105°,是一种 V形分子。据此完成下表:共价键具有方向性,所以多原子分子的共价键之间有一定的夹角。3、键角:键的稳定性------键能,键长分子的空间构型------键长,键角二、键参数—键能、键长、键角 CO分子和N2分子的某些性质
三、等电子原理:原子总数相同、价电子总数相同的分子具有相似的化学键特征,它们的许多性质是相近的。 科学视野: 用质谱仪测定分子结构
现代化学常利用质谱仪测定分子的结构。它的基本原理是在质谱仪中使分子失去电子变成带正电荷的分子离子和碎片离子等粒子。由于生成的分子离子、碎片离子具有不同的相对质量,它们在高压电场加速后,通过狭缝进入磁场分析器得到分离,在记录仪上呈现一系列峰,化学家对这些峰进行系统分析,便可得知样品分子的结构。例如,图2—7的纵坐标是相对丰度(与粒子的浓度成正比),横坐标是粒子的质量与电荷之比(m/e),简称质荷比。化学家通过分析得知,m/e=92的峰是甲苯分子的正离子(C6H5CH3+),m/e=91的峰是丢失一个氢原子的的C6H5CH2+ ,m/e=65的峰是分子碎片……因此,化学家便可推测被测物是甲苯。质谱仪测定分子结构 例题:
2002年诺贝尔化学奖表彰的是在“看清”生物大分子真面目方面的科技成果,一项是美国科学家约翰·芬恩与日本科学家田中耕一“发明了对生物大分子的质谱分析法”;另一项是瑞士科学家库尔特·维特里希“发明了利用核磁共振技术测定溶液中生物大分子三维结构的方法”。质子核磁共振(PMR)是研究有机物结构的有力手段之一,在所有研究的化合物分子中,每一结构中的等性氢原子在PMR中都给出了相应的峰(信号),谱中峰的强度与结构中的等性H原子个成正比。例如乙醛的结构简式为CH3—CHO,在PMR中有两个信号,其强度之比为3:1。
(1)结构式为 的有机物,在PMR谱上
观察峰给出的强度之比为 ;
(2)某含氧有机物,它的相对分子质量为46.0,碳的质量分数为52.2%,氢的质量分数为13.0%,PMR中只有一个信号,请写出其结构简式 (3)实践中可根据PMR谱上观察到氢原子给出的峰值情况,确定有机物的结构。如分子式为C3H6O2的链状有机物,有PMR谱上峰给出的稳定强度仅有四种,其对应的全部结构,它们分别为:①3∶3 ②3∶2∶1 ③3∶1∶1∶1 ④2∶2∶1∶1,请分别推断出结构简式:① ② ③ ④ 。(1)2:2:2:2:2或者1:1:1:1:1
(2)CH3OCH3
(3)①CH3COOCH3 ②CH3CH2COOH ③CH3CH(OH)CHO ④HOCH2CH2CHO
两个原子自旋相反的单电子配对,原子轨道重叠,核间电子云密集,系统能量降低,形成稳定的共价键。
原子中单电子才能配对。所以每个原子形成共价键的数目等于单电子数目。这就是共价键的饱和性。
原子轨道重叠愈多,核间电子云愈密集,共价键愈牢固,称为原子轨道最大重叠原理。因此原子轨道将沿最大程度方向重叠,决定了共价键的方向性。共价键理论
分子结构与性质化学键:物质中相邻原子之间强烈的相互作用。
离子键:阴、阳离子之间通过静电作用形成的化学键。
共价键:原子间通过共用电子对形成的化学键。 物质中相邻原子之间是靠什么作用而结合在一起?极性键A-B
非极性键A-A2、共价键的分类共用电子对的偏移1、共价键的定义原子间通过共用电子对形成的化学键共用电子对无偏向(电荷分布均匀)共用电子对有偏向(电荷分布不均匀)练习:指出下列微粒中的共价键类型1、O2
2 、HCl
3 、CO2
4、 H2O2
5 、Cl2
6 、N2非极性键极性键极性键(H-O-O-H)极性键 非极性键非极性键非极性键2、共用电子对是否有偏向或偏离是由什么因素引起的呢? 这是由于原子对共用电子对的吸引力不同 造成的。即键合原子的电负性不同造成的。
共用电子对即键合电子偏向电负性强的。1、共价键的极性的判断依据是什么?共用电子对是否有偏向或偏离思 考共用电子对有偏向(电荷分布不均匀)共用电子对无偏向(电荷分布均匀)非极性键A-A极性键A-B钠和氯通过得失电子同样也是形成电子对,那么这对电子是共价键还是离子键呢?你能从原子的电负性差别来理解吗?讨论后请填写表2-2:0.9 3.02.1 3.02.5 3.52.10.91.0离子共价 >1.7 <1.7结论: 成键原子间电负性差值 >1.7 离子键 成键原子间电负性差值 <1.7共价键=0非极性键>0极性键极性键
非极性键单键双键叁键2、共价键的分类共用电子对的偏移共用电子对的数目1、共价键的定义原子间通过共用电子对形成的化学键复习回忆第一节
共价键第二章 分子结构与性质电子云在两个原子核间重叠,意味着电子出现在核间的概率增大,电子带负电,因而可以形象的说,核间电子好比在核间架起一座带负电的桥梁,把带正电的两个原子核“黏结”在一起了。1、共价键的形成实质:电子云重叠。新课(a). s-s σ键的形成(1). σ键的形成(b). s-p σ键的形成(c)、p-p σ键的形成σ键:“头碰头”轴对称形成σ键的电子称为σ电子。(2).π键的形成XZZpZ—pZ镜像对称形成π键的电子称为π电子。 π键:“肩并肩” 由原子轨道相互重叠形成的σ键和π键总称价键轨道科学探究1、已知氮分子的共价键是三键,你能模仿图2-1、图2-2、图2-3,通过画图来描述吗?(提示:氮原子各自 用三个p轨道分别跟另一个氮原子形成一个σ键和两个π键。2.乙烷、乙烯和乙炔分子中的共价键分别有几个σ键和几个π键组成?共价单键是σ键;
共价双键中有一个σ键,另一个是π键;
共价三键中有一个σ键和两个π键。 乙烷分子中由7个σ键组成;
乙烯分子中由5个σ键和1个π键组成;
乙炔分子中由3个σ键和2个π键组成。小 结沿轴方向“头碰头”平行方向“肩并肩”轴对称镜像对称重叠大,较难断裂重叠小,较易断裂共价单键是σ键,
共价双键中一个是 σ键,另一个是π键,共价三键中一个是σ键,另两个为π键。①、σ键:以形成化学键的两原子核的连线为轴作旋转操作,共价键电子云的图形不变,这种特征称为轴对称。如H-H键。类型:s—sσ、s—pσ、p—pσ等。实质:电子云重叠。④、判断共价键类型规律:
共价单键是σ键;
共价双键中有一个σ键,另一个是π键;
共价三键由一个σ键和两个π键组成。③、由原子轨道相互重叠形成的σ键和π键总称价键轨道。②、π键:由两个原子的p电子“肩并肩”重叠形成。特点:
特点:肩并肩、两块组成、镜像对称、容易断裂。1、共价键的形成σ键:类型:s—sσ、s—pσ、p—pσ等。
π键:
极性键
非极性键单键双键叁键2、共价键的分类电子云的重叠方向共用电子对的偏移共用电子对的数目1、下列说法正确的是( )
A、含有共价键的化合物一定是共价化合物
B、分子中只有共价键的化合物一定是共价化合物
C、由共价键形成的分子一定是共价化合物
D、只有非金属原子间才能形成共价键
2、氮分子中的化学键是( ) A、3个σ键 B、1个σ键,2个π键 C、3个π键 D、2个σ键,1个π键
3、下列说法中正确的是( )
A、p轨道之间以“肩并肩”重叠可形成σ键
B、p轨道之间以“头对头”重叠可形成π键
C、s和p轨道以“头对头”重叠可形成σ键
D、共价键是两个原子轨道以“头对头”重叠形成的 B B练习C4.在氯化氢分子中,形成共价键的原子轨道是 A、 氯原子的2p轨道和氢原子的1s轨道
B、 氯原子的2p轨道和氢原子的2p轨道
C、氯原子的3p轨道和氢原子的1s轨道
D、氯原子的3p轨道和氢原子的3p轨道C 73学与问 你能用电子式表示H2、HCl、Cl2
分子的形成过程吗? 为什么不可能有H3、H2Cl、Cl3
分子的形成?一、共价键(1)共价键具有饱和性按照共价键的共用电子对理论,一个原子有几个未成对电子,便可和几个自旋相反的电子配对成键,这就是共价键的“饱和性”。
H 原子、Cl原子都只有一个未成对电子,因而只能形成H2、HCl、Cl2分子,不能形成H3、H2Cl、Cl3分子3、共价键的特征spyσ (S-py )例如:H2O中共价键的形成一、共价键(2)共价键具有方向性当两个原子自旋相反的单电子配对形成共价键时,原子轨道重叠,原子轨道重叠愈多,核间电子云愈密集,共价键愈牢固,称为原子轨道最大重叠原理。因此原子轨道将沿最大程度方向重叠,决定了共价键的方向性。3、共价键的特征1、键能:
气态基态原子形成l mol化学键释放的最低能量。通常取正值。
单位:kJ/mol
如,形成l mol H—H键释放的最低能量为436.0 kJ,则 H—H键能为436.0 kJ/mol
形成1 molN三N键释放的最低能量为946 kJ
则 N三N键能为946 kJ/mol二、键参数—键能、键长、键角某些共价键的键能[观察分析]键能大小与化学键稳定性的关系?键能越大,化学键越稳定某些共价键键长形成共价键的两个原子之间的核间距1pm=10-12 m[观察分析]键长与键能的关系?键长越短,键能越大,共价键越稳定。2、键长:共价半径:相同原子的共价键键长的一半称为共价半径。1、试利用表2—l的数据进行计算,1 mo1 H2分别跟l molCl2、lmolBr2(蒸气)反应,分别形成2 mo1HCl分子和2molHBr分子,哪一个反应释放的能量更多?如何用计算的结果说明氯化氢分子和溴化氢分子哪个更容易发生热分解生成相应的单质?
2.N2、02、F2跟H2的反应能力依次增强,从键能的角度应如何理解这一化学事实?
3.通过上述例子,你认为键长、键能对分子的化学性质有什么影响?
思考与交流1、形成2 mo1HCl释放能量:2×431.8 kJ -(436.0kJ+242.7kJ)= 184.9 kJ
形成2 mo1HBr释放能量:2×366kJ -(436.0kJ+193.7kJ)= 102.97kJ
HCl释放能量比HBr释放能量多,因而生成的HCl更稳定,即HBr更容易发生热分解生成相应的单质.
2、键能大小是:F-H>O-H>N-H
3、键长越长,键能越小,键越易断裂,化学性质越活泼。
汇报两个共价键之间的夹角称为键角。 分子的形状有共价键之间的夹角决定。如:三原子分子H2S的H—S—H键角为105°,是一种 V形分子。据此完成下表:共价键具有方向性,所以多原子分子的共价键之间有一定的夹角。3、键角:键的稳定性------键能,键长分子的空间构型------键长,键角二、键参数—键能、键长、键角 CO分子和N2分子的某些性质
三、等电子原理:原子总数相同、价电子总数相同的分子具有相似的化学键特征,它们的许多性质是相近的。 科学视野: 用质谱仪测定分子结构
现代化学常利用质谱仪测定分子的结构。它的基本原理是在质谱仪中使分子失去电子变成带正电荷的分子离子和碎片离子等粒子。由于生成的分子离子、碎片离子具有不同的相对质量,它们在高压电场加速后,通过狭缝进入磁场分析器得到分离,在记录仪上呈现一系列峰,化学家对这些峰进行系统分析,便可得知样品分子的结构。例如,图2—7的纵坐标是相对丰度(与粒子的浓度成正比),横坐标是粒子的质量与电荷之比(m/e),简称质荷比。化学家通过分析得知,m/e=92的峰是甲苯分子的正离子(C6H5CH3+),m/e=91的峰是丢失一个氢原子的的C6H5CH2+ ,m/e=65的峰是分子碎片……因此,化学家便可推测被测物是甲苯。质谱仪测定分子结构 例题:
2002年诺贝尔化学奖表彰的是在“看清”生物大分子真面目方面的科技成果,一项是美国科学家约翰·芬恩与日本科学家田中耕一“发明了对生物大分子的质谱分析法”;另一项是瑞士科学家库尔特·维特里希“发明了利用核磁共振技术测定溶液中生物大分子三维结构的方法”。质子核磁共振(PMR)是研究有机物结构的有力手段之一,在所有研究的化合物分子中,每一结构中的等性氢原子在PMR中都给出了相应的峰(信号),谱中峰的强度与结构中的等性H原子个成正比。例如乙醛的结构简式为CH3—CHO,在PMR中有两个信号,其强度之比为3:1。
(1)结构式为 的有机物,在PMR谱上
观察峰给出的强度之比为 ;
(2)某含氧有机物,它的相对分子质量为46.0,碳的质量分数为52.2%,氢的质量分数为13.0%,PMR中只有一个信号,请写出其结构简式 (3)实践中可根据PMR谱上观察到氢原子给出的峰值情况,确定有机物的结构。如分子式为C3H6O2的链状有机物,有PMR谱上峰给出的稳定强度仅有四种,其对应的全部结构,它们分别为:①3∶3 ②3∶2∶1 ③3∶1∶1∶1 ④2∶2∶1∶1,请分别推断出结构简式:① ② ③ ④ 。(1)2:2:2:2:2或者1:1:1:1:1
(2)CH3OCH3
(3)①CH3COOCH3 ②CH3CH2COOH ③CH3CH(OH)CHO ④HOCH2CH2CHO
两个原子自旋相反的单电子配对,原子轨道重叠,核间电子云密集,系统能量降低,形成稳定的共价键。
原子中单电子才能配对。所以每个原子形成共价键的数目等于单电子数目。这就是共价键的饱和性。
原子轨道重叠愈多,核间电子云愈密集,共价键愈牢固,称为原子轨道最大重叠原理。因此原子轨道将沿最大程度方向重叠,决定了共价键的方向性。共价键理论
