人教版高中化学选修三2.3.1 键的极性和分子的极性 课件(81张)
文档属性
| 名称 | 人教版高中化学选修三2.3.1 键的极性和分子的极性 课件(81张) |  | |
| 格式 | zip | ||
| 文件大小 | 2.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-11-17 20:38:00 | ||
图片预览








文档简介
课件81张PPT。第三节 分子的性质(第一课时)各类分子形形色色分子世界如此形形色色,异彩纷呈,美不胜收,常使人流连忘返。
那么分子空间结构又是怎么测定的呢各种理论的解释:
价层电子对互斥理论
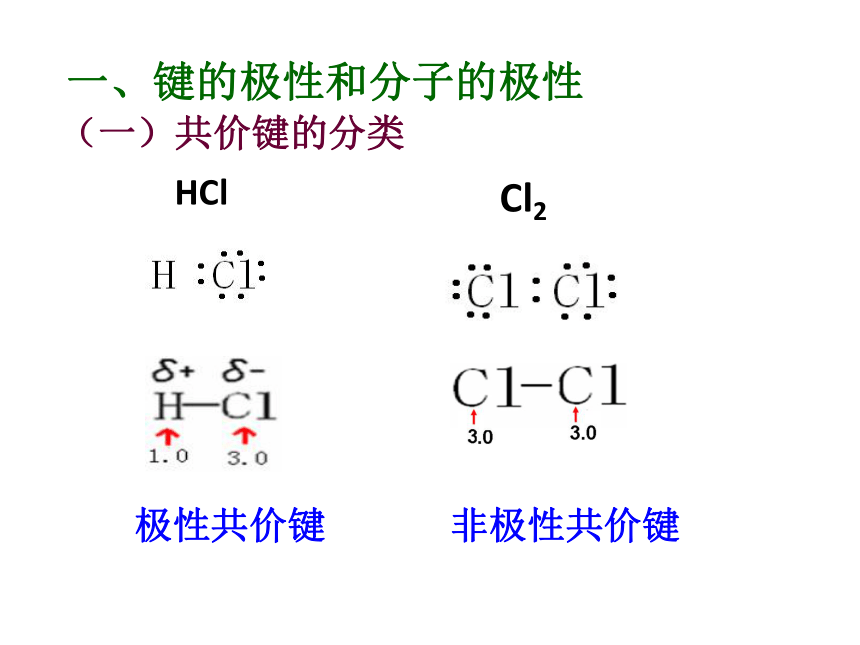
杂化轨道理论等 结构 性质第三节 分子的性质(第一课时)极性共价键 非极性共价键一、键的极性和分子的极性(一)共价键的分类HClCl22、共用电子对是否有偏向或偏离是由什么因素引起的呢? 这是由于原子对共用电子对的吸引力不同造成的。即键合原子的电负性不同造成的。1、键的极性的判断依据是什么?共用电子对是否有偏向或偏离思 考共用电子对有偏向
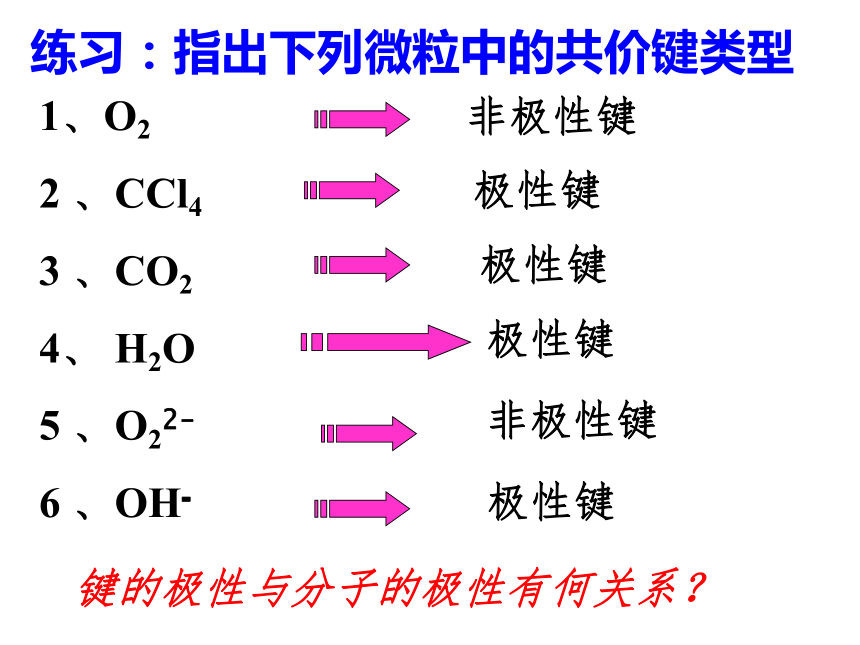
(电荷分布不均匀)共用电子对无偏向(电荷分布均匀)A-A非极性键A-B极键3、判断方法:(1)同种非金属元素的原子间形成的共价键是非极性键A--A。(2)不同种非金属元素的原子间形成的共价键是极性键A--B。练习:指出下列微粒中的共价键类型1、O2
2 、CCl4
3 、CO2
4、 H2O
5 、O22-
6 、OH-非极性键极性键极性键极性键非极性键极性键键的极性与分子的极性有何关系?1用滴管放下一股水流,用塑料笔在毛皮上摩擦后接近水滴并移动塑料笔,你观察到什么?为什么?
2.换用 CCl4,观察现象。原因:
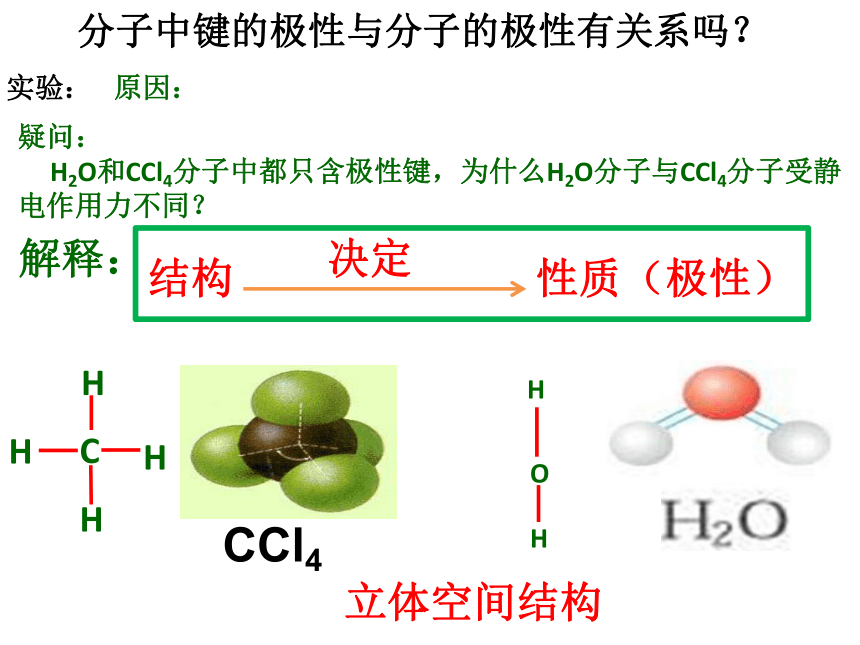
说明H2O分子与CCl4分子不同, H2O分子受静电作用(极性分子), CCl4分子不受静电作用(非极性分子)。实验:分子中键的极性与分子的极性有关系吗?原因: 实验:分子中键的极性与分子的极性有关系吗?解释:
结构 性质(极性)疑问:
H2O和CCl4分子中都只含极性键,为什么H2O分子与CCl4分子受静电作用力不同?立体空间结构 极性分子: 正电荷中心和负电荷中心不重合的分子非极性分子:正电荷中心和负电荷中心重合的分子看正电荷中心和负电荷中心是否重合 (2)再看分子的空间构型确定正负电荷中心(1)看键的极性确定正负电荷 2、判断方法:1、概念(二)分子的极性与分子立体空间结构有密切联系 方法一:109o28' 正四面体型 ,对称结构,C-Cl键的极性互相抵消( F合=0),正负电荷中心重合 ,是非极性分子CCl4105oF合≠0O-H键是极性键,共用电子对偏O原子,由于分子是V形构型,∴整个分子电荷中心不重合,是极性分子H2OC=O键是极性键,但从分子总体而言CO2是直线型分子,两个C=O键是对称排列的,两键的极性互相抵消( F合=0),∴整个分子电荷分布均匀,没有极性,是非极性分子180oF1F2F合=0如CO2BF3120oF1F2F3F’平面正三角形,对称,键的极性互相抵消( F合=0) ,是非极性分子109o28' 正四面体型 ,对称结构,C-H键的极性互相抵消( F合=0) ,是非极性分子CH4NH3107o三角锥型, 不对称,键的极性不能抵消,是极性分子105oF1F2F合≠0O-H键是极性键,共用电子对偏O原子,由于分子是V形构型,两个O-H键的极性不能抵消( F合≠0),∴整个分子电荷分布不均匀,是极性分子H2O ABn分子的判断
法一:A-B键看作AB原子间的相互作用力,根据中心原子A所受合力是否为零来判断,F合=0,为非极性分子(极性抵消), F合≠0,为极性分子(极性不抵消)109o28' 正四面体型 ,对称结构,C-Cl键的极性互相抵消( F合=0),正负电荷中心重合 ,是非极性分子CCl4105oF合≠0O-H键是极性键,共用电子对偏O原子,由于分子是V形构型,∴整个分子电荷中心不重合,是极性分子H2OC=O键是极性键,但从分子总体而言CO2是直线型分子,两个C=O键是对称排列的,两键的极性互相抵消( F合=0),∴整个分子电荷分布均匀,没有极性,是非极性分子180oF1F2F合=0如CO2BF3120oF1F2F3F’平面正三角形,对称,键的极性互相抵消( F合=0) ,是非极性分子109o28' 正四面体型 ,对称结构,C-H键的极性互相抵消( F合=0) ,是非极性分子CH4NH3107o三角锥型, 不对称,键的极性不能抵消,是极性分子ABn多原子分子CCl4
CH4
BF3
CO2非极性分子极性分子H2O
NH3中心原子无孤对电子中心原子有孤对电子ABn分子中心原子无孤对电子非极性分子,中心原子有孤对电子为极性分子 当中心原子的化合价的绝对值等于该元素的价电子数时(中心原子A无孤对电子)为非极性分子,反之为极性分子C=O键是极性键,但从分子总体而言CO2是直线型分子,两个C=O键是对称排列的,两键的极性互相抵消( F合=0),∴整个分子电荷分布均匀,没有极性,是非极性分子180oF1F2F合=0如CO2BF3120oF1F2F3F’平面正三角形,对称,键的极性互相抵消( F合=0) ,是非极性分子109o28' 正四面体型 ,对称结构,C-H键的极性互相抵消( F合=0) ,是非极性分子CH4NH3107o三角锥型, 不对称,键的极性不能抵消,是极性分子 ABn分子的判断
法一:A-B键看作AB原子间的相互作用力,根据中心原子A所受合力是否为零来判断,F合=0,为非极性分子(极性抵消), F合≠0,为极性分子(极性不抵消) 法二:当中心原子的化合价的绝对值等于该元素的价电子数时(中心原子A无孤对电子)为非极性分子,反之为极性分子全部由非极性键组成的分子是非极性分子。如:P4、C60、S8 C70、B12
A-A形分子非极性分子,A-B形分子极性分子练习CCl4、CH4、BF3、CO2非极性分子:极性分子:H2O、NH3[练习]判断下列分子是极性分子还是非极性分子:PCl3、CCl4、CS2、SO2 、H2O、PCl5、SO3、CO2、NH3、CH4、NO2非极性分子:CCl4、CS2、PCl5、SO3、CO2、 CH4只含极性键的多原子分子有的是极性分子,有的是非极性分子。?多原子分子(ABn),当中心原子的化合价的绝对值等于该元素的价电子数时,中心原子无孤对电子,该分子一般为非极性分子;否则为极性分子。[练习]判断下列分子是极性分子还是非极性分子:PCl3、CCl4、CS2、SO2 .H2O、PCl5、SO3、CO2非极性分子:+4+4+3+4-2+5+6+4CCl4、CS2、PCl5、SO3、CO2、 CH4NH3、CH4、NO2-3-4+4常见分子的构型及分子的极性无 无 直线型 非极性有 无 直线型 极性有 105o V型 极性有 180o 直线型 非极性有 107 三角锥型 极性有 120o 平面三角形 非极性有 109o28 ' 正四面体型 非极性分子的极性分子的空间结构键角键的极性成键原子电负性差别第三节 分子的性质(第二课时)思考水分子中氢氧原子之间存在相互作用,那么水分子之间呢?
为什么水较容易气化(100℃)而水却很难分解( 1000℃也仅有极少量分解 )?
Cl2、Br2、I2单质都是由分子组成的物质,而它们的物态却是不相同的,这说明什么?二、范德华力及其对物质性质的影响1. 定义:把分子聚集在一起的作用力称范德华力。请分析下表中数据2. 特点:范德华力 ,约比化学键能 。 很弱小1-2数量级?
?
3. 影响范德华力大小的因素(1)结构 的分子,相对分子质量越 ,范德华力越 ,熔、沸点越 。?
?
相似大大请分析下表中数据高四卤化碳的熔沸点与相对分子质量的关系(2)相对分子质量 或 时,分子的极性越 ,范德华力越 ,熔、沸点越 。 相同相近大大请分析下表中数据高4. 分子间的范德华力有以下几个特征: (1)作用力的范围很小(气态时可忽略)
(2)很弱,约比化学键能小1~2个数量级,
大约只有几到几十 KJ·mol-1。
(3)影响物质的物理性质,如熔沸点等。
(4)相对分子质量越大,范德华力越大;分子 的极性越大,范德华力越大(1)将干冰气化,破坏了CO2分子晶
体的 。(2)将CO2气体溶于水,破坏了CO2
分子 。范德华力共价键思考:(3)解释CCl4(液体)CH4及CF4是气体,
CI4是固体的原因。 它们均是正四面体结构,它们分子间范德华力随相对分子质量增大而增大,相对分子质量越大,范德华力越大。 范德华力大小: CI4> CCl4 >CF4 >CH4四卤化碳的熔沸点与相对分子质量的关系 非金属元素的氢化物在固态时是分子晶体,其熔沸点与其分子量有关.对于同一主族非金属元素而言,从上到下,分子量逐渐增大,熔沸点应逐渐升高.而HF、H2O、NH3却出现反常,为什么? 说明在HF、H2O、NH3分子间还存在除范德华力之外的其他作用.这种作用就是氢键.三、氢键及其对物质性质的影响1. 氢键概念:氢键是一种特殊的分子间作用力,它是由已经与电负性很强的原子形成共 价键的氢原子与另一分子中电负性很强的原子之间的作用力.例如: 在HF中 F 的电负性相当大, 电子对强烈地偏向 F, 而 H 几乎成了质子(H+), 这种 H 与另一个HF分子中电负性相当大、半径小的F相互接近时, 产生一种特殊的分子间力 —— 氢键. 不属于化学键
(2)一般表示为: X—H----Y(其中X、Y为F、O、N)
表示式中的实线表示共价键,虚线表示氢键。
(3)形成的两个条件:
①与电负性大且半径小的原子(F, O, N)相连的 H ;
② 在附近有电负性大, 半径小的原子(F, O, N). 甲醇2. 氢键的存在(1)分子间氢键 氢键普遍存在于已经与N、O、F形成共价键的氢原子与另外的N、O、F原子之间。如:HF、H2O、NH3 相互之间C2H5OH、CH3COOH、H2O相互之间 (2)分子内氢键
某些物质在分子内也可形成氢键,例如当苯酚在邻位上有—CHO、—COOH、—OH和—NO2时,可形成分子内的氢键,组成“螯合环”的特殊结构. (2)分子内氢键: 例如 (1)分子间氢键:3. 氢键键能大小范围 氢键介于范德华力和化学键之间,是一种较弱的作用力。 X—H----Y
氢键强弱与X和Y的吸引电子的能力有关,即与X和Y的电负性有关.
X—H----Y它们的吸引电子能力越强(即电负性越大),则氢键越强,
如F原子得电子能力最强,因而F-H…F是最强的氢键; 原子吸引电子能力不同,所以氢键强弱变化顺序为:
F-H…F > O-H…O > O-H…N > N-H…N
C原子吸引电子能力较弱,一般不形成氢键。4. 氢键强弱(1)分子间氢键使物质熔沸点升高
(2)分子内氢键使物质熔沸点降低
(3)物质的溶解性增大5. 氢键对物质物理性质的影响:思考:NH3为什么极易溶于水?NH3溶于水是形成
N-H…O还是形成O-H…N?NH3溶于水形成氢键示意图如右,正是这样,NH3溶于水溶液呈碱性X √ 我们在学习化学的过程中还有什么地方能用氢键的知识来解释的?(1)醇比含有相同碳原子的烃熔沸点高
(2)低级醇易溶于水
(3)HF酸是弱酸6. 氢键的应用 ……讨论水的特殊性:
(1)水的熔沸点比较高?
(2)为什么水结冰后体积膨胀?
(3)为什么水在4℃时密度最大?液态水中的氢键 在水蒸气中水以单个的H2O分子形式存在;在液态水中,经常是几个水分子通过氢键结合起来,形成(H2O)n(如上图);在固态水(冰)中,水分子大范围地以氢键互相联结,形成相当疏松的晶体,从而在结构中有许多空隙,造成体积膨胀,密度减小,因此冰能浮在水面上. 随温度升高,同时发生两种相反的过程:一是冰晶结构小集体受热不断崩溃,缔合分子减少;另一是水分子间距因热运动不断增大.0~4℃间,前者占优势, 4℃以上,后者占优势, 4℃时,两者互不相让,导致水的密度最大.分子间作用力分子间普遍存在的范德华力
特殊分子间或分子内存在的氢键 (04广东)下列关于氢键的说法中正确的是( )
A. 每个水分子内含有两个氢键
B. 在所有的水蒸气、水、冰中都含有氢键
C. 分子间能形成氢键,使物质的熔沸点升高
D. HF稳定性很强,是因为其分子间能形成氢键 练习:C第三节 分子的性质(第三课时) HCl和NH3易溶于水,难溶于四氯化碳;而苯和碘却易溶于四氯化碳,难溶于水。 现象: “相似相溶”的规律:非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂。
四、溶解性
1.影响物质溶解性的因素
⑴影响固体溶解度的主要因素是___________。
⑵影响气体溶解度的主要因素是_________和_________。
2.相似相溶规律:______________________________
_______________________________。
⑴如果存在氢键,则溶剂和溶质之间的氢键作用力越大,溶解性越_______。相反,无氢键相互作用的溶质在有氢键的水中的溶解度就比较_______。
⑵“相似相溶”还适用于分子结构的_________。
⑶如果溶质与水发生化学反应可_________其溶解度。 温度温度 压强非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂。好小相似性增大在碘水溶液中加入约1mL四氯化碳(CCl4),振荡试管,观察碘被四氯化碳萃取,形成紫红色的碘的四氯化碳溶液。再向试管里加入1mL浓碘化钾(KI)水溶液,振荡试管,溶液紫色变浅,这是由于在水溶液里可发生如下反应:I2+I—=I3—。实验表明碘在纯水还是在四氯化碳中溶解性较好?为什么?
实验:在一个小试管里放入一小粒碘晶体,加入约5mL蒸馏水,观察碘在水中的溶解性(若有不溶的碘,可将碘水溶液倾倒在另一个试管里继续下面的实验)。方法能力
分子的性质
1.比较NH3和CH4在水中的溶解度。怎样用相似相溶规律理解它们的溶解度不同?
2.为什么在日常生活中用有机溶剂(如乙酸乙酯)溶解油漆而不用水?
3.怎样理解汽油在水中的溶解度很小?
4.怎样理解低碳醇与水互溶,而高碳醇在水中的溶解度却很小?自学46:
科学视野—表面活性剂和细胞膜 1、什么是表面活性剂P46?亲水基团?疏水基团?肥皂和 洗涤剂的去污原理是什么?2、什么是单分子膜?双分子膜?举例说明。 3、为什么双分子膜以头向外而尾向内的方式排列? 思考:试一试:是否重合(α)右旋弹簧与左旋弹簧;(b)蜗牛壳;(c)左螺纹与右螺纹螺丝钉 物体与其镜像不能重合1. 手性:镜像对称,在三维空间里不能重叠。 具有完全相同的组成和原子排列的一对分子,如同左手与右手一样互为镜像,却在三维空间里不能重叠,互称手性异构体。2. 手性异构体3. 手性分子:有手性异构体的分子叫做手性分子。五. 手性4. 手性碳原子 当碳原子结合的四个原子或原子团各不相同时,该碳原子是手性碳原子。5. 判断分子是否手性的依据:
(1) 凡具有对称面、对称中心的分子,都是非手性分子。
(2)有无对称轴,对分子是否有手性无决定作用。一般:
※ 当分子中只有一个C* ,分子一定有手性。
※ 当分子中有多个手性中心时,要借助对称因素。无对称
面,又无对称中心的分子,必是手性分子。手性分子在生命科学和生产手性药物方面有广泛的应用。如图所示的分子,是由一家德国制药厂在1957年10月1日上市的高效镇静剂,中文药名为“反应停”,它能使失眠者美美地睡个好觉,能迅速止痛并能够减轻孕妇的妊娠反应。然而,不久就发现世界各地相继出现了一些畸形儿,后被科学家证实,是孕妇服用了这种药物导致的随后的药物化学研究证实,在这种药物中,只有图左边的分子才有这种毒副作用,而右边的分子却没有这种毒副作用。人类从这一药物史上的悲剧中吸取教训,不久各国纷纷规定,今后凡生产手性药物,必须把手性异构体分离开,只出售能治病的那种手性异构体的药物。
“反应停”事件 拓展体验1. 下列说法不正确的是( )
A. 互为手性异构的分子组成相同,官能
团不同
B. 手性异构体的性质不完全相同
C. 手性异构体是同分异构体的一种
D. 利用手性催化剂合成可得到或主要得
到一种手性分子
A2. 下列化合物中含有手性碳原子的是( )
A.CCl2F2 B.CH3—CH—COOH
C.CH3CH2OH D.CH3—OH
B 拓展体验
3. 下列两分子的关系是 ( )
A.互为同分异构体 B.是同一物质
C.是手性分子 D.互为同系物B科学史话:了解巴斯德实验室合成的有机物酒石酸盐并制得手性机物酒石酸盐过程。
多美的晶体啊!六. 无机含氧酸的酸性1.在同一周期中,处于最高价态的元素,其含氧酸的酸性随原子序数递增,自左至右增强。如:H3PO4 < H2SO4 < HClO4高氯酸是非金属含氧酸中酸性最强的无机酸(一)知识回顾与归纳:2.在同一主族中,处于相同价态的不同元素,其含氧酸的酸性随成酸元素的原子序数递增,自上而下减弱。如HClO>HBrO>HIOHClO2>HBrO2>HIO2HClO3>HBrO3>HIO3HClO4>HBrO4>HIO43.同一元素若能形成几种不同价态的含氧酸,其酸性依化合价的递增而递增;如:HClO< HClO2< HClO3 HClO Cl(OH) 0 3.2×10-8
HClO2 ClO(OH) 1 1.1×10-2
HClO3 ClO2(OH) 2 103
HClO4 ClO3(OH) 3 108学会归纳1. (HO)mROn,如果成酸元素 ,则n值越大,即酸性越 。强(二)无机含氧酸酸性规律 R相同(1)H2SO3和H2SO4(2)HNO2和HNO3(3) HClO、 HClO2、 HClO3 、HClO4H2SO3: (HO)2SO n=1 ; H2SO4 : (HO)2SO2 n=2 ∴H2SO4 ﹥ H2SO3HNO2: (HO)NO n=1 ; HNO3 : (HO)NO2 n=2 HClO: (HO) Cl n=0 ; HClO2: (HO) ClO n=1
HClO3 : (HO) ClO2 n=2 ; HClO4 : (HO) ClO3 n=3∴ HNO3 > HNO2∴ HClO4 > HClO3 > HClO2 > HClO例如再认识拓展2. (HO)mROn,如果成酸元素R不同时,则非羟基氧原子数n值越大,即酸性越强。练习:
1.已知含氧酸可用通式XOm(OH)n来表示,如X是S,则m=2,n=2,则这个式子就表示H2SO4。一般而言,该式中m大的是强酸,m小的是弱酸。下列各含氧酸中酸性最强的是( )
A.HClO4 B.H2SeO3
C.H3BO3 D.H3PO4
那么分子空间结构又是怎么测定的呢各种理论的解释:
价层电子对互斥理论
杂化轨道理论等 结构 性质第三节 分子的性质(第一课时)极性共价键 非极性共价键一、键的极性和分子的极性(一)共价键的分类HClCl22、共用电子对是否有偏向或偏离是由什么因素引起的呢? 这是由于原子对共用电子对的吸引力不同造成的。即键合原子的电负性不同造成的。1、键的极性的判断依据是什么?共用电子对是否有偏向或偏离思 考共用电子对有偏向
(电荷分布不均匀)共用电子对无偏向(电荷分布均匀)A-A非极性键A-B极键3、判断方法:(1)同种非金属元素的原子间形成的共价键是非极性键A--A。(2)不同种非金属元素的原子间形成的共价键是极性键A--B。练习:指出下列微粒中的共价键类型1、O2
2 、CCl4
3 、CO2
4、 H2O
5 、O22-
6 、OH-非极性键极性键极性键极性键非极性键极性键键的极性与分子的极性有何关系?1用滴管放下一股水流,用塑料笔在毛皮上摩擦后接近水滴并移动塑料笔,你观察到什么?为什么?
2.换用 CCl4,观察现象。原因:
说明H2O分子与CCl4分子不同, H2O分子受静电作用(极性分子), CCl4分子不受静电作用(非极性分子)。实验:分子中键的极性与分子的极性有关系吗?原因: 实验:分子中键的极性与分子的极性有关系吗?解释:
结构 性质(极性)疑问:
H2O和CCl4分子中都只含极性键,为什么H2O分子与CCl4分子受静电作用力不同?立体空间结构 极性分子: 正电荷中心和负电荷中心不重合的分子非极性分子:正电荷中心和负电荷中心重合的分子看正电荷中心和负电荷中心是否重合 (2)再看分子的空间构型确定正负电荷中心(1)看键的极性确定正负电荷 2、判断方法:1、概念(二)分子的极性与分子立体空间结构有密切联系 方法一:109o28' 正四面体型 ,对称结构,C-Cl键的极性互相抵消( F合=0),正负电荷中心重合 ,是非极性分子CCl4105oF合≠0O-H键是极性键,共用电子对偏O原子,由于分子是V形构型,∴整个分子电荷中心不重合,是极性分子H2OC=O键是极性键,但从分子总体而言CO2是直线型分子,两个C=O键是对称排列的,两键的极性互相抵消( F合=0),∴整个分子电荷分布均匀,没有极性,是非极性分子180oF1F2F合=0如CO2BF3120oF1F2F3F’平面正三角形,对称,键的极性互相抵消( F合=0) ,是非极性分子109o28' 正四面体型 ,对称结构,C-H键的极性互相抵消( F合=0) ,是非极性分子CH4NH3107o三角锥型, 不对称,键的极性不能抵消,是极性分子105oF1F2F合≠0O-H键是极性键,共用电子对偏O原子,由于分子是V形构型,两个O-H键的极性不能抵消( F合≠0),∴整个分子电荷分布不均匀,是极性分子H2O ABn分子的判断
法一:A-B键看作AB原子间的相互作用力,根据中心原子A所受合力是否为零来判断,F合=0,为非极性分子(极性抵消), F合≠0,为极性分子(极性不抵消)109o28' 正四面体型 ,对称结构,C-Cl键的极性互相抵消( F合=0),正负电荷中心重合 ,是非极性分子CCl4105oF合≠0O-H键是极性键,共用电子对偏O原子,由于分子是V形构型,∴整个分子电荷中心不重合,是极性分子H2OC=O键是极性键,但从分子总体而言CO2是直线型分子,两个C=O键是对称排列的,两键的极性互相抵消( F合=0),∴整个分子电荷分布均匀,没有极性,是非极性分子180oF1F2F合=0如CO2BF3120oF1F2F3F’平面正三角形,对称,键的极性互相抵消( F合=0) ,是非极性分子109o28' 正四面体型 ,对称结构,C-H键的极性互相抵消( F合=0) ,是非极性分子CH4NH3107o三角锥型, 不对称,键的极性不能抵消,是极性分子ABn多原子分子CCl4
CH4
BF3
CO2非极性分子极性分子H2O
NH3中心原子无孤对电子中心原子有孤对电子ABn分子中心原子无孤对电子非极性分子,中心原子有孤对电子为极性分子 当中心原子的化合价的绝对值等于该元素的价电子数时(中心原子A无孤对电子)为非极性分子,反之为极性分子C=O键是极性键,但从分子总体而言CO2是直线型分子,两个C=O键是对称排列的,两键的极性互相抵消( F合=0),∴整个分子电荷分布均匀,没有极性,是非极性分子180oF1F2F合=0如CO2BF3120oF1F2F3F’平面正三角形,对称,键的极性互相抵消( F合=0) ,是非极性分子109o28' 正四面体型 ,对称结构,C-H键的极性互相抵消( F合=0) ,是非极性分子CH4NH3107o三角锥型, 不对称,键的极性不能抵消,是极性分子 ABn分子的判断
法一:A-B键看作AB原子间的相互作用力,根据中心原子A所受合力是否为零来判断,F合=0,为非极性分子(极性抵消), F合≠0,为极性分子(极性不抵消) 法二:当中心原子的化合价的绝对值等于该元素的价电子数时(中心原子A无孤对电子)为非极性分子,反之为极性分子全部由非极性键组成的分子是非极性分子。如:P4、C60、S8 C70、B12
A-A形分子非极性分子,A-B形分子极性分子练习CCl4、CH4、BF3、CO2非极性分子:极性分子:H2O、NH3[练习]判断下列分子是极性分子还是非极性分子:PCl3、CCl4、CS2、SO2 、H2O、PCl5、SO3、CO2、NH3、CH4、NO2非极性分子:CCl4、CS2、PCl5、SO3、CO2、 CH4只含极性键的多原子分子有的是极性分子,有的是非极性分子。?多原子分子(ABn),当中心原子的化合价的绝对值等于该元素的价电子数时,中心原子无孤对电子,该分子一般为非极性分子;否则为极性分子。[练习]判断下列分子是极性分子还是非极性分子:PCl3、CCl4、CS2、SO2 .H2O、PCl5、SO3、CO2非极性分子:+4+4+3+4-2+5+6+4CCl4、CS2、PCl5、SO3、CO2、 CH4NH3、CH4、NO2-3-4+4常见分子的构型及分子的极性无 无 直线型 非极性有 无 直线型 极性有 105o V型 极性有 180o 直线型 非极性有 107 三角锥型 极性有 120o 平面三角形 非极性有 109o28 ' 正四面体型 非极性分子的极性分子的空间结构键角键的极性成键原子电负性差别第三节 分子的性质(第二课时)思考水分子中氢氧原子之间存在相互作用,那么水分子之间呢?
为什么水较容易气化(100℃)而水却很难分解( 1000℃也仅有极少量分解 )?
Cl2、Br2、I2单质都是由分子组成的物质,而它们的物态却是不相同的,这说明什么?二、范德华力及其对物质性质的影响1. 定义:把分子聚集在一起的作用力称范德华力。请分析下表中数据2. 特点:范德华力 ,约比化学键能 。 很弱小1-2数量级?
?
3. 影响范德华力大小的因素(1)结构 的分子,相对分子质量越 ,范德华力越 ,熔、沸点越 。?
?
相似大大请分析下表中数据高四卤化碳的熔沸点与相对分子质量的关系(2)相对分子质量 或 时,分子的极性越 ,范德华力越 ,熔、沸点越 。 相同相近大大请分析下表中数据高4. 分子间的范德华力有以下几个特征: (1)作用力的范围很小(气态时可忽略)
(2)很弱,约比化学键能小1~2个数量级,
大约只有几到几十 KJ·mol-1。
(3)影响物质的物理性质,如熔沸点等。
(4)相对分子质量越大,范德华力越大;分子 的极性越大,范德华力越大(1)将干冰气化,破坏了CO2分子晶
体的 。(2)将CO2气体溶于水,破坏了CO2
分子 。范德华力共价键思考:(3)解释CCl4(液体)CH4及CF4是气体,
CI4是固体的原因。 它们均是正四面体结构,它们分子间范德华力随相对分子质量增大而增大,相对分子质量越大,范德华力越大。 范德华力大小: CI4> CCl4 >CF4 >CH4四卤化碳的熔沸点与相对分子质量的关系 非金属元素的氢化物在固态时是分子晶体,其熔沸点与其分子量有关.对于同一主族非金属元素而言,从上到下,分子量逐渐增大,熔沸点应逐渐升高.而HF、H2O、NH3却出现反常,为什么? 说明在HF、H2O、NH3分子间还存在除范德华力之外的其他作用.这种作用就是氢键.三、氢键及其对物质性质的影响1. 氢键概念:氢键是一种特殊的分子间作用力,它是由已经与电负性很强的原子形成共 价键的氢原子与另一分子中电负性很强的原子之间的作用力.例如: 在HF中 F 的电负性相当大, 电子对强烈地偏向 F, 而 H 几乎成了质子(H+), 这种 H 与另一个HF分子中电负性相当大、半径小的F相互接近时, 产生一种特殊的分子间力 —— 氢键. 不属于化学键
(2)一般表示为: X—H----Y(其中X、Y为F、O、N)
表示式中的实线表示共价键,虚线表示氢键。
(3)形成的两个条件:
①与电负性大且半径小的原子(F, O, N)相连的 H ;
② 在附近有电负性大, 半径小的原子(F, O, N). 甲醇2. 氢键的存在(1)分子间氢键 氢键普遍存在于已经与N、O、F形成共价键的氢原子与另外的N、O、F原子之间。如:HF、H2O、NH3 相互之间C2H5OH、CH3COOH、H2O相互之间 (2)分子内氢键
某些物质在分子内也可形成氢键,例如当苯酚在邻位上有—CHO、—COOH、—OH和—NO2时,可形成分子内的氢键,组成“螯合环”的特殊结构. (2)分子内氢键: 例如 (1)分子间氢键:3. 氢键键能大小范围 氢键介于范德华力和化学键之间,是一种较弱的作用力。 X—H----Y
氢键强弱与X和Y的吸引电子的能力有关,即与X和Y的电负性有关.
X—H----Y它们的吸引电子能力越强(即电负性越大),则氢键越强,
如F原子得电子能力最强,因而F-H…F是最强的氢键; 原子吸引电子能力不同,所以氢键强弱变化顺序为:
F-H…F > O-H…O > O-H…N > N-H…N
C原子吸引电子能力较弱,一般不形成氢键。4. 氢键强弱(1)分子间氢键使物质熔沸点升高
(2)分子内氢键使物质熔沸点降低
(3)物质的溶解性增大5. 氢键对物质物理性质的影响:思考:NH3为什么极易溶于水?NH3溶于水是形成
N-H…O还是形成O-H…N?NH3溶于水形成氢键示意图如右,正是这样,NH3溶于水溶液呈碱性X √ 我们在学习化学的过程中还有什么地方能用氢键的知识来解释的?(1)醇比含有相同碳原子的烃熔沸点高
(2)低级醇易溶于水
(3)HF酸是弱酸6. 氢键的应用 ……讨论水的特殊性:
(1)水的熔沸点比较高?
(2)为什么水结冰后体积膨胀?
(3)为什么水在4℃时密度最大?液态水中的氢键 在水蒸气中水以单个的H2O分子形式存在;在液态水中,经常是几个水分子通过氢键结合起来,形成(H2O)n(如上图);在固态水(冰)中,水分子大范围地以氢键互相联结,形成相当疏松的晶体,从而在结构中有许多空隙,造成体积膨胀,密度减小,因此冰能浮在水面上. 随温度升高,同时发生两种相反的过程:一是冰晶结构小集体受热不断崩溃,缔合分子减少;另一是水分子间距因热运动不断增大.0~4℃间,前者占优势, 4℃以上,后者占优势, 4℃时,两者互不相让,导致水的密度最大.分子间作用力分子间普遍存在的范德华力
特殊分子间或分子内存在的氢键 (04广东)下列关于氢键的说法中正确的是( )
A. 每个水分子内含有两个氢键
B. 在所有的水蒸气、水、冰中都含有氢键
C. 分子间能形成氢键,使物质的熔沸点升高
D. HF稳定性很强,是因为其分子间能形成氢键 练习:C第三节 分子的性质(第三课时) HCl和NH3易溶于水,难溶于四氯化碳;而苯和碘却易溶于四氯化碳,难溶于水。 现象: “相似相溶”的规律:非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂。
四、溶解性
1.影响物质溶解性的因素
⑴影响固体溶解度的主要因素是___________。
⑵影响气体溶解度的主要因素是_________和_________。
2.相似相溶规律:______________________________
_______________________________。
⑴如果存在氢键,则溶剂和溶质之间的氢键作用力越大,溶解性越_______。相反,无氢键相互作用的溶质在有氢键的水中的溶解度就比较_______。
⑵“相似相溶”还适用于分子结构的_________。
⑶如果溶质与水发生化学反应可_________其溶解度。 温度温度 压强非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂。好小相似性增大在碘水溶液中加入约1mL四氯化碳(CCl4),振荡试管,观察碘被四氯化碳萃取,形成紫红色的碘的四氯化碳溶液。再向试管里加入1mL浓碘化钾(KI)水溶液,振荡试管,溶液紫色变浅,这是由于在水溶液里可发生如下反应:I2+I—=I3—。实验表明碘在纯水还是在四氯化碳中溶解性较好?为什么?
实验:在一个小试管里放入一小粒碘晶体,加入约5mL蒸馏水,观察碘在水中的溶解性(若有不溶的碘,可将碘水溶液倾倒在另一个试管里继续下面的实验)。方法能力
分子的性质
1.比较NH3和CH4在水中的溶解度。怎样用相似相溶规律理解它们的溶解度不同?
2.为什么在日常生活中用有机溶剂(如乙酸乙酯)溶解油漆而不用水?
3.怎样理解汽油在水中的溶解度很小?
4.怎样理解低碳醇与水互溶,而高碳醇在水中的溶解度却很小?自学46:
科学视野—表面活性剂和细胞膜 1、什么是表面活性剂P46?亲水基团?疏水基团?肥皂和 洗涤剂的去污原理是什么?2、什么是单分子膜?双分子膜?举例说明。 3、为什么双分子膜以头向外而尾向内的方式排列? 思考:试一试:是否重合(α)右旋弹簧与左旋弹簧;(b)蜗牛壳;(c)左螺纹与右螺纹螺丝钉 物体与其镜像不能重合1. 手性:镜像对称,在三维空间里不能重叠。 具有完全相同的组成和原子排列的一对分子,如同左手与右手一样互为镜像,却在三维空间里不能重叠,互称手性异构体。2. 手性异构体3. 手性分子:有手性异构体的分子叫做手性分子。五. 手性4. 手性碳原子 当碳原子结合的四个原子或原子团各不相同时,该碳原子是手性碳原子。5. 判断分子是否手性的依据:
(1) 凡具有对称面、对称中心的分子,都是非手性分子。
(2)有无对称轴,对分子是否有手性无决定作用。一般:
※ 当分子中只有一个C* ,分子一定有手性。
※ 当分子中有多个手性中心时,要借助对称因素。无对称
面,又无对称中心的分子,必是手性分子。手性分子在生命科学和生产手性药物方面有广泛的应用。如图所示的分子,是由一家德国制药厂在1957年10月1日上市的高效镇静剂,中文药名为“反应停”,它能使失眠者美美地睡个好觉,能迅速止痛并能够减轻孕妇的妊娠反应。然而,不久就发现世界各地相继出现了一些畸形儿,后被科学家证实,是孕妇服用了这种药物导致的随后的药物化学研究证实,在这种药物中,只有图左边的分子才有这种毒副作用,而右边的分子却没有这种毒副作用。人类从这一药物史上的悲剧中吸取教训,不久各国纷纷规定,今后凡生产手性药物,必须把手性异构体分离开,只出售能治病的那种手性异构体的药物。
“反应停”事件 拓展体验1. 下列说法不正确的是( )
A. 互为手性异构的分子组成相同,官能
团不同
B. 手性异构体的性质不完全相同
C. 手性异构体是同分异构体的一种
D. 利用手性催化剂合成可得到或主要得
到一种手性分子
A2. 下列化合物中含有手性碳原子的是( )
A.CCl2F2 B.CH3—CH—COOH
C.CH3CH2OH D.CH3—OH
B 拓展体验
3. 下列两分子的关系是 ( )
A.互为同分异构体 B.是同一物质
C.是手性分子 D.互为同系物B科学史话:了解巴斯德实验室合成的有机物酒石酸盐并制得手性机物酒石酸盐过程。
多美的晶体啊!六. 无机含氧酸的酸性1.在同一周期中,处于最高价态的元素,其含氧酸的酸性随原子序数递增,自左至右增强。如:H3PO4 < H2SO4 < HClO4高氯酸是非金属含氧酸中酸性最强的无机酸(一)知识回顾与归纳:2.在同一主族中,处于相同价态的不同元素,其含氧酸的酸性随成酸元素的原子序数递增,自上而下减弱。如HClO>HBrO>HIOHClO2>HBrO2>HIO2HClO3>HBrO3>HIO3HClO4>HBrO4>HIO43.同一元素若能形成几种不同价态的含氧酸,其酸性依化合价的递增而递增;如:HClO< HClO2< HClO3
HClO2 ClO(OH) 1 1.1×10-2
HClO3 ClO2(OH) 2 103
HClO4 ClO3(OH) 3 108学会归纳1. (HO)mROn,如果成酸元素 ,则n值越大,即酸性越 。强(二)无机含氧酸酸性规律 R相同(1)H2SO3和H2SO4(2)HNO2和HNO3(3) HClO、 HClO2、 HClO3 、HClO4H2SO3: (HO)2SO n=1 ; H2SO4 : (HO)2SO2 n=2 ∴H2SO4 ﹥ H2SO3HNO2: (HO)NO n=1 ; HNO3 : (HO)NO2 n=2 HClO: (HO) Cl n=0 ; HClO2: (HO) ClO n=1
HClO3 : (HO) ClO2 n=2 ; HClO4 : (HO) ClO3 n=3∴ HNO3 > HNO2∴ HClO4 > HClO3 > HClO2 > HClO例如再认识拓展2. (HO)mROn,如果成酸元素R不同时,则非羟基氧原子数n值越大,即酸性越强。练习:
1.已知含氧酸可用通式XOm(OH)n来表示,如X是S,则m=2,n=2,则这个式子就表示H2SO4。一般而言,该式中m大的是强酸,m小的是弱酸。下列各含氧酸中酸性最强的是( )
A.HClO4 B.H2SeO3
C.H3BO3 D.H3PO4
