人教版高中化学选修三3.4 离子晶体、晶体计算 课件(29张PPT)
文档属性
| 名称 | 人教版高中化学选修三3.4 离子晶体、晶体计算 课件(29张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-11-17 20:47:26 | ||
图片预览






文档简介
(共29张PPT)
晶体的分类及依据
分类依据
构成晶体的微粒(离子、原子、分子)
微粒间的作用力
化学键
分子间作用力
离子键
共价键
金属键
常见晶体类型:分子晶体、原子晶体、
金属晶体、离子晶体
作用力越强,晶体的熔沸
点越高,晶体的硬度越大。
第四节、离 子 晶 体
1.定义:
离子间通过离子键结合而成的晶体
微粒间的作用力:
构成微粒:
组成元素:
离子键
阴、阳离子
一般由金属元素和非金属元素组成
注
意
离子化合物在固态时都是离子晶体
2.离子晶体的结构
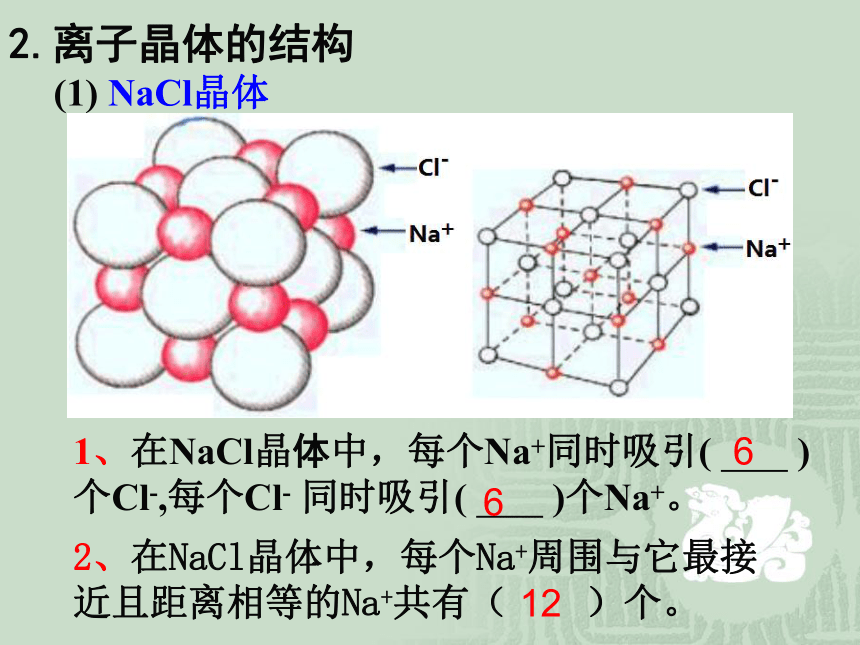
1、在NaCl晶体中,每个Na+同时吸引( )个Cl-,每个Cl- 同时吸引( )个Na+。
2、在NaCl晶体中,每个Na+周围与它最接近且距离相等的Na+共有( )个。
(1) NaCl晶体
6
6
12
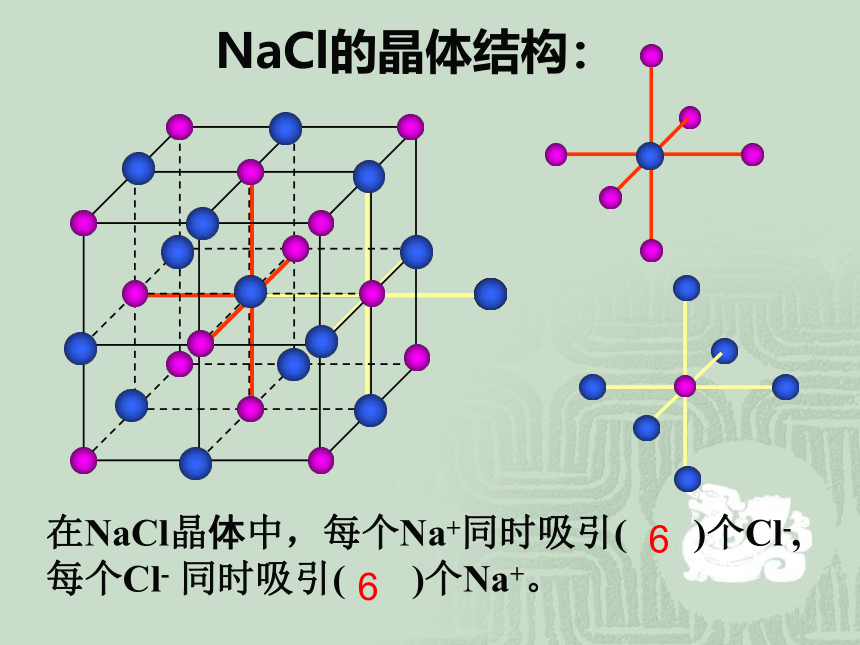
NaCl的晶体结构:
在NaCl晶体中,每个Na+同时吸引( )个Cl-,每个Cl- 同时吸引( )个Na+。
6
6
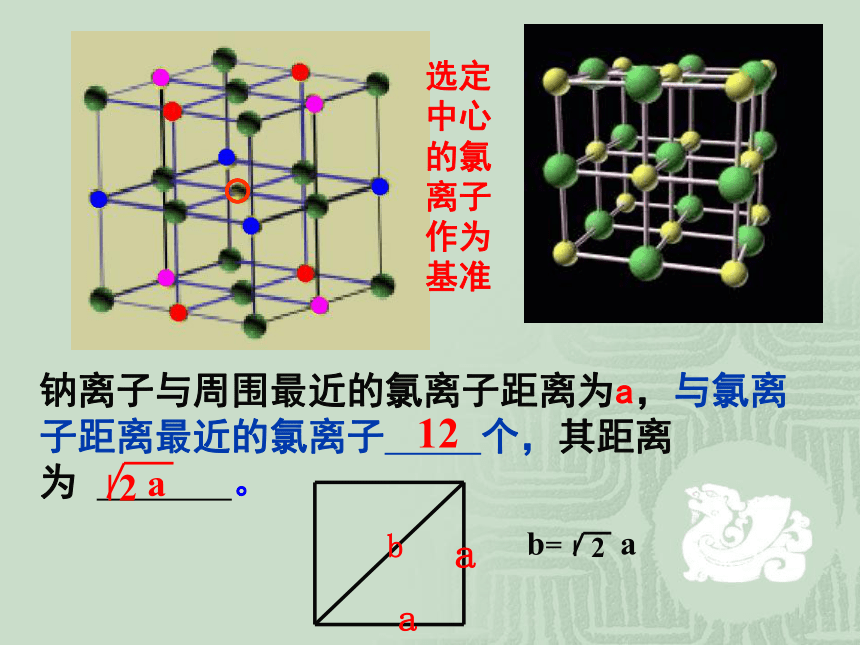
选定中心的氯离子作为基准
钠离子与周围最近的氯离子距离为a,与氯离子距离最近的氯离子 个,其距离为 。
12
b
a
a
b=
2
a
2
a
(2) CsCl晶体
在CsCl晶体中,每个Cs+同时吸引( )个Cl-,每个Cl- 同时吸引( )个Cs+。
在CsCl晶体中,每个Cs+周围与它最接近且距离相等的Cs+共有( )个。
8
8
6
氯化铯晶体结构
在CsCl晶体中,每个Cs+同时吸引( )个Cl-,每个Cl- 同时吸引( )个Cs+。
在CsCl晶体中,每个Cs+周围与它最接近且距离相等的Cs+是( )个。
8
8
6
配位数是8
Na+
Cl-
Cl-
Na+
Na+
Na+
Cl-
Cl-
Na+
Cl-
Na+
Na+
Cl-
Cl-
Na+
Cl-
Na+
Cl-
Na+
Cl-
Cl-
Na+
Na+
Na+
Cl-
Cl-
Na+
NaCl和 CsCl是不是表示分子组成的的分子式?
那么,它们表示的是什么??
Na+
Cl-
每个NaCl晶胞,平均占有Na+:12×1/4+1=4
Cl-:8×1/8+6×1/2=4
离子化合物的化学式为离子最简个数比
①Na+的配位数(等距离的Cl-)是6(上,下,左,右,前,后),构成 体;同样,Cl-的配位数也是6。
②每个Na+周围与它最近且等距离的Na+有12个(三个平面各4个)。
③每个晶胞中含有Na+和Cl-的数目都是 。
3、常见离子晶体的总结
正八面
4
密堆积的分子晶体结构示意图
由此可见,每个分子周围有12个分子。
①Cs+的配位数是8 ,构成 体。Cl-的配位数也是8。
立方(正六面)
正八面
②每个Cs+ 周围最近且等距离的Cs+有6个(上,下,左,右,前,后) 构成 体。
CaF2型晶体结构模型
①Ca2+的配位数是8:
Ca2+ 周围8个F-成立方体;
F-的配位数是4:
F-周围4个Ca2+成正四面体。
②每个 Ca2+周围与它最近且等距离的Ca2+有12个,每个F-周围与它最近且等距离的F-有6个。
③ 晶胞中含有Ca2+的数目是8×1/8+6×1/2=4,
F-的数目是1×8=8,晶体的化学式为CaF2。
4、离子晶体的物理性质:
NaCl
CsCl
熔点℃
沸点℃
801
645
1413
1290
大多易溶于极性溶剂,难溶于非极性溶剂。
固体不导电,水溶液或熔融状态导电;
硬度较大,难于压缩,熔沸点较高;
请你想想
为什么NaCl的熔沸点比CsCl高?
异:Na+半径比Cs+ 小
同:Na+ 与Cs+ 均带一个单位正电荷,
阴离子均为氯离子。
结果:NaCl晶体中的离子键较强,则熔沸点较高。
一般来说:阴、阳离子的电荷数越多,离子半径越小,则离子键越强,离子晶体的晶格能越大。
5、晶格能:
①.概念:离子晶体的晶格能是指__________形成1摩离子晶体_____的能量,通常取_____,单位为 __________。
②.晶格能对离子晶体性质的影响:晶格能是最能反映离子晶体________的数据。晶格能越大,形成的离子晶体越______,而且熔点_____,硬度______。
气态离子
释放
正值
kJ·mol-1
稳定性
稳定
越高
越大
练习:NaCl与KCl, MgCl2与NaCl哪一个晶格能更大?
晶格能:NaCl>KCl;MgCl2>NaCl。
小结:
各种晶体结构与性质关系的比较:
溶解性
导电性
熔、沸点
硬 度
粒子间的相互作用力
构成晶体粒子
原子晶体
分子晶体
离子晶体
晶体类型
结 构
性 质
离子
分子
原子
范德华力
离子键
共价键
较大
较高
熔融或水溶液中能导电
一般易溶于水
部分溶于水
不导电,部分溶于水导电
较低
很高
较小
很大
不导电,个别为半导体
不溶于任何溶剂
2.同
种
晶
体
离子晶体:电荷越多,离子半径越小,
物质熔沸点的一般规律
1、不同晶型的熔沸点:
原子晶体 > 离子晶体 > 分子晶体
(金属晶体熔沸点有的很高(钨);有的则很低(汞)。
离子键强,熔沸点越高。
MgO>MgCl2>NaCl>KCl>KBr
原子晶体:比较共价键强弱(看键长和键能)
金刚石(C) > SiC > Si
分子晶体:
金属晶体:
比较分子间作用力:
比较金属键:
2.同
种
晶
体
分子晶体:比较分子间作用力:
1)结构相似时,分子质量大熔沸点高
F22)同分异构体:支链越多沸点越低;
正戊烷>异戊烷>新戊烷
物质熔沸点的一般规律
金属晶体:比较金属键:
同主族从上到下熔沸点逐渐减小,
同周期从左到右熔沸点逐渐增大。
Li>Na>K>Rb>Cs ; Na题型探究技法归纳
题型1 离子晶体的空间构型
如图是从NaCl或CsCl晶体结构中分割出来的部分结构,其中属于NaCl晶体中分割出来的结构图是( )
例1
A.(1)和(3) B.(2)和(3) C.(1)和(4) D.只有(4)
C
【解析】图(1)中黑球的配位数为6,图(4)应为简单立方结构。
图(2)中黑球的配位数为8,图(3)为体心立方结构。
题型2 离子晶体的物理性质
下列性质适合于离子晶体的是( )
①熔点1070 ℃,易溶于水,水溶液能导电
②熔点10.31 ℃,液态不导电,水溶液导电
③熔点112.8 ℃,沸点444.6 ℃,能溶于CS2
④熔点97.81 ℃,质软,导电,密度0.97 g·cm-3
⑤熔点-218 ℃,难溶于水
⑥熔点3900 ℃,硬度很大,不导电
⑦难溶于水,固态时导电,升温时导电能力减弱
⑧难溶于水,熔点高,固体不导电,熔化时导电
例2
A.①⑧ B.②③⑥ C.①④⑦ D.②⑤
A
如图所示的是硼和镁形成的某化合物的晶体结构单元:镁原子间形成正六棱柱,且棱柱的上下底面还各有1个镁原子,6个硼原子位于棱柱内。则该化合物的化学式可表示为
A、MgB B、 MgB2
C、Mg2B D、Mg3B2
Mg原子的数目:
12×1/6+2×1/2=3
B原子的数目:6
故化学式可表示为MgB2
题型3 求晶体的化学式
例3
B
[练习1].下图为高温超导领域中的一种化合物:钙-钛矿 (氧化物)晶体结构中具有代表性的最小重复单元:该晶体中氧钙钛的微粒个数比为_______ 该晶体的化学式为_______
Ti
O
Ca
3:1:1
分析:
Ti: 顶点:8
O: 棱心:12
Ca: 体心:1
×1/8 =1
×1/4 =3
CaTiO3
[练习2] 、钇钡铜氧化合物在90K温度下具有超导性。若该化合物晶体的晶胞结构如图所示,则该化合物的化学式是 。
A.YBa2Cu3O3.75
B.YBa2Cu2O7
C.YBa2Cu3O5.5
D.YBa2Cu4O7
Ba
O
Y
Cu
C
右图为NaCl晶胞结构示意图。
(1)用X射线衍射法测得晶胞的边长为a cm,求该温度下NaCl晶体的密度。
(2)晶体的密度为ρg/cm3,则晶体中Na+与Na+之间的最短距离是多少?
ρ=m/V=
题型4、 晶体密度、粒子间距离的计算
例4
[练习3]. 已知 NaCl 的摩尔质量为 M g·mol-1,食盐晶体的密度为ρg·cm-3,若下图中Na+与最邻近的Cl- 的核间距离为 a cm,那么阿伏加德罗常数的值可表示为 A. 2Ma3ρ B. M/a3ρ
C. 2M/a3ρ D.M/2a3ρ
D
[练习4]、 NiO晶体结构与NaCl相同,Ni2+与邻近的O2-核间距为a×10-8 ㎝,计算NiO晶体密度
(NiO摩尔质量:74.7g·mol-1)
即晶体中每个小正方体中平均含有1/2个NiO其质量为:
而此小正方体体积为:(a×10-8㎝)3
故NiO晶体密度为:
解:在该晶体中最小正方体中所含的Ni2+、O2-个数均为:
4×1/8=1/2(个)
[练习5]金是面心立方晶胞(如图),
金原子的直径为d,用NA表示阿伏加
德罗常数,M表示金的摩尔质量。
(1)金晶体中每个晶胞中含有
个金原子;
(2) 一个晶胞的体积是多少?
(3)金晶体的密度是多少?
4
右图为NaCl晶胞结构,已知FexO晶体晶胞结构为NaCl型,由于晶体缺陷,x值小于1。测知FexO晶体的密度为ρ=5.71g/cm3,晶胞边长为4.28×10-10m。
(1) FexO中的x值(精确至0.01)为 ;
(2)晶体虽的Fen+分别为Fe2+和Fe3+,
在Fe2+和Fe3+的总数中, Fe2+所占分数
(用小数表示)为 ;
(3)此晶体的化学式为 ;
(4)与某个Fe2+或Fe3+距离最近且距离相等的O2-离子围成的空间几何形状是 ;
(5)在晶体中铁元素的离子间最短距离为 m。
0.92
0.826
正八面体
3.03×10-10
Fe0.762+Fe0.163+O
例5
祝:
同学们学习进步,
天天有个好心情
晶体的分类及依据
分类依据
构成晶体的微粒(离子、原子、分子)
微粒间的作用力
化学键
分子间作用力
离子键
共价键
金属键
常见晶体类型:分子晶体、原子晶体、
金属晶体、离子晶体
作用力越强,晶体的熔沸
点越高,晶体的硬度越大。
第四节、离 子 晶 体
1.定义:
离子间通过离子键结合而成的晶体
微粒间的作用力:
构成微粒:
组成元素:
离子键
阴、阳离子
一般由金属元素和非金属元素组成
注
意
离子化合物在固态时都是离子晶体
2.离子晶体的结构
1、在NaCl晶体中,每个Na+同时吸引( )个Cl-,每个Cl- 同时吸引( )个Na+。
2、在NaCl晶体中,每个Na+周围与它最接近且距离相等的Na+共有( )个。
(1) NaCl晶体
6
6
12
NaCl的晶体结构:
在NaCl晶体中,每个Na+同时吸引( )个Cl-,每个Cl- 同时吸引( )个Na+。
6
6
选定中心的氯离子作为基准
钠离子与周围最近的氯离子距离为a,与氯离子距离最近的氯离子 个,其距离为 。
12
b
a
a
b=
2
a
2
a
(2) CsCl晶体
在CsCl晶体中,每个Cs+同时吸引( )个Cl-,每个Cl- 同时吸引( )个Cs+。
在CsCl晶体中,每个Cs+周围与它最接近且距离相等的Cs+共有( )个。
8
8
6
氯化铯晶体结构
在CsCl晶体中,每个Cs+同时吸引( )个Cl-,每个Cl- 同时吸引( )个Cs+。
在CsCl晶体中,每个Cs+周围与它最接近且距离相等的Cs+是( )个。
8
8
6
配位数是8
Na+
Cl-
Cl-
Na+
Na+
Na+
Cl-
Cl-
Na+
Cl-
Na+
Na+
Cl-
Cl-
Na+
Cl-
Na+
Cl-
Na+
Cl-
Cl-
Na+
Na+
Na+
Cl-
Cl-
Na+
NaCl和 CsCl是不是表示分子组成的的分子式?
那么,它们表示的是什么??
Na+
Cl-
每个NaCl晶胞,平均占有Na+:12×1/4+1=4
Cl-:8×1/8+6×1/2=4
离子化合物的化学式为离子最简个数比
①Na+的配位数(等距离的Cl-)是6(上,下,左,右,前,后),构成 体;同样,Cl-的配位数也是6。
②每个Na+周围与它最近且等距离的Na+有12个(三个平面各4个)。
③每个晶胞中含有Na+和Cl-的数目都是 。
3、常见离子晶体的总结
正八面
4
密堆积的分子晶体结构示意图
由此可见,每个分子周围有12个分子。
①Cs+的配位数是8 ,构成 体。Cl-的配位数也是8。
立方(正六面)
正八面
②每个Cs+ 周围最近且等距离的Cs+有6个(上,下,左,右,前,后) 构成 体。
CaF2型晶体结构模型
①Ca2+的配位数是8:
Ca2+ 周围8个F-成立方体;
F-的配位数是4:
F-周围4个Ca2+成正四面体。
②每个 Ca2+周围与它最近且等距离的Ca2+有12个,每个F-周围与它最近且等距离的F-有6个。
③ 晶胞中含有Ca2+的数目是8×1/8+6×1/2=4,
F-的数目是1×8=8,晶体的化学式为CaF2。
4、离子晶体的物理性质:
NaCl
CsCl
熔点℃
沸点℃
801
645
1413
1290
大多易溶于极性溶剂,难溶于非极性溶剂。
固体不导电,水溶液或熔融状态导电;
硬度较大,难于压缩,熔沸点较高;
请你想想
为什么NaCl的熔沸点比CsCl高?
异:Na+半径比Cs+ 小
同:Na+ 与Cs+ 均带一个单位正电荷,
阴离子均为氯离子。
结果:NaCl晶体中的离子键较强,则熔沸点较高。
一般来说:阴、阳离子的电荷数越多,离子半径越小,则离子键越强,离子晶体的晶格能越大。
5、晶格能:
①.概念:离子晶体的晶格能是指__________形成1摩离子晶体_____的能量,通常取_____,单位为 __________。
②.晶格能对离子晶体性质的影响:晶格能是最能反映离子晶体________的数据。晶格能越大,形成的离子晶体越______,而且熔点_____,硬度______。
气态离子
释放
正值
kJ·mol-1
稳定性
稳定
越高
越大
练习:NaCl与KCl, MgCl2与NaCl哪一个晶格能更大?
晶格能:NaCl>KCl;MgCl2>NaCl。
小结:
各种晶体结构与性质关系的比较:
溶解性
导电性
熔、沸点
硬 度
粒子间的相互作用力
构成晶体粒子
原子晶体
分子晶体
离子晶体
晶体类型
结 构
性 质
离子
分子
原子
范德华力
离子键
共价键
较大
较高
熔融或水溶液中能导电
一般易溶于水
部分溶于水
不导电,部分溶于水导电
较低
很高
较小
很大
不导电,个别为半导体
不溶于任何溶剂
2.同
种
晶
体
离子晶体:电荷越多,离子半径越小,
物质熔沸点的一般规律
1、不同晶型的熔沸点:
原子晶体 > 离子晶体 > 分子晶体
(金属晶体熔沸点有的很高(钨);有的则很低(汞)。
离子键强,熔沸点越高。
MgO>MgCl2>NaCl>KCl>KBr
原子晶体:比较共价键强弱(看键长和键能)
金刚石(C) > SiC > Si
分子晶体:
金属晶体:
比较分子间作用力:
比较金属键:
2.同
种
晶
体
分子晶体:比较分子间作用力:
1)结构相似时,分子质量大熔沸点高
F2
正戊烷>异戊烷>新戊烷
物质熔沸点的一般规律
金属晶体:比较金属键:
同主族从上到下熔沸点逐渐减小,
同周期从左到右熔沸点逐渐增大。
Li>Na>K>Rb>Cs ; Na
题型1 离子晶体的空间构型
如图是从NaCl或CsCl晶体结构中分割出来的部分结构,其中属于NaCl晶体中分割出来的结构图是( )
例1
A.(1)和(3) B.(2)和(3) C.(1)和(4) D.只有(4)
C
【解析】图(1)中黑球的配位数为6,图(4)应为简单立方结构。
图(2)中黑球的配位数为8,图(3)为体心立方结构。
题型2 离子晶体的物理性质
下列性质适合于离子晶体的是( )
①熔点1070 ℃,易溶于水,水溶液能导电
②熔点10.31 ℃,液态不导电,水溶液导电
③熔点112.8 ℃,沸点444.6 ℃,能溶于CS2
④熔点97.81 ℃,质软,导电,密度0.97 g·cm-3
⑤熔点-218 ℃,难溶于水
⑥熔点3900 ℃,硬度很大,不导电
⑦难溶于水,固态时导电,升温时导电能力减弱
⑧难溶于水,熔点高,固体不导电,熔化时导电
例2
A.①⑧ B.②③⑥ C.①④⑦ D.②⑤
A
如图所示的是硼和镁形成的某化合物的晶体结构单元:镁原子间形成正六棱柱,且棱柱的上下底面还各有1个镁原子,6个硼原子位于棱柱内。则该化合物的化学式可表示为
A、MgB B、 MgB2
C、Mg2B D、Mg3B2
Mg原子的数目:
12×1/6+2×1/2=3
B原子的数目:6
故化学式可表示为MgB2
题型3 求晶体的化学式
例3
B
[练习1].下图为高温超导领域中的一种化合物:钙-钛矿 (氧化物)晶体结构中具有代表性的最小重复单元:该晶体中氧钙钛的微粒个数比为_______ 该晶体的化学式为_______
Ti
O
Ca
3:1:1
分析:
Ti: 顶点:8
O: 棱心:12
Ca: 体心:1
×1/8 =1
×1/4 =3
CaTiO3
[练习2] 、钇钡铜氧化合物在90K温度下具有超导性。若该化合物晶体的晶胞结构如图所示,则该化合物的化学式是 。
A.YBa2Cu3O3.75
B.YBa2Cu2O7
C.YBa2Cu3O5.5
D.YBa2Cu4O7
Ba
O
Y
Cu
C
右图为NaCl晶胞结构示意图。
(1)用X射线衍射法测得晶胞的边长为a cm,求该温度下NaCl晶体的密度。
(2)晶体的密度为ρg/cm3,则晶体中Na+与Na+之间的最短距离是多少?
ρ=m/V=
题型4、 晶体密度、粒子间距离的计算
例4
[练习3]. 已知 NaCl 的摩尔质量为 M g·mol-1,食盐晶体的密度为ρg·cm-3,若下图中Na+与最邻近的Cl- 的核间距离为 a cm,那么阿伏加德罗常数的值可表示为 A. 2Ma3ρ B. M/a3ρ
C. 2M/a3ρ D.M/2a3ρ
D
[练习4]、 NiO晶体结构与NaCl相同,Ni2+与邻近的O2-核间距为a×10-8 ㎝,计算NiO晶体密度
(NiO摩尔质量:74.7g·mol-1)
即晶体中每个小正方体中平均含有1/2个NiO其质量为:
而此小正方体体积为:(a×10-8㎝)3
故NiO晶体密度为:
解:在该晶体中最小正方体中所含的Ni2+、O2-个数均为:
4×1/8=1/2(个)
[练习5]金是面心立方晶胞(如图),
金原子的直径为d,用NA表示阿伏加
德罗常数,M表示金的摩尔质量。
(1)金晶体中每个晶胞中含有
个金原子;
(2) 一个晶胞的体积是多少?
(3)金晶体的密度是多少?
4
右图为NaCl晶胞结构,已知FexO晶体晶胞结构为NaCl型,由于晶体缺陷,x值小于1。测知FexO晶体的密度为ρ=5.71g/cm3,晶胞边长为4.28×10-10m。
(1) FexO中的x值(精确至0.01)为 ;
(2)晶体虽的Fen+分别为Fe2+和Fe3+,
在Fe2+和Fe3+的总数中, Fe2+所占分数
(用小数表示)为 ;
(3)此晶体的化学式为 ;
(4)与某个Fe2+或Fe3+距离最近且距离相等的O2-离子围成的空间几何形状是 ;
(5)在晶体中铁元素的离子间最短距离为 m。
0.92
0.826
正八面体
3.03×10-10
Fe0.762+Fe0.163+O
例5
祝:
同学们学习进步,
天天有个好心情
