高三上化学复习一轮教学案 第一章 化学反应及能量变化-旧人教[上学期]
文档属性
| 名称 | 高三上化学复习一轮教学案 第一章 化学反应及能量变化-旧人教[上学期] |

|
|
| 格式 | rar | ||
| 文件大小 | 295.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-10-29 00:00:00 | ||
图片预览




文档简介
南洋中学一轮复习教学案
高三总复习 第一讲 氧化还原反应
一. 重点、难点:
1. 理解氧化剂和还原剂、氧化性和还原性等概念。
2. 能判断氧化还原反应中电子转移的方向和数目。
二. 具体内容:
(一)概念及实质
1. 概念:发生电子转移(得失或偏移)的反应。
2. 实质:发生电子转移。
3. 判断:有化合价升降。
反应物 化合价变化 表现性质 变化过程 发生反应 生成物
氧化剂还原剂 降低 升高 氧化性 还原性 被还原 被氧化 还原反应 氧化反应 还原产物 氧化产物
(二)元素的化合价
元素原子的最外电子层结构决定了原子间是按一定数目相互化合,元素的原子相互化合的数目叫这种元素的化合价。
1. 单质中元素的化合价为0;
2. 在化合物中金属元素的化合价全为正值,非金属元素的化合价一般既有负值又有正值;
3. 在化合物中,各元素的正、负化合价的代数和为0;
如:原子团的化合价:NO3-、SO42-、SO32-、HSO3-(亚硫酸氢根)、CO32-、
HCO3-、ClO3-(氯酸根)、NH4+(铵根)、MnO4-(高锰酸根)、PO43-(磷酸根)。
中心元素的化合价:
4. 离子化合物中,元素的化合价与在生成它们的反应中原子得、失电子数目及离子的电荷数在数值上相等,如NaCl:
离子符号 原子得、失电子数 离子的电荷数 元素的化合价
Na+ 1(失) 1 +1
Cl- 1(得) 1 -1
共价化合物中,元素的化合价与在生成它们的反应中共用电子对的偏向、偏离的对数在数值上相等。如HCl:
共用电子对偏向氯原子,氯元素化合价为-1价;共用电子对偏离氢原子,氢元素化合价为+1价。
5. 有机物中:H:+1、O:,再计算C元素平均化合价。
(三)氧化还原反应中电子转移的表示方法
双线桥法
1. 双箭号从反应物指向生成物,箭号起止所指的均为同一种元素。
2. 线上标出得失电子的情况及价的升降、被氧化或被还原等内容。
氧化剂为Fe2O3,还原剂为CO,氧化产物为CO2,还原产物为Fe。
氧化剂为HCl,还原剂为Zn,氧化产物为ZnCl2,还原产物为H2。
单桥线法
1. 箭号由还原剂中失电子的元素指向氧化剂中得电子的元素;
2. 线上只标出转移电子的总数。
(四)氧化还原反应的规律
1. 对立统一规律
还原剂、氧化剂相互对立又相互依存。
2. 电子守恒规律
还原剂失电子总数=氧化剂得电子总数
3. 性质传递规律
氧化剂+还原剂=还原产物+氧化产物
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
4. 谁强谁先规律
在溶液中存在多种氧化剂,氧化性强的抢先得电子,先被还原。
在溶液中存在多种还原剂,还原性强的抢先失电子,先被氧化。
5. 价态规律
(1)高低规律:
最高价态——只具氧化性
最低价态——只具还原性
中间价态——兼有氧化性和还原性
讨论分析下列氧化还原反应中电子转移的方向和数目,判断氧化产物和还原产物。
① H2S+H2SO4(浓)=S↓+SO2↑+2H2O
② KClO3+6HCl=KCl+3Cl2↑+3H2O
(2)价态归中规律:
同种元素不同价态之间发生氧化还原反应时,价态的变化“只靠拢,不交叉”。
(五)重要的氧化剂、还原剂
氧化剂 具体物质 举例
(1)活泼非金属单质 O3、Cl2、Br2、O2
(2)高价的氧化物 NO2、CO2、MnO2
(3)高价的含氧酸 HClO、浓H2SO4、HNO3
(4)高价的盐 KMnO4、KClO3、FeCl3 2FeCl3+Cu=2FeCl2+CuCl2
(5)过氧化物 Na2O2、H2O2等
还原剂 具体物质 举例
(1)活泼金属单质 Na、Al、Zn、Fe
(2)某些非金属单质 H2、C、Si
(3)低价的氧化物 CO、SO2
(4)低价的酸 HCl、H2S、H2SO3
(5)低价的盐 Na2SO3、FeCl2 2FeCl2 + Cl2 = 2FeCl3
【典型例题】
[例1](2002年上海理综,16)人体血红蛋白中含有Fe2+,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+离子转变成Fe3+,生成高铁血红蛋白而丧失与O2结合的能力.服用维生素C可缓解亚硝酸盐的中毒,这说明维生素C具有( )
A. 酸性 B. 碱性 C. 氧化性 D. 还原性
解析:亚硝酸盐会使Fe2+转变成Fe3+.表现了亚硝酸盐的氧化性,服用维生素C可缓解亚硝酸盐的中毒,说明维生素C还原了亚硝酸盐或使Fe3+又生成了Fe2+,即:维生素C具有还原性。
答案: D
思考:维生素C和Fe2+都具有还原性,二者相比较还原性较强的是_______________?
答案: 维生素C的还原性比Fe2+强.因为维生素C能将Fe3+还原为Fe2+,而Fe2+则不能。(也可根据同一氧化还原反应中,还原剂维生素C的还原性比还原产物Fe2+的还原性强进行分析判断)
[例2](2002年上海23)在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质.
(1)某厂废水中含KCN,其浓度为650 mg/L.现用氯氧化法处理,发生如下反应(其中N均为价):KCN+2KO+Cl2=KOCN+2KCl+H2O。被氧化的元素是______。
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气.请配平下列化学方程式,并标出电子转移方向和数目:KOCN+KOH+Cl2——CO2+N2+KCl+H2O
(3)若处理上述废水20 L,使KCN完全转化为无毒物质.至少需液氯_______g。
解析:此题以污水处理为知识背景,考查了氧化还原的概念、氧化还原方程式的配平及氧化还原反应的计算。
(1)在KCN+2KOH+Cl2=KOCN+2KCl+H2O反应中,氯元素价态降低,H、N、O、K四种元素的价态没变,只有碳元素的价态升高,故被氧化的为碳元素。
(2)氧化还原方程式的配平,首先要找准变价元素,再利用化合价升降法配平,反应物KOCN中N的价态升高,KOCN为还原剂,氯气为氧化剂。
(3)20 L废水中含KCN的物质的量为:=0.2 mol,由两步反应的化学方程式得出关系式:2KCN~5Cl2,所以需氯气:0.2 mol×=0.5 mol,即35.5 g。
答案:(1)碳(或C)
思考:在化学反应KCN+2KOH+Cl2KOCN+2KCl+H2O中,氧化剂是___________________________;还原剂是_________________________;氧化产物是_________________;还原产物是__________________。
答案: Cl2 KCN KOCN KCl
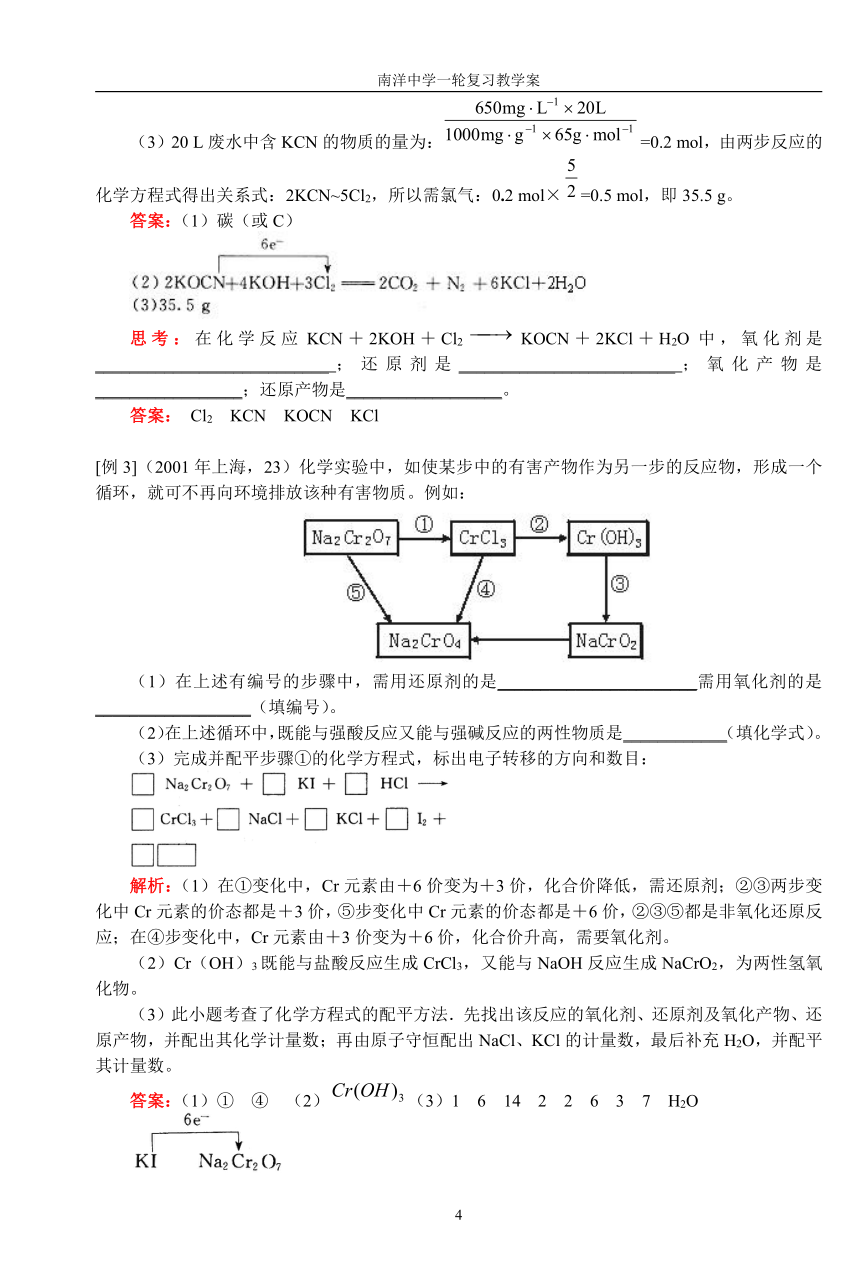
[例3](2001年上海,23)化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如:
(1)在上述有编号的步骤中,需用还原剂的是_______________________需用氧化剂的是__________________(填编号)。
(2)在上述循环中,既能与强酸反应又能与强碱反应的两性物质是____________(填化学式)。
(3)完成并配平步骤①的化学方程式,标出电子转移的方向和数目:
解析:(1)在①变化中,Cr元素由+6价变为+3价,化合价降低,需还原剂;②③两步变化中Cr元素的价态都是+3价,⑤步变化中Cr元素的价态都是+6价,②③⑤都是非氧化还原反应;在④步变化中,Cr元素由+3价变为+6价,化合价升高,需要氧化剂。
(2)Cr(OH)3既能与盐酸反应生成CrCl3,又能与NaOH反应生成NaCrO2,为两性氢氧化物。
(3)此小题考查了化学方程式的配平方法.先找出该反应的氧化剂、还原剂及氧化产物、还原产物,并配出其化学计量数;再由原子守恒配出NaCl、KCl的计量数,最后补充H2O,并配平其计量数。
答案:(1)① ④ (2)(3)1 6 14 2 2 6 3 7 H2O
思考:写出两性氢氧化物Cr(OH)3分别与盐酸、氢氧化钠反应的化学方程式.
答案:Cr(OH)3+3HCl=CrCl3+3H2O
+NaOH=NaCrO2+2H2O
[例4] 1962年,英国青年化学家以巴特莱特将PtF6和Xe按等物质的量在室温下混合后,首次得到含有化学键的稀有气体化合物六氟合铂酸氙:Xe+PtF6=XePtF6。有关此反应的叙述中,正确的是( )
A. Xe是氧化剂
B. PtF6是氧化剂
C. PtF6是氧化剂又是还原剂
D. 该反应不属于氧化还原反应
解析:关键确定XePtF6中各元素的价态,须破除Xe只有0价的思维定势,由于F元素是最活泼的非金属元素,故为-1价,但F不会表现出氧化性.而Pt在PtF6中处于较高价态具备氧化性,故Xe表现还原性,失去电子.
答案:B
[例5] 三聚氰酸C3N3(OH)3可用于消除汽车尾气中的氮氧化物(如NO2)。当加热至一定温度时,它发生如下分解:
C3N3(OH)3=3HNCO
HNCO(异氰酸,其结构是H—N=C=O)能和NO2反应生成N2、CO2和H2O。
(1)写出HNCO和NO2反应的化学方程式.分别指明化合物中哪种元素被氧化 哪种元素被还原 指出氧化剂和还原剂,标出电子转移的方向和数目。
(2)如按上述反应式进行反应,试计算吸收1.0 kg NO2气体所消耗的三聚氰酸的质量。
解析:应首先判断HNCO中N的化合价为-3价,然后才可写出方程式.HNCO的→,故其中氮元素被氧化;NO2中→,其中氮元素被还原.这个问题明确后,其他问题就简单了。
答案:
(1)
NO2是氧化剂、HNCO是还原剂;
HNCO中的氮元素被氧化,NO2中的氮元素被还原。
(2)1.0 kg×=1.2 kg
高三总复习 第二讲 氧化还原反应
一. 重点、难点
1 掌握比较氧化性、还原性强弱的一般方法。
2. 掌握配平氧化还原反应方程式的基本方法
二 具体内容
(六)氧化性、还原性强弱的判断方法
1. 金属、非金属性
(1)随着金属活动顺序表中金属活动性的减弱,金属的还原性越来越弱,其对应离子的氧化性越来越强.(除Fe3+外)
还原性逐渐减弱
氧化性逐渐增强
(2)对于非金属单质
氧化性逐渐减弱
还原性逐渐增强
2. 氧化还原反应的性质传递规律
则:还原性:H2>Cu
3. 根据元素周期律判断
(1)同周期
氧化性:左<右 还原性:左>右
(2)同主族
氧化性:上>下 还原性:上<下
4. 根据反应结果判断
(1)同一物质在相同条件下,被不同氧化剂氧化的程度越大,氧化剂的氧化性越强。
Fe+S=FeS
2Fe+3Cl2=2FeCl3
(2)同一物质在相同的条件下,被不同还原剂还原得越彻底,还原剂的还原性越强
HCl+H2SO4(浓)→不反应
HBr+H2SO4(浓)→Br2+SO2↑+H2O
HI+H2SO4(浓)→I2+H2S↑+H2O
5. 根据电极反应确定
(1)原电池 还原性:负极>正极
(2)电解池 阴极(氧化性):先析出>后析出
阳极(还原性):先反应>后反应
6. 从反应所需条件来比较。一般来讲,一组反应中,反应条件越简单,对应反应物的氧化性或还原性越强。
从反应条件可以看出氧化剂的氧化能力:KMnO4>MnO2>O2
7. 外界条件对氧化性或还原性强弱的影响(同一物质在不同条件下的氧化性或还原性)
(1)物质的浓度越高,氧化性或还原性越强。
(2)温度越高,氧化性或还原性越强。
(3)酸性越强,氧化性越强;碱性越强,还原性越强。
【典型例题】
[例1] 常温下,在下列溶液中发生如下反应
① 16H++10Z-+2XO=2X2++5Z2+8H2O
② 2A2++B2=2A3++2B-
③ 2B-+Z2=B2+2Z-
由此判断下列说法错误的是( )
A. 反应Z2+2A2+=2A3++2Z-可以进行
B. Z元素在①③反应中均被还原
C. 氧化性由强到弱的顺序是XO、Z2、B2、A3+
D. 还原性由强到弱的顺序是A2+、B-、Z-、X2+
解析:根据有关规律,在同一反应中,氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性,可得出( )
氧化性:XO>Z2>B2>A3+
答案: B
[例2] 从下列各组反应对比中,判断哪种粒子的氧化性最强,哪种粒子的还原性最强.
(1)铁钉浸入CuSO4溶液后,表面会附有红色物质;铜丝浸入AgNO3溶液后,表面会附有银白色物质,则Cu、Fe、Ag中,___________原子还原性最强;Cu2+、Fe2+、Ag+中,_______________离子氧化性最强。
(2)铁钉在氯气中被锈蚀成棕褐色物质FeCl3,而在盐酸中生成淡绿色溶液(FeCl2)。则氯气分子、氯离子、氢离子中_____________具有氧化性,___________氧化性最强。
解析:(1)由反应Fe+Cu2+=Fe2++Cu可知氧化性Cu2+>Fe2+,还原性Fe>Cu;由Cu+2Ag+=2Ag+Cu2+可知,氧化性Ag+>Cu2+,还原性Cu>Ag,故Fe的还原性最强,Ag+氧化性最强。
(2)因Cl2、H+都能将铁氧化,被还原为Cl-、H2,所以Cl2、H+具有氧化性;由Fe被Cl2、H+氧化的程度可知,Cl2氧化性最强。
答案:(1)Fe Ag+ (2)H+、;
[例3](1)配平化学方程式
KMnO4+FeS+H2SO4——MnSO4+Fe2(SO4)3+S↓+K2SO4+H2O
解析:① 标价态。
KO4++H2SO4——SO4+(SO4)3+↓+K2SO4+H2O
② 列变化,算出一个氧化剂(或还原剂)“分子”的化合价总共降低(或升高)多少.
氧化剂KMnO4,→↓5价
③ 等升降。↑3×5(系数)5FeS;↓5×3(系数)3KMnO4并确定相应的其他元素的系数:
3KMnO4+5FeS+H2SO4——3MnSO4+Fe2(SO4)3+5S↓+K2SO4+H2O
④ 平系数。
用观察法配平其他物质的系数,一般先配盐,再配酸,最后配水,并核对氧原子数。
⑤ 验结果。
答案:6 10 24——6 5 10 3 24
(2)配平化学方程式并填空
当KMnO4消耗0.05 mol时,产生CO2的体积为__________________L(标准状况下)。
解析:为简化过程,可直接在原题目中进行分析。首先列出价态变化并使之升降总数相等:
2×5 5×2
↑ ↓
H2C2O4 +KMnO4+H2SO4——CO2+K2SO4+MnSO4+H2O
然后确定参与氧化还原反应的元素的计量数:
5H2C2O4+2KMnO4+H2SO4——10CO2+K2SO4+2MnSO4+H2O
再用观察法配平其他物质的计量数:
5H2C2O4+2KMnO4+3H2SO4=10CO2+K2SO4+2MnSO4+8H2O
最后用O原子个数进行验算。
又根据方程式得:2KMnO4~10CO2
所以V(CO2)=0.05××22.4=5.6 L
答案:5 2 3——10 1 2 8 5.6
[例4] 已知Cu2S与某浓度的HNO3反应时,生成Cu(NO3)2和H2SO4,若反应中Cu2S与HNO3的质量比为320:819,则该反应的还原产物为__________________。
解析:Cu2S与HNO3物质的量之比为:=2:13,设还原产物中N元素价态降低n价,由得失电子守恒可知:2×(1×2+8)=(13-2×4)n,解得n=4,其还原产物为N2O。
答案: N2O
[例10] 绿矾在强热条件下分解,生成H2SO4、SO2、Fe2O3和H2O,每生成1 mol H2SO4时,分解绿矾的物质的量是__________________。
解析:设分解绿矾的物质的量为x,则生成氧化产物Fe2O3的物质的量为,生成还原产物SO2物质的量为y,由得失电子守恒可知×1×2=y×2,即y=,由题意可知
x-=1mol 解得x=2mol
答案: 2 mol
[例5] 已知下列变化过程中,0.2 mol RxO参加反应时,共转移0.4 mol电子。
RxO+MnO+H+RO2+Mn2++H2O
(1)x值为__________。
(2)参加反应的H+的物质的量为__________mol。
解析:由得失电子守恒可知:
0.2 molx×(4-)=0.4 mol ?=2
n(MnO)×5=0.4 mol
n(MnO)=0.08 mol
由电荷守恒可知:
n(H+)×1-0.08 mol×1-0.2 mol×2=0.08 mol×2
n(H+)=0.64 mol
答案:(1)2 (2)0.64
【模拟试题】
1. 下列反应一定属于氧化还原反应的是( )
A. 化合反应 B. 分解反应
C. 置换反应 D. 复分解反应
2. 下列变化中,需要加入氧化剂的是( )
A. SO2→SO3 B. HCl→H2
C. FeCl2→FeCl3 D. Fe2O3→Fe
3. 按金属活动性顺序由前到后考虑,下列说法中正确的是( )
A. 单质的还原性逐渐减弱
B. 原子的失电子能力逐渐增强
C. 对应离子的氧化性逐渐增强
D. 对应离子的得电子能力逐渐减弱
4. 下列反应中,盐酸只作氧化剂的是( )
A . Zn+2HCl=ZnCl2+H2↑
B.
C. Cl2+H2O=HCl+HClO
D. CaCO3+2HCl=CaCl2+H2O+CO2
5. 下列叙述中,正确的是( )
A. 同一反应中,氧化剂的氧化性比氧化产物的氧化性强
B. 同一反应中,还原剂的还原性比还原产物的还原性弱
C. 由X原子变成X2+的反应是氧化反应
D. 由X原子变成X2+,需加入还原剂
6. 在3Cl2+8NH3=6NH4Cl+N2反应中,还原性最强的物质是( )
A. Cl2 B. NH3 C. NH4Cl D. N2
7. 下列关于氧化还原反应的叙述中正确的是( )
A. 金属单质在反应中只作为还原剂
B. 非金属单质在反应中只作为氧化剂
C. 金属原子失电子越多,还原性越强
D. Cu2+比Fe2+氧化性强,Fe比Cu还原性强
8. 一个A原子转移两个电子给两个B原子,下列说法中正确的是( )
A. 形成化合物AB2,A是氧化剂
B. 形成化合物A2B,A被还原
C. 形成化合物AB2,B被还原
D. 形成化合物AB2,B有氧化性
9. 某反应的化学方程式为:aFeCl2+bKNO3+cHCl=dFeCl3+eKCl+fX+gH2O,若b=1,d=3,则X的化学式为( )
A. N2 B. NO C. NO2 D. NH4Cl
10. 有反应:;;依据上述方程式,下列微粒氧化能力排列顺序正确的是( )
A. B.
C. D.
11. 在8NH3+3Cl2=N2+6NH4Cl反应中,若有21.3g Cl2参加反应,则被氧化的NH3的质量为( )
A. 13.6g B. 10.2g C. 6.8g D. 3.4g
12. 离子在一定条件下可把Mn2+氧化成,若反应后变成,又知反应中氧化剂与还原剂的离子个数比为5:2,则中R元素的化合价为( )
A. +3 B. +5 C. +6 D. +7
13. 一定条件下硝酸铵受热分解的未配平化学方程式为:NH4NO3——HNO3+N2+H2O,在反应中被氧化与被还原的氮原子之比为( )
A. 1:1 B. 5:4 C. 5:3 D. 3:5
14. 下列叙述中,正确的是( )
A. 含氧酸能起氧化作用,无氧酸则不能
B. 阳离子只有氧化性,阴离子只有还原性
C. 失电子难的原子获得电子的能力一定强
D. 由X变为X2+的化学反应是氧化反应
15. 下列对盐酸的有关性质叙述正确的是( )
A. 有酸性,没有氧化性和还原性
B. 有酸性和氧化性,没有还原性
C. 有酸性和还原性,没有氧化性
D. 有氧化性和还原性,还有酸性
16. 配平下列氧化还原反应方程式。
① P+CuSO4+H2OCu3P+H3PO4+H2SO4
② H2PO+Ag++H2OH3PO4+Ag↓+H2↑
③ Fe2++O2+H2OFe3++Fe(OH)3↓
④ S+Ca(OH)2CaS2O3+CaS·Sx+H2O
17. 配平下列氧化还原反应方程式,并标明电子转移的方向和数目。
① H2S+H2SO3S↓+H2O
氧化产物是_____________,还原产物是_____________,二者质量比是_____________.
② Cl2+KOHKCl+KClO3+H2O
氧化剂是_____________,还原剂是____________,二者物质的量之比是____________.
③ KClO3+HClKCl+Cl2↑+H2O
HCl的作用是_____________,被还原的元素是________________,当反应过程中有3 mol电子转移时,可产生氯气_____________mol。
④ KIx+Cl2+H2OKCl+HIO3+HCl,若KIx与Cl2的化学计量数之比为1:8,则x=_____________。
18. 智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘,其化学方程式为:2NaIO3+5NaHSO3=3NaHSO4+2Na2SO4+I2+H2O
(1)反应中_____________元素被氧化,_____________是氧化剂。
(2)用短线标出电子转移方向和总数。
(3)反应产物中,所得氧化产物与还原产物质量之比为_____________。
19. ① 在淀粉碘化钾溶液中,滴加少量次氯酸钠溶液,立即会看到溶液变蓝色,这是因为_____________,离子方程式为____________________。
② 在碘和淀粉形成的蓝色溶液中,滴加亚硫酸钠溶液,发现蓝色逐渐消失,这是因为__________________,离子方程式是____________________。
③ 对比①和②实验所得的结果,将I2、ClO-、SO按氧化性由强到弱的顺序排列为___________________。
20. K2Cr2O7是一种橙红色且具有强氧化性的化合物,当它被还原成三价铬时,颜色有明显变化.据此,当交通警察发现汽车行驶反常时,就上前拦车,并让司机对填充了吸附有K2Cr2O7的硅胶颗粒的装置吹气。若发现硅胶变色达到一定程度,即证明司机是_________。这是因为K2Cr2O7跟_________(写化学名称)发生了反应.反应中,当有0.06 mol电子发生转移时,有_____________mol K2Cr2O7被还原。
21.(2003年上海,23)实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为:4CuI+HgCu2HgI4+2Cu
(1)上述反应产物Cu2HgI4中,Cu元素显__________价。
(2)以上反应中的氧化剂为__________,当有1 mol CuI参与反应时,转移电子________mol。
(3)CuI可由Cu2+与I-直接反应制得,请配平下列反应的离子方程式。
22. 工业上为从4J29合金(铁钴镍合金)废料中提取钴和镍,一般先用硫酸溶解合金使成为Fe2+、Co2+、Ni2+,再把Fe2+氧化为Fe3+,从而使Fe3+转化为某种沉淀析出,达到与Ni2+、Co2+分离的目的.生产上要使Fe2+氧化为Fe3+,而不使Co2+、Ni2+氧化的试剂是NaClO或NaClO3(均含少量H2SO4)溶液,反应的部分化学方程式如下(A为还原剂):
请完成以上化学方程式,并回答实际生产上采用NaClO3来氧化Fe2+比较合算的理由。
配平下列离子方程式,并回答问题:
(2)已知有3.21 g Fe(OH)3参加反应,共转移了5.42×1022个电子,则n=_______,FeO中铁的化合价为_____________________。
(3)根据(1)、(2)推测FeO能与下列哪些物质反应(只填序号)______________。
A. Cl2 B. SO2 C. H2S D. O2
【试题答案】
1. C 2. AC 3. AC 4. A 5. AC 6. B 7. AD 8. CD
9. B 10. C 11. D 12. D 13. C 14. D 15. D
提示:
1. 参见“氧化还原反应与基本反应类型的关系”,同步教学中的“一、(一)、8”,选C。
2. 只有物质被氧化,元素化合价升高时才需要加入氧化剂,选AC。
3. 参见同步教学中的“二、(一)、2”中的金属活动性与还原性、离子氧化性的关系,选AC。
4. A中的HCl全部作氧化剂,起氧化作用的是H+;
B中的HCl既作还原剂,又起酸的作用;
C中的HCl是还原产物;
D中的HCl起酸的作用。选A。
5. 参见同步教学中“氧化性和还原性强弱的比较”。选AC。
6. 根据氧化剂,氧化产物具有氧化性,还原剂,还原产物具有还原性,且还原剂的还原性大于还原产物的还原性。选B。
7. A中金属在反应时,一般由0价上升到正价,都作还原剂,B中非金属单质在反应中价态可升可降,既可以作氧化剂,也可以作还原剂,如:Cl2+H2O=HCl+HClO,C中还原性是以失电子的能力而论,而不是以失电子多少为依据,选AD。
8. 可以写出反应:A+2B=AB2,选CD
9. 设X中N的化合价为+m价
aFeCl2+bKNO3+cHCl=dFeCl3+eKCl+fX+gH2O
↓(5-m)b ↑d
依据化合价升降相等(5-m)b=d,b=1,d=3
则:m=2,因此产物为NO(N为+2价),选B。
10. 根据氧化剂的氧化能力大于氧化产物的氧化能力,选C。
11. 反应方程式中8NH3只有2NH3被氧化,设被氧化的NH3为xg,则:
2NH3+6NH3+3Cl2=N2+6NH4Cl
34g 71×3g
xg 21.3g
解得:x=3.4g,选D。
12. 依据题目,试着写出反应为:
据化合价升降相等:2×(x-6)×5=5×2
解得x=+7,选D.
13. 由题给:NH4NO3——HNO3+N2+H2O知NH4+中-3价氮元素失电子被氧化成N2,NH4NO3中-3价的氮被氧化;NO3-中+5价氮元素被还原为N2,NH4NO3中+5价的氮被还原,由得失电子相等,故有5NH4-失电子总数=3NO3-得电子总数的关系,因而被氧化的氮与被还原的氮原子数之比为5:3,选C。
14. A项错,任何酸都能电离出H+,因而都有氧化性,B项错,物质的氧化性或还原性与原子团的电荷无关,只与其中某些元素的价态有关。MnO4-有氧化性,NH4+有还原性,C项错,稀有气体既难得电子,也难失电子,选D。
15. HCl中+1价的氢有氧化性,-1价的Cl有还原性,另外H+还体现了酸性选D。
16. ① 11,15,24——5,6,15
② 2,2,4——2,2,3
③ 12,3,6——8,4
④ 4+2x,3——1,2,3
17. ① 2,1——3,3 S S 2:1
② 3,6——5,1,3 Cl2 Cl2 5:1
③ 1,6——1,3,3 还原剂与酸作用 氯酸钾中氯元素 1.8
④ 2,5x+1,6x——2,2x,10x 3?
18. (1)硫 碘酸钠
(3)氧化产物为3NaHSO4+2Na2SO4,还原产物为I2,故氧化产物与还原产物质量之比为(3×120+2×142):(2×127)=322:127
先从化合价的变化入手:;。在任何一个氧化还原反应中,得失电子总数(电子转移总数)等于化合价升降总数,本题第(2)问即是根据此规律来确定电子转移总数的。
19. ① I-被氧化成I2,I2遇淀粉变蓝 2I-+ClO-+H2O=I2+Cl-+2OH-
② I2被SO还原成I- I2+SO+H2O=SO+2H++2I- ③ ClO->I2>SO
提示:淀粉溶液变蓝的原因是溶液中存在I2,可由题目提供的反应物及产物中是否有I2,推断出反应的方程式.进一步来确定I2,ClO-,SO氧化性强弱。
20. 乙醇(C2H5OH)中碳元素平均为-2价,所以乙醇具有还原性,而K2Cr2O7具有强氧化性,硅胶是氧化剂载体,且具有吸附性.当司机饮酒后,口中呼出的气体中含有乙醇气体,乙醇遇到K2Cr2O7会发生氧化还原反应,其反应方程式为2K2Cr2O7+CH3CH2OH+8H2SO4=2K2SO4+2Cr2(SO4)3+2CO2+11H2O,由于K2Cr2O7被还原为正三价的铬,而产生明显的颜色改变.还原1 mol K2Cr2O7需要6 mol电子,所以当转移0.06 mol电子时,可还原的K2Cr2O7的物质的量为0.01 mol。
答案:酒后驾车 乙醇 0.01
21. (1)反应中Hg是还原剂,化合价由0价升高到+2,在反应产物Cu2HgI4中碘为-1价,由2x+2+(-1)×4=0 x=+1,即Cu元素显+1价。
(2)由所给反应知由CuI→Cu化合价从+1降到0,所从CuI为氧化剂。由
知每有4 mol CuI 参加反应,转移电子的物质的量为2 mol 当有1 mol CuI 参与反应时转移电子0.5 mol。
(3)用化合价升降法配平:
观察配平I-的化学计量数。
答案:(1)+1 (2)CuI 0.5 (3)2 5 2 1
22. 由于A为还原剂,氧化剂NaClO、NaClO3在酸性溶液中氧化能力增强知,A为FeSO4,B为H2SO4,则C一定为Fe2(SO4)3,反应的化学方程式如下:
NaClO+2FeSO4+H2SO4=NaCl+Fe2(SO4)3+H2O
NaClO3+6FeSO4+3H2SO4=NaCl+3Fe(SO4)3+3H2O
由上述反应知1 mol的NaClO3氧化FeSO4的物质的量为6 mol,而1 mol NaClO只氧化2 mol FeSO4,因而NaClO3合适。(2)由离子方程式:2Fe(OH)3+(5-n)ClO-+=2FeO+(5-n)Cl-+(n+3)H2O知2 mol Fe(OH)3共失去2(5-n) mol电子,所以有::=2 mol:2(5-n) mol n=2,在FeO中的Fe化合价为+6。(3)由铁及其化合物性质知:+6价的铁价态只能降低,故FeO可与SO2、H2S反应。
答案:NaClO+2FeSO4+H2SO4=NaCl+Fe2(SO4)3+H2O
NaClO3+6FeSO4+3H2SO4=NaCl+3Fe2(SO4)3+3H2O
由于NaClO31 mol可氧化6mol FeSO4,而NaClO 1mol只能氧化2 mol FeSO4故用NaClO3合适。
(1)2 5-n 2n 2 5-n n+3 (2)2 +6 (3)B C
第3课时 离子反应
考点要求:
1.离子共存问题是高考中的常见题型,是每年必考的题型。今后命题的发展趋势是:
(1)增加限制条件,如强酸性、无色透明、碱性、pH、甲基橙呈红色、发生氧化还原反应等;
(2)定性中有定量,如“由水电离出的c(H+)=1×10-4mol·L-1 的溶液中……”。
2.离子方程式的正误书写也是历年高考必出的试题。从命题的内容看,存在着三种特点:
(1)所考查的化学反应均为中学化学教材中的基本反应;错因大都属于化学式能否拆分、处理不当、电荷未配平、产物不合理和漏掉部分反应等;有量的限止的离子方程的书写或正误判断也是近几年考查的重点内容,也是这部分的难点。
(2)所涉及的化学反应类型以复分解反应为主,而溶液中的氧化还原反应约占15%;
(3)一些重要的离子反应方程式,在历年考卷中多次重复。如Na与H20的反应、Fe与盐酸或稀H2S04的反应自1992年以来分别考过多次。
(4)考查离子方程式的目的主要是了解学生使用化学用语的准确程度和熟练程度,具有一定的综合性,预计今后的考题还会保留。
重点、难点:
离子共存,离子方程式的正误判断是本节的重点内容;有量限止的离子方程式的书写或判断正误是本节的难点
基本概念:
1、离子反应、电解质、非电解质、离子方程式
(1)离子反应
定义:有离子参加的反应。
类型:
离子互换的非氧化还原反应:当有难溶物(如CaCO3 难电离物(如H20、弱酸、弱碱)以及挥发性物质(如 HCl)生成时离子反应可以发生。
离子间的氧化还原反应:取决于氧化剂和还原剂的相对强弱,氧化剂和还原剂越强,离子反应越完全
注意点:离子反应不一定都能用离子方程式表示。
如实验室制氨气 (NH4)2SO4 +Ca(OH)2 ?CaSO4+2NH3↑+2H2O
H2S气体的检验 Pb(AC)2+H2S=PbS↓+2HAc (注:Pb(AC)2可溶于水的盐的弱电解质)
(2)电解质、非电解质、强、弱电解质
电解质:在水溶液里或熔化状态下能够导电的化合物。
非电解质:在水溶液和熔化状态都不导电的化合物。
强电解质:在水溶液里全部电离成离子的电解质。
弱电解质:在水溶液里只有一部分分子电离成离子的电解质
强电解质与弱电解质的注意点
①电解质的强弱与其在水溶液中的电离程度有关,与其溶解度的大小无关。例如:难溶的BaS04、CaS03等和微溶的Ca(OH)2等在水中溶解的部分是完全电离的,故是强电解质。而易溶于水的CH3COOH、H3P04等在水中只有部分电离,故归为弱电解质。
②电解质溶液的导电能力的强弱只与自由移动的离子浓度及离子所带的电荷数有关,而与电解质的强弱没有必然的联系。例如:一定浓度的弱酸溶液的导电能力也可能比较稀的强酸溶液强。
③强电解质包括:强酸(如HCl、HN03、H2S04)、强碱(如NaOH、KOH、Ba(OH)2)和大多数盐(如NaCl、 MgCl2、K2S04、NH4C1)及所有的离子化合物;弱电解质包括:弱酸(如CH3COOH)、弱碱(如NH3·H20)、中强酸 (如H3PO4 ),注意:水也是弱电解质。
④共价化合物在水中才能电离,熔融状态下不电离
举例:KHSO4在水中的电离式和熔融状态下电离式是不同的。
(3)离子方程式:
定义:用实际参加反应的离子符号表示离子反应的式子
使用环境:离子程式在水溶液或熔融状态下才可用离子方程式表示
2、离子方程式的书写
(1)离子反应是在溶液中或熔融状态时进行时反应,凡非溶液中进行的反应一般不能写离子方程式,即没有自由移动离子参加的反应,不能写离子方程式。如 NH4Cl固体和Ca(OH):固体混合加热,虽然也有离子和离子反应,但不能写成离子方程式,只能写化学方程式。即:
2NH4Cl(固)+Ca(OH)2(固)=CaCl2+2H2O +2NH3 ↑
(2)单质、氧化物在离子方程式中一律写化学式;弱酸(HF、H2S、HCl0、H2S03等)、弱碱(如NH3·H20)等难电离的物质必须写化学式;难溶于水的物质(如CaC03、BaS03、FeS、PbS、BaS04,Fe(OH)3等)必须写化学式。如:
CO2+2OH-=CO32-+H2O CaC03+2H+=CO2↑+H20+Ca2+
(3)多元弱酸的酸式盐的酸根离子在离子方程式中不能拆开写。如NaHS03溶液和稀硫酸反应:HSO3- +H+=SO2↑+H2O
(4)对于微溶物的处理有三种情况;
①在生成物中有微溶物析出时,微溶物用化学式表示。如Na2S04溶液中加入AgNO3 ,溶液:2Ag++SO42-=Ag2S04 ↓
②当反应物里有微溶物处于溶液状态(稀溶液),应写成离子的形式。如C02气体通入澄清石灰水中:
CO2+Ca2++2OH-=CaCO3↓+H2O
③当反应物里有微溶物处于悬浊液或固态时,应写成化学式。如在石灰乳中加入Na2C03溶液:Ca(OH)2+CO32-=CaCO3↓+H2O 。
(5)操作顺序或反应物相对量不同时离子方程式不同,例如少量烧碱滴人Ca(HC03)2溶液[此时Ca(HCO3)2 过量],有
Ca2++HCO3-+OH-=CaCO3↓+H2O
少量Ca(HC03)2溶液滴人烧碱溶液(此时NaOH过量),有
Ca2++2OH-+2HCO3- =CaCO3↓+CO32- +2H2O
例1 碳酸氢钙溶液与过量氢氧化钠溶液混合,碳酸氢钙溶液与少量氢氧化钠溶液混合的化学方程式和离子方程式。
解答:当n(NaOH)>2nCa(HCO3)2时,NaOH过量
2NaOH+Ca(HCO3)2=CaCO3↓+Na2CO3+2H2O
2OH-+Ca2++2HCO3-=CaCO3↓+CO+2H2O
当n(NaOH)<2nCa(HCO3)2时,NaOH不足量
NaOH+Ca(HCO3)2=CaCO3↓+Na2CO3+H2O
OH-+Ca2++HCO3-=CaCO3↓+H2O
例2 在含有n mol FeBr2的溶液中,通入的Cl2的物质的量为x mol
(1)当x≤0.5n mol时的离子反应是 。
(2)当x≥1.5n mol时的离子反应是 。
(3)当x=n mol时的离子反应是 。
解答:了解离子反应类型,理解离子反应的实质,正确书写离子方程式,掌握离子反应规律。
(1)2Fe2++Cl2=2Fe3++2Cl- (2)2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
(3)2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
例3 在碘化钾溶液里滴加CuSO4溶液,可见无色溶液变为棕黄色,并有白色沉淀生成,表示这个反应的离子方程式是 。
解答:I-被Cu2+氧化为I2,Cu2+还原为Cu+,Cu+与溶液中的I-结合生成CuI
4I-+2Cu2+=2CuI↓+I2
第4课时 离子反应
3、离子共存问题
(1)“不共存”情况归纳
①离子之间相互结合呈沉淀析出时不能大量共存。如形成BaS04、CaS04、H2Si03、Ca(OH)2、MgS03、MgC03、 PbCl2、H2S04、Ag2S04等。
②离子之间相互结合呈气体逸出时不能大量共存,如:H+与S2-、HCO3-、SO32-、HSO3-和OH-与NH4+等,由于逸出H2S、C02、S02、NH3等气体或S2-变成HS-,CO32-变成HCO3-而不能大量共存。
③离子之间相互结合成弱电解质时不能大量共存。如:H+与CH3COO-、OH-、PO43-等离子,由于生成 CH3COOH、H20、HPO42-、H2PO4-、H3P04而不能大量共存。
④离子之间发生双水解析出沉淀或逸出气体时不能大量共存,如Al3+与AlO2-、Fe3+与HCO3- 、Al3+与HS- 、S2-、HCO3-、CO32-等离子。
⑤离子之间发生氧化还原反应时不能大量共存 Fe3+与I-、S2-、HS-;
MnO4-(H+)、NO3-(H+)、ClO-与Fe2+、I-、S2-、HS-、SO32-、HSO3-等
⑥离子之间相互结合成络离子时不能大量共存。如Fe3+与SCN-生成[Fe(SCN)]2+,Ag+、NH4+、OH-生成[Ag(NH3)2]+,Fe3+与C6H5OH也络合等
(2)离子在酸性或城性溶液中存在情况的归纳。
①某些弱碱金屑阳离子,如:Zn2+、Fe3+、Fe2+、 Cu2+、Al3+、NH4+、Pb2+、Ag+等。在水溶液中发生水解,有OH-则促进水解生成弱碱或难溶的氢氧化物。故上述离子可和H+(在酸性溶液中)大量共存,不能与OH-(在碱性溶液中)共存。但有NO3-存在时的酸性溶液, Fe2+等还原性离子不与之共存。
②某些弱酸的酸式酸根离子,如HCO3-、HS-等可和酸发生反应,由于本身是酸式酸根,故又可与碱反应,故此类离子与H+和OH-都不能共存。
③某些弱酸的阴离子,如:CH3COO- 、S2-、CO32-、 PO43-、AlO2-、SO32-、ClO- 、SiO32-—等离子在水溶液中发生水解,有H‘则促进其水解,生成难电离的弱酸或弱酸的酸式酸根离子。所以这些离子可和OH-(在碱性溶液中)大量共存,不能与H+(在酸性溶液中)大量共存。
④强酸的酸根离子和强碱的金属阳离子,如:Cl-、 Br- 、I-、SO42-、NO3-、K+、Na+等离子,因为在水溶液中不发生水解,所以不论在酸性或碱性溶液中都可以大量共存。但SO42-与Ba2+不共存。
⑤某些络离子,如[Ag(NH3)2]+,它们的配位体能与H+结合成NH3 [Ag(NH3)2]+ +2H+=Ag++ 2NH4+,所以,它们只能存在于碱性溶液中,即可与OH-共存,而不能与H+共存。
分析:“共存”问题,还应考虑到题目附加条件的影响,如溶液的酸碱性、PH值、溶液颜色、水的电离情况等。
[题型1]离子间因发生复分解反应(离子互换反应)而不能大量共存。
例1、下列各组离子在水溶液中能大量共存的是 (AC)
(A)K+ HCO3— CO32— Br— (B)CO32— HCO3— OH— K+
(C)Fe3+ Cu2+ NO3- SO42- (D)H+ Cl- Na+ SO32-
解析:分析所给选项B中:HCO3—+ OH—= CO32—+H2O;而D中:2H+ + SO32-= H2SO3
[题型2] 离子间因发生双水解反应而不能大量共存。
例2、某无色透明溶液,跟金属铝反应放出H2 ,试判断下列离子:Mg2+、Cu2+、 Ba2+ 、H+、Ag+、 SO42- 、 SO32-、HCO3- 、OH-、NO3- ,何者能存在于此溶液中
(1) 当生成Al3+时,可能存在__________;
(1) 当生成AlO2-时,可能存在__________。
解析: (1)说明溶液呈酸性:一则有H+ ,二必有SO42- ,三可能有Mg2+ (注意无NO3- );(2)说明溶液呈碱性:一则有OH- ,二必有Ba2+ ,三可能有NO3- 。
解题回顾:一是审题中注意溶液是无色的,二是注意H+、NO3-与Al作用不产生H2。
[题型3]:离子间因发生氧化还原反应而不能大量共存。
例3(2001年上海市高考题)下列离子在溶液中因发生氧化还原反应而不能大量共存的是(A)
(A)H3O+、 NO3- 、 Fe2+ 、 Na+ (B)Ag+、 NO3- 、Cl-、 K+
(C)K+ 、Ba2+、OH-、 SO42- (D)Cu2+、NH4+、Br-、OH-
解析:所给四个选项中各组离子均不能大量共存,只有A中的 H3O+ 、NO3- 、Fe2+三种离子因发生氧化还原反应符合题意。
点拨:抓住不能共存的条件——发生氧化还原反应。强强反应规律及中学常见强氧化剂、强还原剂的识记,是解决氧化还原应用问题(特别是隐含氧化还原反应问题)的关键,例如检验SO42-时不能用硝酸酸化,就是因为HNO3会使SO32-氧化为SO42- ,而干扰检验。
[题型4]在特殊条件下能够大量共存。
例4、下列各组离子中,在碱性溶液里能大量共存,并且溶液为无色透明的是(BD)
(A)K+ MnO4- Cl- SO42- (B)Na+ AlO2- NO3- CO32-
(C)Na+ H+ NO3- SO42- (D)Na+ SO42- S2- Cl-
解析:分析所给四个选项A中MnO4- 有颜色不合题意,C中H+ 也不合题材意。
例5下列各组离子中,在碱性溶液中共存,且加入盐酸过程中会产生气体和沉淀的是(C)
(A)Na+ NO3- AlO2- SO42- (B)Na+ NO3- SiO32- K+
(C)K+ Cl- AlO2- CO32- (D)Na+ Cl- HCO3- Ca2+
解析:分析所给四个选项:D中HCO3-不能在碱性溶液中大量存在,A和B中加入盐酸后无气体产生也不合题意。
例6、在含有I-且能使酚酞变红的无色溶液中,可大量存在的离子组是 ( D )
A.Na+、Cu2+、Br-、Cl- B.AlO2-、K+、NH4+、Na+
C.K+、Na+、NO3-、H+ D.K+、S2-、SO42-、OH-
解析:首先理解附加条件:I-不能在强氧化性溶液中存在,使酚酞变红的溶液为碱性,溶液为无色,有色离子不存在。逐一省视各选项:选项A 中Cu2+为蓝色且在碱性溶液中不共存。选项B中NH4+在碱性溶液中不共存。选项C中溶液具有强氧化性,I-不能共存。
课后练习
1.(2003·江苏)若溶液中由水电离产生的=1×10—14mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是(B )
A. Al3+ 、Na+ 、NO3-、Cl- B. K+ 、Na+、Cl-、NO3-
C. K+ 、Na+ 、Cl-、AlO2- D. K+ 、 NH4+、SO32-、NO3-
2.(2005年江苏高考化学试题)某溶液既能溶解AI(OH)3,又能溶解H2SiO3,在该溶液中可以大量共存的离子组是(B)
A.K+、Na+、HCO3-、NO3- B.Na+、SO42-、Cl-、ClO-
C.H+、Mg2+、SO42-、NO3- D.Ag+、K+、NO3- 、Na+
3、下列各组离子在溶液中不能大量共存,且加入过量NaOH溶液或过量稀盐酸均能得到澄清溶液的是 (BD)
A. Fe3+、CI-、Na+、SO42- B. AI3+、Na+、CO32-、NO3-
C. Ag+、Na+、SO42-、NO3- D. AIO2-、CO32-、K+、Na+
4.某能使石蕊试液变红的溶液中,能大量存在的离子是(A)
A.Al3+ NH4+ SO42- CI- B.Na+ Mg2+ HCO3- NO3-
C.K+ Na+ AlO2- Cl- D.Fe2+ K+ NO3- Cl-
5.在pH=0的无色透明溶液中,因发生氧化还原反应而不能大量共存的离子组是( BD )
A.Na+、K+、MnO4—、Cl— B.Cl—、S2O32—、K+、Na+
C.Na+、Cl—、CH3COO—、K+ D.K+、I—、Na+、ClO—
6.常温下测得某无色溶液中由水电离出的H+浓度为1×10—13mol/L,又知该溶液中还有NO-3,Na+,Cl-,那么该溶液中还一定存在的离子是 (D )
A.AlO2—、ClO— B.Mg2+、、SO42— C.Fe2+ 、Cu2+ D.Ba2+、K+
7、下列各组离子中,在碱性溶液中共存,且加入盐酸过程中会产生气体和沉淀的是(C)
(A)Na+ NO3- AlO2- SO42- (B)Na+ NO3- SiO32- K+
(C)K+ Cl- AlO2- CO32- (D)Na+ Cl- HCO3- Ca2+
8.某溶液滴入甲基橙显红色,在这种溶液中能大量共存的离子是(A)
A.Mg2+、K+、Br-、SO42— B.S2O32—、Na+、H+、Cl-
C.Ca2+、K+、ClO-、I- D.Al3+、K+、AlO3—、Cl-
9.在加入少量Al(OH)3能溶解的溶液中,加入下列各组离子,有可能在溶液中大量共存的是( BD)
A.NH4—、Na+、HCO3—、ClO- B.K+、ClO4—、NO3—、SO42—
C.Ca2+、Fe2+、Cl-、NO3— D.Na+、AlO2-、SO32—、S2-
10.在pH=0的溶液中,下列各组中的离子因发生氧化还原反应而不能大量共存的是(CD)
A.Ag+、Ca2+、NO3—、HCO3— B.SO32—、SO42—、Na+、Mg2+
C.Fe2+、K+、NO3—、Cl- D.K+、S2O32—、SO42—、Na+
11.某无色透明溶液中,由水电离出来的c(H+)=1×10-13 mol·L-1,在该溶液中一定能够大量共存的离子组是(B)
A.K+、Na+、MnO4—、NO3— B.K+、Na+、Cl-、NO3—
C.NH4+、AlO2-、Na+、CH3COO- D.Fe3+、S2-、Al3+、HCO3—
12.下列各离子组的叙述正确的是(BC)
A.在强酸性条件下Na+、I+、K+、可以大量共存
B.在强碱性条件下K+、AlO2-、Na+、S2-、NO3—可以大量共存
C.在水溶液中H+、NH4+、SiO32—、Cl-不能大量共存
D.在强酸性条件下NH4+、K+、SO32—、S2-可以大量共存
13.对下列各组离子的叙述不正确的是(BC)
A.H+、AlO2—、Ba2+、HCO3—不能在水中大量共存
B.Mg2+、NH4+、Fe2+、NO3—能在酸性溶液中大量共存
C.Fe3+、K+、SCN-、Cl-能大量共存且使溶液显红色
D.Na+、NO3—、CO32—、AlO2—能在碱性溶液中大量共存
第5课时 与试剂用量有关的离子反应
离子方程式的正确书写是高中化学教学中的重点内容之一。有很多反应因试剂用量不同而离子方程式不同,这部分知识构成了高中化学教学中的一个难点。但只要我们仔细分析,就会从中找出一些规律。
一、碱溶液与酸性氧化物的反应:
Ca(OH)2溶液、Ba(OH)2溶液、KOH溶液、NaOH溶液等碱溶液与CO2、SO2等酸性氧化物反应时若酸性氧化物用量不同则离子方程式不同。例如:
Ca(OH)2溶液和CO2反应时有:Ca2++2OH-+CO2=CaCO3↓+H2O(CO2少量) CO2+OH-=HCO3-(CO2足量)
NaOH溶液和SO2反应时有:2OH-+SO2=SO32-+H2O(SO2少量) OH-+SO2=HSO3-(SO2足量)
二、多元酸酸式盐与碱溶液生成沉淀的反应:
NaHCO3溶液、NaHSO3溶液、NaH2PO4溶液、Na2HPO4溶液、NaHSO4溶液分别与Ba(OH)2溶液、Ca(OH)2溶液反应或Ca(HCO3)2溶液、Ba(HCO3)2溶液与NaOH溶液、KOH溶液等反应时若试剂用量不同则离子方程式不同。例如:
Ca(HCO3)2溶液和NaOH溶液反应时有:
Ca2++HCO3-+OH-=CaCO3↓+H2O(NaOH少量) Ca2++2HCO3-+2OH-=CaCO3↓+ CO32-+2H2O(NaOH足量)
NaHSO4溶液与Ba(OH)2溶液反应时有: H++SO42-+Ba2++OH-=BaSO4↓+H2O(NaHSO4少量)
2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O(NaHSO4足量)
三、碳酸盐溶液与H+的反应:
Na2CO3溶液、K2CO3溶液与HCl溶液、HNO3溶液、NaHSO4溶液反应或Ba(HCO3)2溶液与NaHSO4溶液反应时若试剂用量不同则离子方程式不同。例如:
Na2CO3溶液与HCl溶液时有: CO32-+H+=HCO3-+H2O(HCl少量) CO32-+2H+=CO2↑+H2O(HCl足量)
Ba(HCO3)2溶液与NaHSO4溶液反应时有:
Ba2++HCO3-+H++SO42-= BaSO4↓+CO2↑+H2O(NaHSO4少量) Ba2++2HCO3-+2H++SO42-= BaSO4↓+2CO2↑+2H2O(NaHSO4足量)
四、氧化还原反应:
在氧化还原反应中,还原能力强的优先被氧化。例如在FeBr2溶液中通入Cl2时,因为Fe2+的还原能力比Br- 强,因此,当通入少量的Cl2时反应为:Fe2++Cl2=Fe3++2Cl-;当通入足量的Cl2时反应为:2Fe2++4Br-+3Cl2=2Fe3++6Cl-+4Br2。
五、多元弱酸或中强酸与碱溶液的反应:
多元弱酸或中强酸与碱溶液反应时当碱的用量不同时,酸中的H+被中和的程度不同而生成不同的盐。例如H3PO4溶液和NaOH溶液反应时:
当H3PO4和NaOH的物质的量之比为1﹕1时反应为: H3PO4+OH-=H2PO4-+H2O
当H3PO4和NaOH的物质的量之比为1﹕2时反应为:H3PO4+2OH-=HPO42-+2H2O
当H3PO4和NaOH的物质的量之比为1﹕3时反应为:H3PO4+3OH-=PO43-+3H2O
六、与铝有关的离子反应:
⑴Al3+ 和OH-的反应:Al3++3OH-=Al(OH)3↓(OH-少量) Al3++4OH-=AlO2-+2H2O(OH-足量)
⑵AlO2- 和 H+反应:AlO2-+ H++H2O=Al(OH)3↓(H+少量) AlO2-+ 4H+ =Al3++2H2O (H+足量)
⑶KAl(SO4)2和Ba(OH)2反应:
2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓[Ba(OH)2少量]
Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓[Ba(OH)2足量]
七、NH4+ 和OH- 的反应:
NH4+和OH-的反应因溶液的浓度不同而有不同的离子反应:
NH4++OH-=NH3↑+H2O(浓溶液) NH4++OH-=NH3 H2O(稀溶液)
八、漂白粉溶液和CO2的反应:
漂白粉溶液和CO2的反应因CO2的量不同而有不同的离子反应:
Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO(CO2少量) ClO-+CO2+H2O=HCO3-+HClO(CO2足量)
九、氨水与AgNO3溶液、CuSO4溶液的反应:
氨水与AgNO3溶液、CuSO4溶液反应时因氨水的用量不同有不同的离子反应。氨水少量时生成沉淀,足量或稍过量时生成络离子。
例如:2NH3 H2O+Cu2+=Cu(OH)2↓+2NH4+(氨水少量) 4NH3 H2O+Cu2+=[Cu(NH3)4]2++4H2O(氨水足量)
第6课时 化学反应中的能量变化
高考分析:反应热在教材中的篇幅较少,高考内容主要包括:
1.书写热化学方程式或判断热化学方程式的正误;
2.有关反应热的计算;
3.比较反应热的大小
最近又出现反应热与能源结合起来进行考查。由于能源问题已成为社会热点,有关能源的试题也将成为今后命题的重点:预计考查反应热的内容将不断拓宽,难度有所提高,题型也会有新的变化。由于反应热与物理学中的“热”、生物学生态系统中的“能量传递”又有密切联系,有关能量的学科间的综合将会成为“3+X”理科综合命题的热点。
知识框架
1、化学反应的能量
2、反应热的知识结构:
知识点拨
一、概念
1.化学反应及其能量变化
任何一个化学反应中,反应物所具有的总能量与生成物所具有的总能量总不会相等的。在新物质产生的同时总是伴随着能量的变化。
2.放热反应和吸热反应
(1)放热反应:即有热量放出的化学反应,其反应物的总能量大于生成物的总能量。
(2)吸热反应:即吸收热量的化学反应,其反应物的总能量小于生成物的总能量。
3.化学反应中的能量变化示意图对于该“示意图”可理解为下列形式:
由能量守恒可得:
反应物的总能量:生成物的总能量+热量(放热反应)
反应物的总能量:生成物的总能量-热量(吸热反应)
4.燃料充分燃烧的两个条件
(1)要有足够的空气
(2)燃料与空气要有足够大的接触面。
热化学方程式与普通化学方程式的区别有三点不同
1.热化学方程式必须标有热量变化。
2.热化学方程式中必须标明反应物和生成物的状态,因为反应热除跟物质的量有关外,还与反应物和生成物的聚集状态有关。
3.热化学方程式中各物质的系数只表示各物质对应的物质的量,因此,有时可用分数表示,但要注意反应热也发生相应变化。
书写热化学方程式时明确以下问题:
(1)反应放出或吸收的热量的多少与外界的温度和压强有关,需要注明,不注明的指101kPa和25℃时的数据。
(2)物质的聚集状态不同,反应吸收和放出的热量不同,因此要注明反应物和生成物的聚集状态。
(3)热化学方程式中的热量数据,是与各化学计量数为物质的量时相对应的,不是几个分子反应的热效应。因此式中化学计量数可以是整数,也可以是分数。一般出现分数时是以某一反应物或生成物为“1mol”时其它物质才出现的。
(4)无论热化学方程式中化学计量数为多少,△H的单位总是KJ/mol,但△H的数值与反应式中的系数有关。
二、燃烧热、中和热
1.燃烧热
(1)概念:在101kPa时,1mol物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。燃烧热的单位一般用kJ/mol表示。
注意:完全燃烧,是指物质中下列元素完全转变成对应的物质:C→C02,H→H20,S→S02等。
(2)表示的意义:例如C的燃烧热为393.5kJ/mol,表示在101kPa时,1molC完全燃烧放出393.5kJ的热量。
2.中和热
(1)概念:在稀溶液中,酸跟碱发生中和反应而生成 1 molH20,这时的反应热叫中和热。
(2)中和热的表示:H+(aq)+OH-(aq)=H2O (1); △H=-57.3kJ/mol。
3.使用化石燃料的利弊及新能源的开发
(1)重要的化石燃料:煤、石油、天然气
(2)煤作燃料的利弊问题
①煤是重要的化工原料,把煤作燃料简单烧掉太可惜,应该综合利用。
②煤直接燃烧时产生S02等有毒气体和烟尘,对环境造成严重污染。
③煤作为固体燃料,燃烧反应速率小,热利用效率低,且运输不方便。
④可以通过清洁煤技术,如煤的液化和气化,以及实行烟气净化脱硫等,大大减少燃煤对环境造成的污染,提高煤燃烧的热利用率。
(3)新能源的开发
①调整和优化能源结构,降低燃煤在能源结构中的比率,节约油气资源,加强科技投入,加快开发水电、核电和新能源等就显得尤为重要和迫切。
②最有希望的新能源是太阳能、燃料电池、风能和氢能等。这些新能源的特点是资源丰富,且有些可以再生,为再生性能源,对环境没有污染或污染少。
理解中和热时注意:
①稀溶液是指溶于大量水的离子。②中和热不包括离子在水溶液中的生成热、电解质电离的吸热所伴随的热效应。③中和反应的实质是H+和OH-化合生成 H20,若反应过程中有其他物质生成,这部分反应热也不在中和热内。
三、中和热测定实验:
在50 mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在下图装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。试回答下列问题。
(1)大小烧杯间填满碎纸条的作用是什么?
(2)大烧杯上如不盖硬纸板,对求得中和热的数值有何影响
(3)改用60 mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液进行反应,与上述实验相比,所放热量是否相等 所求中和热数值是否相等?简述理由。
(4)用相同浓度和体积的氨水代替氢氧化钠溶液进行上述实验,为什么测得中和热的数值偏低?
例题1.(06年浙江湖州)下列各图中,表示正反应是吸热反应的是( )
2.(06年南师大附中)“摇摇冰”是一种即用即冷的饮料。吸食时将饮料罐隔离层中的化学物质和水混合后摇动即能制冷。该化学物质是( )
A.氯化钠 B.生石灰 C.氢氧化钠 D.硝酸铵
3.(06年重庆)下列热化学方程式中的ΔH能表示物质燃烧热的是( )
A. 2 CO(g) + O2(g) = 2 CO2(g) ΔH = - 566 KJ·mol-1
B. CH4(g) + 2 O2(g) = CO2(g) + 2 H2O(l) ΔH = - 890 KJ·mol-1
C. 2 H2(g) + O2(g) = 2 H2O(l) ΔH = - 571.6 KJ·mol-1
D. H2(g) + Cl2(g) = 2 HCl(g) ΔH = - 184.6 KJ·mol-1
4.(06年湖南简阳)已知H+(aq) + OH-(aq) = H2O(l) ΔH = - 57.3 kJ·mol-1。以下四个化学反应方程式:
① H2SO4(aq) +2 NaOH(aq) = Na2SO4(aq) + 2 H2O(l);
② H2SO4(aq) + Ba(OH)2(aq) = BaSO4(s) + 2 H2O(l);
③ HCl(aq) + NH3 H2O(aq) = NH4Cl(aq) + H2O(l);
④ CH3COOH(aq) + NH3 H2O(aq) = CH3COONH4(aq) + H2O(l)。
其中反应热为57.3 kJ·mol-1的是( )
A.①和② B.③ C.④ D.以上都不对
4.(06年天津)已知:H+ (aq)+OH- (aq)= H2O △H1 = - 57.3 kJ·mol-1,
H2SO4(浓)+ NaOH(aq)=Na2SO4(aq)+ H2O(l) △H2 = m,下列说法正确的是( )
A.上述热化学方程式中的计量数表示分子个数 B. △H1>△H2
C.△H2 = - 57.3 kJ·mol-1 D. |△H1|>|△H2|
6.(06年湖南石门)在下列各说法中,正确的是
A.△H > 0表示放热反应,△H < 0表示吸热反应
B.热化学方程式中的化学计量数只表示物质的量,可以是分数
C.1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热
D.1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热
11.(06年江苏淮阴)据《参考消息》报道,有科学家提出硅是“21世纪的能源”、“未来的石油”的观点。假如硅作为一种普遍使用的新型能源被开发利用,关于其有利因素的下列说法中,你认为不妥当的是
A.硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料
B.硅的来源丰富,易于开采,且可再生
C.硅燃烧放出的热量大,且燃烧产物对环境污染程度低,容易有效控制
D.寻找高效新催化剂,使硅的生产耗能很低,是硅能源开发利用的关键技术
7.(06年南开中学)已知31 g 白磷变成红磷放出 18.39 kJ 热量,下列两反应中:
P4(s)+ 5 O2(g)= 2 P2O5(s),△H = Q1 kJ·mol-1
4 P(红,s)+ 5 O2(g)= 2 P2O5 (s),△H = Q2 kJ·mol-1
则下列说法中正确的是( )
A.Q1 > Q2,白磷比红磷稳定 B.Q1 > Q2,红磷比白磷稳定
C.Q1 < Q2,白磷比红磷稳定 D.Q1 < Q2,红磷比白磷稳定
9.(06年广东惠州)根据热化学方程式:S(s) + O2(g)= SO2(g) △H = -297.23 kJ·mol-1,下列说法正确的是:
A.1 mol SO2 (g)的能量总和大于1 mo S(s)和1 mol O2(g)的能量总和
B.1 mol SO2(g)的能量总和小于1 mol S(s)和1 mol O2(g)的能量总和
C.S(g) + O2(g) = SO2(g) △H = -Q kJ·mol-1;Q的值大于297.23
D.S(g) + O2(g)= SO2(g) △H = -Q kJ·mol-1;Q的值等于297.23
10.(06年江苏东海)工业由粗硅制取纯硅有以下反应:
①Si(s) + 3 HCl(g)SiHCl3(g) + H2(g);△H = -318 kJ·mol-l
②SiHCl3(g) + H2(g)Si(s) + 3 HCl(g);
下列关于上述反应的说法中不正确的是
A.反应①、②均为氧化还原反应 B.反应①、②均为置换反应
C.若反应①放热,则反应②一定吸热 D.欲提高SiHCl3产率,可减压或升温
1.(06年广东深圳)1840年前后,俄国科学家盖斯(Hess)指出,一个化学反应的热效应,仅与反应物的最初状态及生成物的最终状态有关,而与中间步骤无关,这就是著名的“盖斯定理”。现已知,在101 KPa下,CH4(g)、H2(g)、C(s)的燃烧热分别为890.83 kJ·mol-1、285.83 kJ·mol-1和393.51 kJ·mol-1,则反应C(s) + 2 H2(g) = CH4(g)的反应热△H =____,根据以上信息,你认为“盖斯定理”在我们确定一些化学反应的反应热时有何重要意义_________________________。
12.(06年东阳)已知:2 H2(g) + O2(g) = 2 H2O(g) △H1;
2 H2(g) + O2(g) = 2 H2O(l) △H2;
2 CO(g) + O2(g) = 2 CO2(g) △H3。
⑴ 写出液态水转化为气态水的热化学方程式 。
⑵ CO和H 2分别燃烧生成CO2(g)和H 2O(g),欲得到相同热量,所需CO和H 2的体积比是 。
13.(06年安徽宿迁)在化学反应中,只有
极少数能量比平均能量高得多的反应物分子发生
碰撞时才可能发生化学反应,这些分子被称为活
化分子。使普通分子变成活化分子所需提供的最
低限度的能量叫活化能,其单位通常用kJ·mol-1
表示。请认真观察右图,然后回答问题。
(1)图中所示反应是________(填“吸热”
或“放热”)反应,该反应_______(填“需要”或“不需要”)加热,该反应的△H =________
(用含E1、E2的代数式表示)。
(2)已知热化学方程式:H2(g)+ O2(g) = H2O(g) △H = - 241.8 kJ·mol-1,该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为____________________。
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子百分数增多,反应速率加快,你认为最可能的原因是_________________________。
答案A, D ,B ,D ,B ,B ,D ,D ,BC ,D
11:△H = - 74.81 kJ·mol-1;对于一些很难用实验方法直接测定热量的化学反应的反应热可以用“盖斯定理”间接测定。
解析:CH4(g)、H2(g)、C(s)在101 KPa下燃烧的热化学方程式分别为:
① CH4(g) + 2 O2(g) = CO2(g) + 2 H2O(l),ΔH1= -890.36 kJ·mol-1
② H2(g) +O2(g) = 2 H2O(l),ΔH2 = -285.83 kJ·mol-1
③ C(s) + O2(g) = CO2(g),ΔH3 = -393.51 kJ·mol-1
根据“盖斯定理”,③ + ② × 2 - ① 得:
④ C(s) + 2 H2(g) = CH4(g),ΔH = ΔH3 + 2 ΔH2–ΔH1 = -74.81 kJ·mol-1
12 ⑴ H2O(l) = H2O(g); ⑵
13 (1)放热; 需要; -(E1 - E2) kJ·mol-1
(2)409 kJ·mol-1; (3)使用了催化剂。
能量变化
化学能转化为热能
放热反应
吸热反应
类型
反应物的总能量大于生成物的总能量
反应物的总能量小于生成物的总能量
遵循能量守恒原理
能量利用
燃料充分燃烧
新能源的开发
减少污染
化学反应中的能量的变化
反应热
含义
与键能的关系
表示方法
种类
单位:kJ/mol
符号:△H
燃烧热
中和热
热化学方程式
意义
书写方法
有关计算
能量
反应过程
反应过程
反应物
生成物
能量
△H<0
△H>0
反应物
生成物
反应过程
能量
(kJ/mol)
反应物
分子
生成物
分子
活化
分子
反应物的
总能量(E1)
生成物的
总能量(E2)
(Ⅰ)
(Ⅱ)
活化分子的最低能量
20
高三总复习 第一讲 氧化还原反应
一. 重点、难点:
1. 理解氧化剂和还原剂、氧化性和还原性等概念。
2. 能判断氧化还原反应中电子转移的方向和数目。
二. 具体内容:
(一)概念及实质
1. 概念:发生电子转移(得失或偏移)的反应。
2. 实质:发生电子转移。
3. 判断:有化合价升降。
反应物 化合价变化 表现性质 变化过程 发生反应 生成物
氧化剂还原剂 降低 升高 氧化性 还原性 被还原 被氧化 还原反应 氧化反应 还原产物 氧化产物
(二)元素的化合价
元素原子的最外电子层结构决定了原子间是按一定数目相互化合,元素的原子相互化合的数目叫这种元素的化合价。
1. 单质中元素的化合价为0;
2. 在化合物中金属元素的化合价全为正值,非金属元素的化合价一般既有负值又有正值;
3. 在化合物中,各元素的正、负化合价的代数和为0;
如:原子团的化合价:NO3-、SO42-、SO32-、HSO3-(亚硫酸氢根)、CO32-、
HCO3-、ClO3-(氯酸根)、NH4+(铵根)、MnO4-(高锰酸根)、PO43-(磷酸根)。
中心元素的化合价:
4. 离子化合物中,元素的化合价与在生成它们的反应中原子得、失电子数目及离子的电荷数在数值上相等,如NaCl:
离子符号 原子得、失电子数 离子的电荷数 元素的化合价
Na+ 1(失) 1 +1
Cl- 1(得) 1 -1
共价化合物中,元素的化合价与在生成它们的反应中共用电子对的偏向、偏离的对数在数值上相等。如HCl:
共用电子对偏向氯原子,氯元素化合价为-1价;共用电子对偏离氢原子,氢元素化合价为+1价。
5. 有机物中:H:+1、O:,再计算C元素平均化合价。
(三)氧化还原反应中电子转移的表示方法
双线桥法
1. 双箭号从反应物指向生成物,箭号起止所指的均为同一种元素。
2. 线上标出得失电子的情况及价的升降、被氧化或被还原等内容。
氧化剂为Fe2O3,还原剂为CO,氧化产物为CO2,还原产物为Fe。
氧化剂为HCl,还原剂为Zn,氧化产物为ZnCl2,还原产物为H2。
单桥线法
1. 箭号由还原剂中失电子的元素指向氧化剂中得电子的元素;
2. 线上只标出转移电子的总数。
(四)氧化还原反应的规律
1. 对立统一规律
还原剂、氧化剂相互对立又相互依存。
2. 电子守恒规律
还原剂失电子总数=氧化剂得电子总数
3. 性质传递规律
氧化剂+还原剂=还原产物+氧化产物
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
4. 谁强谁先规律
在溶液中存在多种氧化剂,氧化性强的抢先得电子,先被还原。
在溶液中存在多种还原剂,还原性强的抢先失电子,先被氧化。
5. 价态规律
(1)高低规律:
最高价态——只具氧化性
最低价态——只具还原性
中间价态——兼有氧化性和还原性
讨论分析下列氧化还原反应中电子转移的方向和数目,判断氧化产物和还原产物。
① H2S+H2SO4(浓)=S↓+SO2↑+2H2O
② KClO3+6HCl=KCl+3Cl2↑+3H2O
(2)价态归中规律:
同种元素不同价态之间发生氧化还原反应时,价态的变化“只靠拢,不交叉”。
(五)重要的氧化剂、还原剂
氧化剂 具体物质 举例
(1)活泼非金属单质 O3、Cl2、Br2、O2
(2)高价的氧化物 NO2、CO2、MnO2
(3)高价的含氧酸 HClO、浓H2SO4、HNO3
(4)高价的盐 KMnO4、KClO3、FeCl3 2FeCl3+Cu=2FeCl2+CuCl2
(5)过氧化物 Na2O2、H2O2等
还原剂 具体物质 举例
(1)活泼金属单质 Na、Al、Zn、Fe
(2)某些非金属单质 H2、C、Si
(3)低价的氧化物 CO、SO2
(4)低价的酸 HCl、H2S、H2SO3
(5)低价的盐 Na2SO3、FeCl2 2FeCl2 + Cl2 = 2FeCl3
【典型例题】
[例1](2002年上海理综,16)人体血红蛋白中含有Fe2+,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+离子转变成Fe3+,生成高铁血红蛋白而丧失与O2结合的能力.服用维生素C可缓解亚硝酸盐的中毒,这说明维生素C具有( )
A. 酸性 B. 碱性 C. 氧化性 D. 还原性
解析:亚硝酸盐会使Fe2+转变成Fe3+.表现了亚硝酸盐的氧化性,服用维生素C可缓解亚硝酸盐的中毒,说明维生素C还原了亚硝酸盐或使Fe3+又生成了Fe2+,即:维生素C具有还原性。
答案: D
思考:维生素C和Fe2+都具有还原性,二者相比较还原性较强的是_______________?
答案: 维生素C的还原性比Fe2+强.因为维生素C能将Fe3+还原为Fe2+,而Fe2+则不能。(也可根据同一氧化还原反应中,还原剂维生素C的还原性比还原产物Fe2+的还原性强进行分析判断)
[例2](2002年上海23)在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质.
(1)某厂废水中含KCN,其浓度为650 mg/L.现用氯氧化法处理,发生如下反应(其中N均为价):KCN+2KO+Cl2=KOCN+2KCl+H2O。被氧化的元素是______。
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气.请配平下列化学方程式,并标出电子转移方向和数目:KOCN+KOH+Cl2——CO2+N2+KCl+H2O
(3)若处理上述废水20 L,使KCN完全转化为无毒物质.至少需液氯_______g。
解析:此题以污水处理为知识背景,考查了氧化还原的概念、氧化还原方程式的配平及氧化还原反应的计算。
(1)在KCN+2KOH+Cl2=KOCN+2KCl+H2O反应中,氯元素价态降低,H、N、O、K四种元素的价态没变,只有碳元素的价态升高,故被氧化的为碳元素。
(2)氧化还原方程式的配平,首先要找准变价元素,再利用化合价升降法配平,反应物KOCN中N的价态升高,KOCN为还原剂,氯气为氧化剂。
(3)20 L废水中含KCN的物质的量为:=0.2 mol,由两步反应的化学方程式得出关系式:2KCN~5Cl2,所以需氯气:0.2 mol×=0.5 mol,即35.5 g。
答案:(1)碳(或C)
思考:在化学反应KCN+2KOH+Cl2KOCN+2KCl+H2O中,氧化剂是___________________________;还原剂是_________________________;氧化产物是_________________;还原产物是__________________。
答案: Cl2 KCN KOCN KCl
[例3](2001年上海,23)化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如:
(1)在上述有编号的步骤中,需用还原剂的是_______________________需用氧化剂的是__________________(填编号)。
(2)在上述循环中,既能与强酸反应又能与强碱反应的两性物质是____________(填化学式)。
(3)完成并配平步骤①的化学方程式,标出电子转移的方向和数目:
解析:(1)在①变化中,Cr元素由+6价变为+3价,化合价降低,需还原剂;②③两步变化中Cr元素的价态都是+3价,⑤步变化中Cr元素的价态都是+6价,②③⑤都是非氧化还原反应;在④步变化中,Cr元素由+3价变为+6价,化合价升高,需要氧化剂。
(2)Cr(OH)3既能与盐酸反应生成CrCl3,又能与NaOH反应生成NaCrO2,为两性氢氧化物。
(3)此小题考查了化学方程式的配平方法.先找出该反应的氧化剂、还原剂及氧化产物、还原产物,并配出其化学计量数;再由原子守恒配出NaCl、KCl的计量数,最后补充H2O,并配平其计量数。
答案:(1)① ④ (2)(3)1 6 14 2 2 6 3 7 H2O
思考:写出两性氢氧化物Cr(OH)3分别与盐酸、氢氧化钠反应的化学方程式.
答案:Cr(OH)3+3HCl=CrCl3+3H2O
+NaOH=NaCrO2+2H2O
[例4] 1962年,英国青年化学家以巴特莱特将PtF6和Xe按等物质的量在室温下混合后,首次得到含有化学键的稀有气体化合物六氟合铂酸氙:Xe+PtF6=XePtF6。有关此反应的叙述中,正确的是( )
A. Xe是氧化剂
B. PtF6是氧化剂
C. PtF6是氧化剂又是还原剂
D. 该反应不属于氧化还原反应
解析:关键确定XePtF6中各元素的价态,须破除Xe只有0价的思维定势,由于F元素是最活泼的非金属元素,故为-1价,但F不会表现出氧化性.而Pt在PtF6中处于较高价态具备氧化性,故Xe表现还原性,失去电子.
答案:B
[例5] 三聚氰酸C3N3(OH)3可用于消除汽车尾气中的氮氧化物(如NO2)。当加热至一定温度时,它发生如下分解:
C3N3(OH)3=3HNCO
HNCO(异氰酸,其结构是H—N=C=O)能和NO2反应生成N2、CO2和H2O。
(1)写出HNCO和NO2反应的化学方程式.分别指明化合物中哪种元素被氧化 哪种元素被还原 指出氧化剂和还原剂,标出电子转移的方向和数目。
(2)如按上述反应式进行反应,试计算吸收1.0 kg NO2气体所消耗的三聚氰酸的质量。
解析:应首先判断HNCO中N的化合价为-3价,然后才可写出方程式.HNCO的→,故其中氮元素被氧化;NO2中→,其中氮元素被还原.这个问题明确后,其他问题就简单了。
答案:
(1)
NO2是氧化剂、HNCO是还原剂;
HNCO中的氮元素被氧化,NO2中的氮元素被还原。
(2)1.0 kg×=1.2 kg
高三总复习 第二讲 氧化还原反应
一. 重点、难点
1 掌握比较氧化性、还原性强弱的一般方法。
2. 掌握配平氧化还原反应方程式的基本方法
二 具体内容
(六)氧化性、还原性强弱的判断方法
1. 金属、非金属性
(1)随着金属活动顺序表中金属活动性的减弱,金属的还原性越来越弱,其对应离子的氧化性越来越强.(除Fe3+外)
还原性逐渐减弱
氧化性逐渐增强
(2)对于非金属单质
氧化性逐渐减弱
还原性逐渐增强
2. 氧化还原反应的性质传递规律
则:还原性:H2>Cu
3. 根据元素周期律判断
(1)同周期
氧化性:左<右 还原性:左>右
(2)同主族
氧化性:上>下 还原性:上<下
4. 根据反应结果判断
(1)同一物质在相同条件下,被不同氧化剂氧化的程度越大,氧化剂的氧化性越强。
Fe+S=FeS
2Fe+3Cl2=2FeCl3
(2)同一物质在相同的条件下,被不同还原剂还原得越彻底,还原剂的还原性越强
HCl+H2SO4(浓)→不反应
HBr+H2SO4(浓)→Br2+SO2↑+H2O
HI+H2SO4(浓)→I2+H2S↑+H2O
5. 根据电极反应确定
(1)原电池 还原性:负极>正极
(2)电解池 阴极(氧化性):先析出>后析出
阳极(还原性):先反应>后反应
6. 从反应所需条件来比较。一般来讲,一组反应中,反应条件越简单,对应反应物的氧化性或还原性越强。
从反应条件可以看出氧化剂的氧化能力:KMnO4>MnO2>O2
7. 外界条件对氧化性或还原性强弱的影响(同一物质在不同条件下的氧化性或还原性)
(1)物质的浓度越高,氧化性或还原性越强。
(2)温度越高,氧化性或还原性越强。
(3)酸性越强,氧化性越强;碱性越强,还原性越强。
【典型例题】
[例1] 常温下,在下列溶液中发生如下反应
① 16H++10Z-+2XO=2X2++5Z2+8H2O
② 2A2++B2=2A3++2B-
③ 2B-+Z2=B2+2Z-
由此判断下列说法错误的是( )
A. 反应Z2+2A2+=2A3++2Z-可以进行
B. Z元素在①③反应中均被还原
C. 氧化性由强到弱的顺序是XO、Z2、B2、A3+
D. 还原性由强到弱的顺序是A2+、B-、Z-、X2+
解析:根据有关规律,在同一反应中,氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性,可得出( )
氧化性:XO>Z2>B2>A3+
答案: B
[例2] 从下列各组反应对比中,判断哪种粒子的氧化性最强,哪种粒子的还原性最强.
(1)铁钉浸入CuSO4溶液后,表面会附有红色物质;铜丝浸入AgNO3溶液后,表面会附有银白色物质,则Cu、Fe、Ag中,___________原子还原性最强;Cu2+、Fe2+、Ag+中,_______________离子氧化性最强。
(2)铁钉在氯气中被锈蚀成棕褐色物质FeCl3,而在盐酸中生成淡绿色溶液(FeCl2)。则氯气分子、氯离子、氢离子中_____________具有氧化性,___________氧化性最强。
解析:(1)由反应Fe+Cu2+=Fe2++Cu可知氧化性Cu2+>Fe2+,还原性Fe>Cu;由Cu+2Ag+=2Ag+Cu2+可知,氧化性Ag+>Cu2+,还原性Cu>Ag,故Fe的还原性最强,Ag+氧化性最强。
(2)因Cl2、H+都能将铁氧化,被还原为Cl-、H2,所以Cl2、H+具有氧化性;由Fe被Cl2、H+氧化的程度可知,Cl2氧化性最强。
答案:(1)Fe Ag+ (2)H+、;
[例3](1)配平化学方程式
KMnO4+FeS+H2SO4——MnSO4+Fe2(SO4)3+S↓+K2SO4+H2O
解析:① 标价态。
KO4++H2SO4——SO4+(SO4)3+↓+K2SO4+H2O
② 列变化,算出一个氧化剂(或还原剂)“分子”的化合价总共降低(或升高)多少.
氧化剂KMnO4,→↓5价
③ 等升降。↑3×5(系数)5FeS;↓5×3(系数)3KMnO4并确定相应的其他元素的系数:
3KMnO4+5FeS+H2SO4——3MnSO4+Fe2(SO4)3+5S↓+K2SO4+H2O
④ 平系数。
用观察法配平其他物质的系数,一般先配盐,再配酸,最后配水,并核对氧原子数。
⑤ 验结果。
答案:6 10 24——6 5 10 3 24
(2)配平化学方程式并填空
当KMnO4消耗0.05 mol时,产生CO2的体积为__________________L(标准状况下)。
解析:为简化过程,可直接在原题目中进行分析。首先列出价态变化并使之升降总数相等:
2×5 5×2
↑ ↓
H2C2O4 +KMnO4+H2SO4——CO2+K2SO4+MnSO4+H2O
然后确定参与氧化还原反应的元素的计量数:
5H2C2O4+2KMnO4+H2SO4——10CO2+K2SO4+2MnSO4+H2O
再用观察法配平其他物质的计量数:
5H2C2O4+2KMnO4+3H2SO4=10CO2+K2SO4+2MnSO4+8H2O
最后用O原子个数进行验算。
又根据方程式得:2KMnO4~10CO2
所以V(CO2)=0.05××22.4=5.6 L
答案:5 2 3——10 1 2 8 5.6
[例4] 已知Cu2S与某浓度的HNO3反应时,生成Cu(NO3)2和H2SO4,若反应中Cu2S与HNO3的质量比为320:819,则该反应的还原产物为__________________。
解析:Cu2S与HNO3物质的量之比为:=2:13,设还原产物中N元素价态降低n价,由得失电子守恒可知:2×(1×2+8)=(13-2×4)n,解得n=4,其还原产物为N2O。
答案: N2O
[例10] 绿矾在强热条件下分解,生成H2SO4、SO2、Fe2O3和H2O,每生成1 mol H2SO4时,分解绿矾的物质的量是__________________。
解析:设分解绿矾的物质的量为x,则生成氧化产物Fe2O3的物质的量为,生成还原产物SO2物质的量为y,由得失电子守恒可知×1×2=y×2,即y=,由题意可知
x-=1mol 解得x=2mol
答案: 2 mol
[例5] 已知下列变化过程中,0.2 mol RxO参加反应时,共转移0.4 mol电子。
RxO+MnO+H+RO2+Mn2++H2O
(1)x值为__________。
(2)参加反应的H+的物质的量为__________mol。
解析:由得失电子守恒可知:
0.2 molx×(4-)=0.4 mol ?=2
n(MnO)×5=0.4 mol
n(MnO)=0.08 mol
由电荷守恒可知:
n(H+)×1-0.08 mol×1-0.2 mol×2=0.08 mol×2
n(H+)=0.64 mol
答案:(1)2 (2)0.64
【模拟试题】
1. 下列反应一定属于氧化还原反应的是( )
A. 化合反应 B. 分解反应
C. 置换反应 D. 复分解反应
2. 下列变化中,需要加入氧化剂的是( )
A. SO2→SO3 B. HCl→H2
C. FeCl2→FeCl3 D. Fe2O3→Fe
3. 按金属活动性顺序由前到后考虑,下列说法中正确的是( )
A. 单质的还原性逐渐减弱
B. 原子的失电子能力逐渐增强
C. 对应离子的氧化性逐渐增强
D. 对应离子的得电子能力逐渐减弱
4. 下列反应中,盐酸只作氧化剂的是( )
A . Zn+2HCl=ZnCl2+H2↑
B.
C. Cl2+H2O=HCl+HClO
D. CaCO3+2HCl=CaCl2+H2O+CO2
5. 下列叙述中,正确的是( )
A. 同一反应中,氧化剂的氧化性比氧化产物的氧化性强
B. 同一反应中,还原剂的还原性比还原产物的还原性弱
C. 由X原子变成X2+的反应是氧化反应
D. 由X原子变成X2+,需加入还原剂
6. 在3Cl2+8NH3=6NH4Cl+N2反应中,还原性最强的物质是( )
A. Cl2 B. NH3 C. NH4Cl D. N2
7. 下列关于氧化还原反应的叙述中正确的是( )
A. 金属单质在反应中只作为还原剂
B. 非金属单质在反应中只作为氧化剂
C. 金属原子失电子越多,还原性越强
D. Cu2+比Fe2+氧化性强,Fe比Cu还原性强
8. 一个A原子转移两个电子给两个B原子,下列说法中正确的是( )
A. 形成化合物AB2,A是氧化剂
B. 形成化合物A2B,A被还原
C. 形成化合物AB2,B被还原
D. 形成化合物AB2,B有氧化性
9. 某反应的化学方程式为:aFeCl2+bKNO3+cHCl=dFeCl3+eKCl+fX+gH2O,若b=1,d=3,则X的化学式为( )
A. N2 B. NO C. NO2 D. NH4Cl
10. 有反应:;;依据上述方程式,下列微粒氧化能力排列顺序正确的是( )
A. B.
C. D.
11. 在8NH3+3Cl2=N2+6NH4Cl反应中,若有21.3g Cl2参加反应,则被氧化的NH3的质量为( )
A. 13.6g B. 10.2g C. 6.8g D. 3.4g
12. 离子在一定条件下可把Mn2+氧化成,若反应后变成,又知反应中氧化剂与还原剂的离子个数比为5:2,则中R元素的化合价为( )
A. +3 B. +5 C. +6 D. +7
13. 一定条件下硝酸铵受热分解的未配平化学方程式为:NH4NO3——HNO3+N2+H2O,在反应中被氧化与被还原的氮原子之比为( )
A. 1:1 B. 5:4 C. 5:3 D. 3:5
14. 下列叙述中,正确的是( )
A. 含氧酸能起氧化作用,无氧酸则不能
B. 阳离子只有氧化性,阴离子只有还原性
C. 失电子难的原子获得电子的能力一定强
D. 由X变为X2+的化学反应是氧化反应
15. 下列对盐酸的有关性质叙述正确的是( )
A. 有酸性,没有氧化性和还原性
B. 有酸性和氧化性,没有还原性
C. 有酸性和还原性,没有氧化性
D. 有氧化性和还原性,还有酸性
16. 配平下列氧化还原反应方程式。
① P+CuSO4+H2OCu3P+H3PO4+H2SO4
② H2PO+Ag++H2OH3PO4+Ag↓+H2↑
③ Fe2++O2+H2OFe3++Fe(OH)3↓
④ S+Ca(OH)2CaS2O3+CaS·Sx+H2O
17. 配平下列氧化还原反应方程式,并标明电子转移的方向和数目。
① H2S+H2SO3S↓+H2O
氧化产物是_____________,还原产物是_____________,二者质量比是_____________.
② Cl2+KOHKCl+KClO3+H2O
氧化剂是_____________,还原剂是____________,二者物质的量之比是____________.
③ KClO3+HClKCl+Cl2↑+H2O
HCl的作用是_____________,被还原的元素是________________,当反应过程中有3 mol电子转移时,可产生氯气_____________mol。
④ KIx+Cl2+H2OKCl+HIO3+HCl,若KIx与Cl2的化学计量数之比为1:8,则x=_____________。
18. 智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘,其化学方程式为:2NaIO3+5NaHSO3=3NaHSO4+2Na2SO4+I2+H2O
(1)反应中_____________元素被氧化,_____________是氧化剂。
(2)用短线标出电子转移方向和总数。
(3)反应产物中,所得氧化产物与还原产物质量之比为_____________。
19. ① 在淀粉碘化钾溶液中,滴加少量次氯酸钠溶液,立即会看到溶液变蓝色,这是因为_____________,离子方程式为____________________。
② 在碘和淀粉形成的蓝色溶液中,滴加亚硫酸钠溶液,发现蓝色逐渐消失,这是因为__________________,离子方程式是____________________。
③ 对比①和②实验所得的结果,将I2、ClO-、SO按氧化性由强到弱的顺序排列为___________________。
20. K2Cr2O7是一种橙红色且具有强氧化性的化合物,当它被还原成三价铬时,颜色有明显变化.据此,当交通警察发现汽车行驶反常时,就上前拦车,并让司机对填充了吸附有K2Cr2O7的硅胶颗粒的装置吹气。若发现硅胶变色达到一定程度,即证明司机是_________。这是因为K2Cr2O7跟_________(写化学名称)发生了反应.反应中,当有0.06 mol电子发生转移时,有_____________mol K2Cr2O7被还原。
21.(2003年上海,23)实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为:4CuI+HgCu2HgI4+2Cu
(1)上述反应产物Cu2HgI4中,Cu元素显__________价。
(2)以上反应中的氧化剂为__________,当有1 mol CuI参与反应时,转移电子________mol。
(3)CuI可由Cu2+与I-直接反应制得,请配平下列反应的离子方程式。
22. 工业上为从4J29合金(铁钴镍合金)废料中提取钴和镍,一般先用硫酸溶解合金使成为Fe2+、Co2+、Ni2+,再把Fe2+氧化为Fe3+,从而使Fe3+转化为某种沉淀析出,达到与Ni2+、Co2+分离的目的.生产上要使Fe2+氧化为Fe3+,而不使Co2+、Ni2+氧化的试剂是NaClO或NaClO3(均含少量H2SO4)溶液,反应的部分化学方程式如下(A为还原剂):
请完成以上化学方程式,并回答实际生产上采用NaClO3来氧化Fe2+比较合算的理由。
配平下列离子方程式,并回答问题:
(2)已知有3.21 g Fe(OH)3参加反应,共转移了5.42×1022个电子,则n=_______,FeO中铁的化合价为_____________________。
(3)根据(1)、(2)推测FeO能与下列哪些物质反应(只填序号)______________。
A. Cl2 B. SO2 C. H2S D. O2
【试题答案】
1. C 2. AC 3. AC 4. A 5. AC 6. B 7. AD 8. CD
9. B 10. C 11. D 12. D 13. C 14. D 15. D
提示:
1. 参见“氧化还原反应与基本反应类型的关系”,同步教学中的“一、(一)、8”,选C。
2. 只有物质被氧化,元素化合价升高时才需要加入氧化剂,选AC。
3. 参见同步教学中的“二、(一)、2”中的金属活动性与还原性、离子氧化性的关系,选AC。
4. A中的HCl全部作氧化剂,起氧化作用的是H+;
B中的HCl既作还原剂,又起酸的作用;
C中的HCl是还原产物;
D中的HCl起酸的作用。选A。
5. 参见同步教学中“氧化性和还原性强弱的比较”。选AC。
6. 根据氧化剂,氧化产物具有氧化性,还原剂,还原产物具有还原性,且还原剂的还原性大于还原产物的还原性。选B。
7. A中金属在反应时,一般由0价上升到正价,都作还原剂,B中非金属单质在反应中价态可升可降,既可以作氧化剂,也可以作还原剂,如:Cl2+H2O=HCl+HClO,C中还原性是以失电子的能力而论,而不是以失电子多少为依据,选AD。
8. 可以写出反应:A+2B=AB2,选CD
9. 设X中N的化合价为+m价
aFeCl2+bKNO3+cHCl=dFeCl3+eKCl+fX+gH2O
↓(5-m)b ↑d
依据化合价升降相等(5-m)b=d,b=1,d=3
则:m=2,因此产物为NO(N为+2价),选B。
10. 根据氧化剂的氧化能力大于氧化产物的氧化能力,选C。
11. 反应方程式中8NH3只有2NH3被氧化,设被氧化的NH3为xg,则:
2NH3+6NH3+3Cl2=N2+6NH4Cl
34g 71×3g
xg 21.3g
解得:x=3.4g,选D。
12. 依据题目,试着写出反应为:
据化合价升降相等:2×(x-6)×5=5×2
解得x=+7,选D.
13. 由题给:NH4NO3——HNO3+N2+H2O知NH4+中-3价氮元素失电子被氧化成N2,NH4NO3中-3价的氮被氧化;NO3-中+5价氮元素被还原为N2,NH4NO3中+5价的氮被还原,由得失电子相等,故有5NH4-失电子总数=3NO3-得电子总数的关系,因而被氧化的氮与被还原的氮原子数之比为5:3,选C。
14. A项错,任何酸都能电离出H+,因而都有氧化性,B项错,物质的氧化性或还原性与原子团的电荷无关,只与其中某些元素的价态有关。MnO4-有氧化性,NH4+有还原性,C项错,稀有气体既难得电子,也难失电子,选D。
15. HCl中+1价的氢有氧化性,-1价的Cl有还原性,另外H+还体现了酸性选D。
16. ① 11,15,24——5,6,15
② 2,2,4——2,2,3
③ 12,3,6——8,4
④ 4+2x,3——1,2,3
17. ① 2,1——3,3 S S 2:1
② 3,6——5,1,3 Cl2 Cl2 5:1
③ 1,6——1,3,3 还原剂与酸作用 氯酸钾中氯元素 1.8
④ 2,5x+1,6x——2,2x,10x 3?
18. (1)硫 碘酸钠
(3)氧化产物为3NaHSO4+2Na2SO4,还原产物为I2,故氧化产物与还原产物质量之比为(3×120+2×142):(2×127)=322:127
先从化合价的变化入手:;。在任何一个氧化还原反应中,得失电子总数(电子转移总数)等于化合价升降总数,本题第(2)问即是根据此规律来确定电子转移总数的。
19. ① I-被氧化成I2,I2遇淀粉变蓝 2I-+ClO-+H2O=I2+Cl-+2OH-
② I2被SO还原成I- I2+SO+H2O=SO+2H++2I- ③ ClO->I2>SO
提示:淀粉溶液变蓝的原因是溶液中存在I2,可由题目提供的反应物及产物中是否有I2,推断出反应的方程式.进一步来确定I2,ClO-,SO氧化性强弱。
20. 乙醇(C2H5OH)中碳元素平均为-2价,所以乙醇具有还原性,而K2Cr2O7具有强氧化性,硅胶是氧化剂载体,且具有吸附性.当司机饮酒后,口中呼出的气体中含有乙醇气体,乙醇遇到K2Cr2O7会发生氧化还原反应,其反应方程式为2K2Cr2O7+CH3CH2OH+8H2SO4=2K2SO4+2Cr2(SO4)3+2CO2+11H2O,由于K2Cr2O7被还原为正三价的铬,而产生明显的颜色改变.还原1 mol K2Cr2O7需要6 mol电子,所以当转移0.06 mol电子时,可还原的K2Cr2O7的物质的量为0.01 mol。
答案:酒后驾车 乙醇 0.01
21. (1)反应中Hg是还原剂,化合价由0价升高到+2,在反应产物Cu2HgI4中碘为-1价,由2x+2+(-1)×4=0 x=+1,即Cu元素显+1价。
(2)由所给反应知由CuI→Cu化合价从+1降到0,所从CuI为氧化剂。由
知每有4 mol CuI 参加反应,转移电子的物质的量为2 mol 当有1 mol CuI 参与反应时转移电子0.5 mol。
(3)用化合价升降法配平:
观察配平I-的化学计量数。
答案:(1)+1 (2)CuI 0.5 (3)2 5 2 1
22. 由于A为还原剂,氧化剂NaClO、NaClO3在酸性溶液中氧化能力增强知,A为FeSO4,B为H2SO4,则C一定为Fe2(SO4)3,反应的化学方程式如下:
NaClO+2FeSO4+H2SO4=NaCl+Fe2(SO4)3+H2O
NaClO3+6FeSO4+3H2SO4=NaCl+3Fe(SO4)3+3H2O
由上述反应知1 mol的NaClO3氧化FeSO4的物质的量为6 mol,而1 mol NaClO只氧化2 mol FeSO4,因而NaClO3合适。(2)由离子方程式:2Fe(OH)3+(5-n)ClO-+=2FeO+(5-n)Cl-+(n+3)H2O知2 mol Fe(OH)3共失去2(5-n) mol电子,所以有::=2 mol:2(5-n) mol n=2,在FeO中的Fe化合价为+6。(3)由铁及其化合物性质知:+6价的铁价态只能降低,故FeO可与SO2、H2S反应。
答案:NaClO+2FeSO4+H2SO4=NaCl+Fe2(SO4)3+H2O
NaClO3+6FeSO4+3H2SO4=NaCl+3Fe2(SO4)3+3H2O
由于NaClO31 mol可氧化6mol FeSO4,而NaClO 1mol只能氧化2 mol FeSO4故用NaClO3合适。
(1)2 5-n 2n 2 5-n n+3 (2)2 +6 (3)B C
第3课时 离子反应
考点要求:
1.离子共存问题是高考中的常见题型,是每年必考的题型。今后命题的发展趋势是:
(1)增加限制条件,如强酸性、无色透明、碱性、pH、甲基橙呈红色、发生氧化还原反应等;
(2)定性中有定量,如“由水电离出的c(H+)=1×10-4mol·L-1 的溶液中……”。
2.离子方程式的正误书写也是历年高考必出的试题。从命题的内容看,存在着三种特点:
(1)所考查的化学反应均为中学化学教材中的基本反应;错因大都属于化学式能否拆分、处理不当、电荷未配平、产物不合理和漏掉部分反应等;有量的限止的离子方程的书写或正误判断也是近几年考查的重点内容,也是这部分的难点。
(2)所涉及的化学反应类型以复分解反应为主,而溶液中的氧化还原反应约占15%;
(3)一些重要的离子反应方程式,在历年考卷中多次重复。如Na与H20的反应、Fe与盐酸或稀H2S04的反应自1992年以来分别考过多次。
(4)考查离子方程式的目的主要是了解学生使用化学用语的准确程度和熟练程度,具有一定的综合性,预计今后的考题还会保留。
重点、难点:
离子共存,离子方程式的正误判断是本节的重点内容;有量限止的离子方程式的书写或判断正误是本节的难点
基本概念:
1、离子反应、电解质、非电解质、离子方程式
(1)离子反应
定义:有离子参加的反应。
类型:
离子互换的非氧化还原反应:当有难溶物(如CaCO3 难电离物(如H20、弱酸、弱碱)以及挥发性物质(如 HCl)生成时离子反应可以发生。
离子间的氧化还原反应:取决于氧化剂和还原剂的相对强弱,氧化剂和还原剂越强,离子反应越完全
注意点:离子反应不一定都能用离子方程式表示。
如实验室制氨气 (NH4)2SO4 +Ca(OH)2 ?CaSO4+2NH3↑+2H2O
H2S气体的检验 Pb(AC)2+H2S=PbS↓+2HAc (注:Pb(AC)2可溶于水的盐的弱电解质)
(2)电解质、非电解质、强、弱电解质
电解质:在水溶液里或熔化状态下能够导电的化合物。
非电解质:在水溶液和熔化状态都不导电的化合物。
强电解质:在水溶液里全部电离成离子的电解质。
弱电解质:在水溶液里只有一部分分子电离成离子的电解质
强电解质与弱电解质的注意点
①电解质的强弱与其在水溶液中的电离程度有关,与其溶解度的大小无关。例如:难溶的BaS04、CaS03等和微溶的Ca(OH)2等在水中溶解的部分是完全电离的,故是强电解质。而易溶于水的CH3COOH、H3P04等在水中只有部分电离,故归为弱电解质。
②电解质溶液的导电能力的强弱只与自由移动的离子浓度及离子所带的电荷数有关,而与电解质的强弱没有必然的联系。例如:一定浓度的弱酸溶液的导电能力也可能比较稀的强酸溶液强。
③强电解质包括:强酸(如HCl、HN03、H2S04)、强碱(如NaOH、KOH、Ba(OH)2)和大多数盐(如NaCl、 MgCl2、K2S04、NH4C1)及所有的离子化合物;弱电解质包括:弱酸(如CH3COOH)、弱碱(如NH3·H20)、中强酸 (如H3PO4 ),注意:水也是弱电解质。
④共价化合物在水中才能电离,熔融状态下不电离
举例:KHSO4在水中的电离式和熔融状态下电离式是不同的。
(3)离子方程式:
定义:用实际参加反应的离子符号表示离子反应的式子
使用环境:离子程式在水溶液或熔融状态下才可用离子方程式表示
2、离子方程式的书写
(1)离子反应是在溶液中或熔融状态时进行时反应,凡非溶液中进行的反应一般不能写离子方程式,即没有自由移动离子参加的反应,不能写离子方程式。如 NH4Cl固体和Ca(OH):固体混合加热,虽然也有离子和离子反应,但不能写成离子方程式,只能写化学方程式。即:
2NH4Cl(固)+Ca(OH)2(固)=CaCl2+2H2O +2NH3 ↑
(2)单质、氧化物在离子方程式中一律写化学式;弱酸(HF、H2S、HCl0、H2S03等)、弱碱(如NH3·H20)等难电离的物质必须写化学式;难溶于水的物质(如CaC03、BaS03、FeS、PbS、BaS04,Fe(OH)3等)必须写化学式。如:
CO2+2OH-=CO32-+H2O CaC03+2H+=CO2↑+H20+Ca2+
(3)多元弱酸的酸式盐的酸根离子在离子方程式中不能拆开写。如NaHS03溶液和稀硫酸反应:HSO3- +H+=SO2↑+H2O
(4)对于微溶物的处理有三种情况;
①在生成物中有微溶物析出时,微溶物用化学式表示。如Na2S04溶液中加入AgNO3 ,溶液:2Ag++SO42-=Ag2S04 ↓
②当反应物里有微溶物处于溶液状态(稀溶液),应写成离子的形式。如C02气体通入澄清石灰水中:
CO2+Ca2++2OH-=CaCO3↓+H2O
③当反应物里有微溶物处于悬浊液或固态时,应写成化学式。如在石灰乳中加入Na2C03溶液:Ca(OH)2+CO32-=CaCO3↓+H2O 。
(5)操作顺序或反应物相对量不同时离子方程式不同,例如少量烧碱滴人Ca(HC03)2溶液[此时Ca(HCO3)2 过量],有
Ca2++HCO3-+OH-=CaCO3↓+H2O
少量Ca(HC03)2溶液滴人烧碱溶液(此时NaOH过量),有
Ca2++2OH-+2HCO3- =CaCO3↓+CO32- +2H2O
例1 碳酸氢钙溶液与过量氢氧化钠溶液混合,碳酸氢钙溶液与少量氢氧化钠溶液混合的化学方程式和离子方程式。
解答:当n(NaOH)>2nCa(HCO3)2时,NaOH过量
2NaOH+Ca(HCO3)2=CaCO3↓+Na2CO3+2H2O
2OH-+Ca2++2HCO3-=CaCO3↓+CO+2H2O
当n(NaOH)<2nCa(HCO3)2时,NaOH不足量
NaOH+Ca(HCO3)2=CaCO3↓+Na2CO3+H2O
OH-+Ca2++HCO3-=CaCO3↓+H2O
例2 在含有n mol FeBr2的溶液中,通入的Cl2的物质的量为x mol
(1)当x≤0.5n mol时的离子反应是 。
(2)当x≥1.5n mol时的离子反应是 。
(3)当x=n mol时的离子反应是 。
解答:了解离子反应类型,理解离子反应的实质,正确书写离子方程式,掌握离子反应规律。
(1)2Fe2++Cl2=2Fe3++2Cl- (2)2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
(3)2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
例3 在碘化钾溶液里滴加CuSO4溶液,可见无色溶液变为棕黄色,并有白色沉淀生成,表示这个反应的离子方程式是 。
解答:I-被Cu2+氧化为I2,Cu2+还原为Cu+,Cu+与溶液中的I-结合生成CuI
4I-+2Cu2+=2CuI↓+I2
第4课时 离子反应
3、离子共存问题
(1)“不共存”情况归纳
①离子之间相互结合呈沉淀析出时不能大量共存。如形成BaS04、CaS04、H2Si03、Ca(OH)2、MgS03、MgC03、 PbCl2、H2S04、Ag2S04等。
②离子之间相互结合呈气体逸出时不能大量共存,如:H+与S2-、HCO3-、SO32-、HSO3-和OH-与NH4+等,由于逸出H2S、C02、S02、NH3等气体或S2-变成HS-,CO32-变成HCO3-而不能大量共存。
③离子之间相互结合成弱电解质时不能大量共存。如:H+与CH3COO-、OH-、PO43-等离子,由于生成 CH3COOH、H20、HPO42-、H2PO4-、H3P04而不能大量共存。
④离子之间发生双水解析出沉淀或逸出气体时不能大量共存,如Al3+与AlO2-、Fe3+与HCO3- 、Al3+与HS- 、S2-、HCO3-、CO32-等离子。
⑤离子之间发生氧化还原反应时不能大量共存 Fe3+与I-、S2-、HS-;
MnO4-(H+)、NO3-(H+)、ClO-与Fe2+、I-、S2-、HS-、SO32-、HSO3-等
⑥离子之间相互结合成络离子时不能大量共存。如Fe3+与SCN-生成[Fe(SCN)]2+,Ag+、NH4+、OH-生成[Ag(NH3)2]+,Fe3+与C6H5OH也络合等
(2)离子在酸性或城性溶液中存在情况的归纳。
①某些弱碱金屑阳离子,如:Zn2+、Fe3+、Fe2+、 Cu2+、Al3+、NH4+、Pb2+、Ag+等。在水溶液中发生水解,有OH-则促进水解生成弱碱或难溶的氢氧化物。故上述离子可和H+(在酸性溶液中)大量共存,不能与OH-(在碱性溶液中)共存。但有NO3-存在时的酸性溶液, Fe2+等还原性离子不与之共存。
②某些弱酸的酸式酸根离子,如HCO3-、HS-等可和酸发生反应,由于本身是酸式酸根,故又可与碱反应,故此类离子与H+和OH-都不能共存。
③某些弱酸的阴离子,如:CH3COO- 、S2-、CO32-、 PO43-、AlO2-、SO32-、ClO- 、SiO32-—等离子在水溶液中发生水解,有H‘则促进其水解,生成难电离的弱酸或弱酸的酸式酸根离子。所以这些离子可和OH-(在碱性溶液中)大量共存,不能与H+(在酸性溶液中)大量共存。
④强酸的酸根离子和强碱的金属阳离子,如:Cl-、 Br- 、I-、SO42-、NO3-、K+、Na+等离子,因为在水溶液中不发生水解,所以不论在酸性或碱性溶液中都可以大量共存。但SO42-与Ba2+不共存。
⑤某些络离子,如[Ag(NH3)2]+,它们的配位体能与H+结合成NH3 [Ag(NH3)2]+ +2H+=Ag++ 2NH4+,所以,它们只能存在于碱性溶液中,即可与OH-共存,而不能与H+共存。
分析:“共存”问题,还应考虑到题目附加条件的影响,如溶液的酸碱性、PH值、溶液颜色、水的电离情况等。
[题型1]离子间因发生复分解反应(离子互换反应)而不能大量共存。
例1、下列各组离子在水溶液中能大量共存的是 (AC)
(A)K+ HCO3— CO32— Br— (B)CO32— HCO3— OH— K+
(C)Fe3+ Cu2+ NO3- SO42- (D)H+ Cl- Na+ SO32-
解析:分析所给选项B中:HCO3—+ OH—= CO32—+H2O;而D中:2H+ + SO32-= H2SO3
[题型2] 离子间因发生双水解反应而不能大量共存。
例2、某无色透明溶液,跟金属铝反应放出H2 ,试判断下列离子:Mg2+、Cu2+、 Ba2+ 、H+、Ag+、 SO42- 、 SO32-、HCO3- 、OH-、NO3- ,何者能存在于此溶液中
(1) 当生成Al3+时,可能存在__________;
(1) 当生成AlO2-时,可能存在__________。
解析: (1)说明溶液呈酸性:一则有H+ ,二必有SO42- ,三可能有Mg2+ (注意无NO3- );(2)说明溶液呈碱性:一则有OH- ,二必有Ba2+ ,三可能有NO3- 。
解题回顾:一是审题中注意溶液是无色的,二是注意H+、NO3-与Al作用不产生H2。
[题型3]:离子间因发生氧化还原反应而不能大量共存。
例3(2001年上海市高考题)下列离子在溶液中因发生氧化还原反应而不能大量共存的是(A)
(A)H3O+、 NO3- 、 Fe2+ 、 Na+ (B)Ag+、 NO3- 、Cl-、 K+
(C)K+ 、Ba2+、OH-、 SO42- (D)Cu2+、NH4+、Br-、OH-
解析:所给四个选项中各组离子均不能大量共存,只有A中的 H3O+ 、NO3- 、Fe2+三种离子因发生氧化还原反应符合题意。
点拨:抓住不能共存的条件——发生氧化还原反应。强强反应规律及中学常见强氧化剂、强还原剂的识记,是解决氧化还原应用问题(特别是隐含氧化还原反应问题)的关键,例如检验SO42-时不能用硝酸酸化,就是因为HNO3会使SO32-氧化为SO42- ,而干扰检验。
[题型4]在特殊条件下能够大量共存。
例4、下列各组离子中,在碱性溶液里能大量共存,并且溶液为无色透明的是(BD)
(A)K+ MnO4- Cl- SO42- (B)Na+ AlO2- NO3- CO32-
(C)Na+ H+ NO3- SO42- (D)Na+ SO42- S2- Cl-
解析:分析所给四个选项A中MnO4- 有颜色不合题意,C中H+ 也不合题材意。
例5下列各组离子中,在碱性溶液中共存,且加入盐酸过程中会产生气体和沉淀的是(C)
(A)Na+ NO3- AlO2- SO42- (B)Na+ NO3- SiO32- K+
(C)K+ Cl- AlO2- CO32- (D)Na+ Cl- HCO3- Ca2+
解析:分析所给四个选项:D中HCO3-不能在碱性溶液中大量存在,A和B中加入盐酸后无气体产生也不合题意。
例6、在含有I-且能使酚酞变红的无色溶液中,可大量存在的离子组是 ( D )
A.Na+、Cu2+、Br-、Cl- B.AlO2-、K+、NH4+、Na+
C.K+、Na+、NO3-、H+ D.K+、S2-、SO42-、OH-
解析:首先理解附加条件:I-不能在强氧化性溶液中存在,使酚酞变红的溶液为碱性,溶液为无色,有色离子不存在。逐一省视各选项:选项A 中Cu2+为蓝色且在碱性溶液中不共存。选项B中NH4+在碱性溶液中不共存。选项C中溶液具有强氧化性,I-不能共存。
课后练习
1.(2003·江苏)若溶液中由水电离产生的=1×10—14mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是(B )
A. Al3+ 、Na+ 、NO3-、Cl- B. K+ 、Na+、Cl-、NO3-
C. K+ 、Na+ 、Cl-、AlO2- D. K+ 、 NH4+、SO32-、NO3-
2.(2005年江苏高考化学试题)某溶液既能溶解AI(OH)3,又能溶解H2SiO3,在该溶液中可以大量共存的离子组是(B)
A.K+、Na+、HCO3-、NO3- B.Na+、SO42-、Cl-、ClO-
C.H+、Mg2+、SO42-、NO3- D.Ag+、K+、NO3- 、Na+
3、下列各组离子在溶液中不能大量共存,且加入过量NaOH溶液或过量稀盐酸均能得到澄清溶液的是 (BD)
A. Fe3+、CI-、Na+、SO42- B. AI3+、Na+、CO32-、NO3-
C. Ag+、Na+、SO42-、NO3- D. AIO2-、CO32-、K+、Na+
4.某能使石蕊试液变红的溶液中,能大量存在的离子是(A)
A.Al3+ NH4+ SO42- CI- B.Na+ Mg2+ HCO3- NO3-
C.K+ Na+ AlO2- Cl- D.Fe2+ K+ NO3- Cl-
5.在pH=0的无色透明溶液中,因发生氧化还原反应而不能大量共存的离子组是( BD )
A.Na+、K+、MnO4—、Cl— B.Cl—、S2O32—、K+、Na+
C.Na+、Cl—、CH3COO—、K+ D.K+、I—、Na+、ClO—
6.常温下测得某无色溶液中由水电离出的H+浓度为1×10—13mol/L,又知该溶液中还有NO-3,Na+,Cl-,那么该溶液中还一定存在的离子是 (D )
A.AlO2—、ClO— B.Mg2+、、SO42— C.Fe2+ 、Cu2+ D.Ba2+、K+
7、下列各组离子中,在碱性溶液中共存,且加入盐酸过程中会产生气体和沉淀的是(C)
(A)Na+ NO3- AlO2- SO42- (B)Na+ NO3- SiO32- K+
(C)K+ Cl- AlO2- CO32- (D)Na+ Cl- HCO3- Ca2+
8.某溶液滴入甲基橙显红色,在这种溶液中能大量共存的离子是(A)
A.Mg2+、K+、Br-、SO42— B.S2O32—、Na+、H+、Cl-
C.Ca2+、K+、ClO-、I- D.Al3+、K+、AlO3—、Cl-
9.在加入少量Al(OH)3能溶解的溶液中,加入下列各组离子,有可能在溶液中大量共存的是( BD)
A.NH4—、Na+、HCO3—、ClO- B.K+、ClO4—、NO3—、SO42—
C.Ca2+、Fe2+、Cl-、NO3— D.Na+、AlO2-、SO32—、S2-
10.在pH=0的溶液中,下列各组中的离子因发生氧化还原反应而不能大量共存的是(CD)
A.Ag+、Ca2+、NO3—、HCO3— B.SO32—、SO42—、Na+、Mg2+
C.Fe2+、K+、NO3—、Cl- D.K+、S2O32—、SO42—、Na+
11.某无色透明溶液中,由水电离出来的c(H+)=1×10-13 mol·L-1,在该溶液中一定能够大量共存的离子组是(B)
A.K+、Na+、MnO4—、NO3— B.K+、Na+、Cl-、NO3—
C.NH4+、AlO2-、Na+、CH3COO- D.Fe3+、S2-、Al3+、HCO3—
12.下列各离子组的叙述正确的是(BC)
A.在强酸性条件下Na+、I+、K+、可以大量共存
B.在强碱性条件下K+、AlO2-、Na+、S2-、NO3—可以大量共存
C.在水溶液中H+、NH4+、SiO32—、Cl-不能大量共存
D.在强酸性条件下NH4+、K+、SO32—、S2-可以大量共存
13.对下列各组离子的叙述不正确的是(BC)
A.H+、AlO2—、Ba2+、HCO3—不能在水中大量共存
B.Mg2+、NH4+、Fe2+、NO3—能在酸性溶液中大量共存
C.Fe3+、K+、SCN-、Cl-能大量共存且使溶液显红色
D.Na+、NO3—、CO32—、AlO2—能在碱性溶液中大量共存
第5课时 与试剂用量有关的离子反应
离子方程式的正确书写是高中化学教学中的重点内容之一。有很多反应因试剂用量不同而离子方程式不同,这部分知识构成了高中化学教学中的一个难点。但只要我们仔细分析,就会从中找出一些规律。
一、碱溶液与酸性氧化物的反应:
Ca(OH)2溶液、Ba(OH)2溶液、KOH溶液、NaOH溶液等碱溶液与CO2、SO2等酸性氧化物反应时若酸性氧化物用量不同则离子方程式不同。例如:
Ca(OH)2溶液和CO2反应时有:Ca2++2OH-+CO2=CaCO3↓+H2O(CO2少量) CO2+OH-=HCO3-(CO2足量)
NaOH溶液和SO2反应时有:2OH-+SO2=SO32-+H2O(SO2少量) OH-+SO2=HSO3-(SO2足量)
二、多元酸酸式盐与碱溶液生成沉淀的反应:
NaHCO3溶液、NaHSO3溶液、NaH2PO4溶液、Na2HPO4溶液、NaHSO4溶液分别与Ba(OH)2溶液、Ca(OH)2溶液反应或Ca(HCO3)2溶液、Ba(HCO3)2溶液与NaOH溶液、KOH溶液等反应时若试剂用量不同则离子方程式不同。例如:
Ca(HCO3)2溶液和NaOH溶液反应时有:
Ca2++HCO3-+OH-=CaCO3↓+H2O(NaOH少量) Ca2++2HCO3-+2OH-=CaCO3↓+ CO32-+2H2O(NaOH足量)
NaHSO4溶液与Ba(OH)2溶液反应时有: H++SO42-+Ba2++OH-=BaSO4↓+H2O(NaHSO4少量)
2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O(NaHSO4足量)
三、碳酸盐溶液与H+的反应:
Na2CO3溶液、K2CO3溶液与HCl溶液、HNO3溶液、NaHSO4溶液反应或Ba(HCO3)2溶液与NaHSO4溶液反应时若试剂用量不同则离子方程式不同。例如:
Na2CO3溶液与HCl溶液时有: CO32-+H+=HCO3-+H2O(HCl少量) CO32-+2H+=CO2↑+H2O(HCl足量)
Ba(HCO3)2溶液与NaHSO4溶液反应时有:
Ba2++HCO3-+H++SO42-= BaSO4↓+CO2↑+H2O(NaHSO4少量) Ba2++2HCO3-+2H++SO42-= BaSO4↓+2CO2↑+2H2O(NaHSO4足量)
四、氧化还原反应:
在氧化还原反应中,还原能力强的优先被氧化。例如在FeBr2溶液中通入Cl2时,因为Fe2+的还原能力比Br- 强,因此,当通入少量的Cl2时反应为:Fe2++Cl2=Fe3++2Cl-;当通入足量的Cl2时反应为:2Fe2++4Br-+3Cl2=2Fe3++6Cl-+4Br2。
五、多元弱酸或中强酸与碱溶液的反应:
多元弱酸或中强酸与碱溶液反应时当碱的用量不同时,酸中的H+被中和的程度不同而生成不同的盐。例如H3PO4溶液和NaOH溶液反应时:
当H3PO4和NaOH的物质的量之比为1﹕1时反应为: H3PO4+OH-=H2PO4-+H2O
当H3PO4和NaOH的物质的量之比为1﹕2时反应为:H3PO4+2OH-=HPO42-+2H2O
当H3PO4和NaOH的物质的量之比为1﹕3时反应为:H3PO4+3OH-=PO43-+3H2O
六、与铝有关的离子反应:
⑴Al3+ 和OH-的反应:Al3++3OH-=Al(OH)3↓(OH-少量) Al3++4OH-=AlO2-+2H2O(OH-足量)
⑵AlO2- 和 H+反应:AlO2-+ H++H2O=Al(OH)3↓(H+少量) AlO2-+ 4H+ =Al3++2H2O (H+足量)
⑶KAl(SO4)2和Ba(OH)2反应:
2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓[Ba(OH)2少量]
Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓[Ba(OH)2足量]
七、NH4+ 和OH- 的反应:
NH4+和OH-的反应因溶液的浓度不同而有不同的离子反应:
NH4++OH-=NH3↑+H2O(浓溶液) NH4++OH-=NH3 H2O(稀溶液)
八、漂白粉溶液和CO2的反应:
漂白粉溶液和CO2的反应因CO2的量不同而有不同的离子反应:
Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO(CO2少量) ClO-+CO2+H2O=HCO3-+HClO(CO2足量)
九、氨水与AgNO3溶液、CuSO4溶液的反应:
氨水与AgNO3溶液、CuSO4溶液反应时因氨水的用量不同有不同的离子反应。氨水少量时生成沉淀,足量或稍过量时生成络离子。
例如:2NH3 H2O+Cu2+=Cu(OH)2↓+2NH4+(氨水少量) 4NH3 H2O+Cu2+=[Cu(NH3)4]2++4H2O(氨水足量)
第6课时 化学反应中的能量变化
高考分析:反应热在教材中的篇幅较少,高考内容主要包括:
1.书写热化学方程式或判断热化学方程式的正误;
2.有关反应热的计算;
3.比较反应热的大小
最近又出现反应热与能源结合起来进行考查。由于能源问题已成为社会热点,有关能源的试题也将成为今后命题的重点:预计考查反应热的内容将不断拓宽,难度有所提高,题型也会有新的变化。由于反应热与物理学中的“热”、生物学生态系统中的“能量传递”又有密切联系,有关能量的学科间的综合将会成为“3+X”理科综合命题的热点。
知识框架
1、化学反应的能量
2、反应热的知识结构:
知识点拨
一、概念
1.化学反应及其能量变化
任何一个化学反应中,反应物所具有的总能量与生成物所具有的总能量总不会相等的。在新物质产生的同时总是伴随着能量的变化。
2.放热反应和吸热反应
(1)放热反应:即有热量放出的化学反应,其反应物的总能量大于生成物的总能量。
(2)吸热反应:即吸收热量的化学反应,其反应物的总能量小于生成物的总能量。
3.化学反应中的能量变化示意图对于该“示意图”可理解为下列形式:
由能量守恒可得:
反应物的总能量:生成物的总能量+热量(放热反应)
反应物的总能量:生成物的总能量-热量(吸热反应)
4.燃料充分燃烧的两个条件
(1)要有足够的空气
(2)燃料与空气要有足够大的接触面。
热化学方程式与普通化学方程式的区别有三点不同
1.热化学方程式必须标有热量变化。
2.热化学方程式中必须标明反应物和生成物的状态,因为反应热除跟物质的量有关外,还与反应物和生成物的聚集状态有关。
3.热化学方程式中各物质的系数只表示各物质对应的物质的量,因此,有时可用分数表示,但要注意反应热也发生相应变化。
书写热化学方程式时明确以下问题:
(1)反应放出或吸收的热量的多少与外界的温度和压强有关,需要注明,不注明的指101kPa和25℃时的数据。
(2)物质的聚集状态不同,反应吸收和放出的热量不同,因此要注明反应物和生成物的聚集状态。
(3)热化学方程式中的热量数据,是与各化学计量数为物质的量时相对应的,不是几个分子反应的热效应。因此式中化学计量数可以是整数,也可以是分数。一般出现分数时是以某一反应物或生成物为“1mol”时其它物质才出现的。
(4)无论热化学方程式中化学计量数为多少,△H的单位总是KJ/mol,但△H的数值与反应式中的系数有关。
二、燃烧热、中和热
1.燃烧热
(1)概念:在101kPa时,1mol物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。燃烧热的单位一般用kJ/mol表示。
注意:完全燃烧,是指物质中下列元素完全转变成对应的物质:C→C02,H→H20,S→S02等。
(2)表示的意义:例如C的燃烧热为393.5kJ/mol,表示在101kPa时,1molC完全燃烧放出393.5kJ的热量。
2.中和热
(1)概念:在稀溶液中,酸跟碱发生中和反应而生成 1 molH20,这时的反应热叫中和热。
(2)中和热的表示:H+(aq)+OH-(aq)=H2O (1); △H=-57.3kJ/mol。
3.使用化石燃料的利弊及新能源的开发
(1)重要的化石燃料:煤、石油、天然气
(2)煤作燃料的利弊问题
①煤是重要的化工原料,把煤作燃料简单烧掉太可惜,应该综合利用。
②煤直接燃烧时产生S02等有毒气体和烟尘,对环境造成严重污染。
③煤作为固体燃料,燃烧反应速率小,热利用效率低,且运输不方便。
④可以通过清洁煤技术,如煤的液化和气化,以及实行烟气净化脱硫等,大大减少燃煤对环境造成的污染,提高煤燃烧的热利用率。
(3)新能源的开发
①调整和优化能源结构,降低燃煤在能源结构中的比率,节约油气资源,加强科技投入,加快开发水电、核电和新能源等就显得尤为重要和迫切。
②最有希望的新能源是太阳能、燃料电池、风能和氢能等。这些新能源的特点是资源丰富,且有些可以再生,为再生性能源,对环境没有污染或污染少。
理解中和热时注意:
①稀溶液是指溶于大量水的离子。②中和热不包括离子在水溶液中的生成热、电解质电离的吸热所伴随的热效应。③中和反应的实质是H+和OH-化合生成 H20,若反应过程中有其他物质生成,这部分反应热也不在中和热内。
三、中和热测定实验:
在50 mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在下图装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。试回答下列问题。
(1)大小烧杯间填满碎纸条的作用是什么?
(2)大烧杯上如不盖硬纸板,对求得中和热的数值有何影响
(3)改用60 mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液进行反应,与上述实验相比,所放热量是否相等 所求中和热数值是否相等?简述理由。
(4)用相同浓度和体积的氨水代替氢氧化钠溶液进行上述实验,为什么测得中和热的数值偏低?
例题1.(06年浙江湖州)下列各图中,表示正反应是吸热反应的是( )
2.(06年南师大附中)“摇摇冰”是一种即用即冷的饮料。吸食时将饮料罐隔离层中的化学物质和水混合后摇动即能制冷。该化学物质是( )
A.氯化钠 B.生石灰 C.氢氧化钠 D.硝酸铵
3.(06年重庆)下列热化学方程式中的ΔH能表示物质燃烧热的是( )
A. 2 CO(g) + O2(g) = 2 CO2(g) ΔH = - 566 KJ·mol-1
B. CH4(g) + 2 O2(g) = CO2(g) + 2 H2O(l) ΔH = - 890 KJ·mol-1
C. 2 H2(g) + O2(g) = 2 H2O(l) ΔH = - 571.6 KJ·mol-1
D. H2(g) + Cl2(g) = 2 HCl(g) ΔH = - 184.6 KJ·mol-1
4.(06年湖南简阳)已知H+(aq) + OH-(aq) = H2O(l) ΔH = - 57.3 kJ·mol-1。以下四个化学反应方程式:
① H2SO4(aq) +2 NaOH(aq) = Na2SO4(aq) + 2 H2O(l);
② H2SO4(aq) + Ba(OH)2(aq) = BaSO4(s) + 2 H2O(l);
③ HCl(aq) + NH3 H2O(aq) = NH4Cl(aq) + H2O(l);
④ CH3COOH(aq) + NH3 H2O(aq) = CH3COONH4(aq) + H2O(l)。
其中反应热为57.3 kJ·mol-1的是( )
A.①和② B.③ C.④ D.以上都不对
4.(06年天津)已知:H+ (aq)+OH- (aq)= H2O △H1 = - 57.3 kJ·mol-1,
H2SO4(浓)+ NaOH(aq)=Na2SO4(aq)+ H2O(l) △H2 = m,下列说法正确的是( )
A.上述热化学方程式中的计量数表示分子个数 B. △H1>△H2
C.△H2 = - 57.3 kJ·mol-1 D. |△H1|>|△H2|
6.(06年湖南石门)在下列各说法中,正确的是
A.△H > 0表示放热反应,△H < 0表示吸热反应
B.热化学方程式中的化学计量数只表示物质的量,可以是分数
C.1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热
D.1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热
11.(06年江苏淮阴)据《参考消息》报道,有科学家提出硅是“21世纪的能源”、“未来的石油”的观点。假如硅作为一种普遍使用的新型能源被开发利用,关于其有利因素的下列说法中,你认为不妥当的是
A.硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料
B.硅的来源丰富,易于开采,且可再生
C.硅燃烧放出的热量大,且燃烧产物对环境污染程度低,容易有效控制
D.寻找高效新催化剂,使硅的生产耗能很低,是硅能源开发利用的关键技术
7.(06年南开中学)已知31 g 白磷变成红磷放出 18.39 kJ 热量,下列两反应中:
P4(s)+ 5 O2(g)= 2 P2O5(s),△H = Q1 kJ·mol-1
4 P(红,s)+ 5 O2(g)= 2 P2O5 (s),△H = Q2 kJ·mol-1
则下列说法中正确的是( )
A.Q1 > Q2,白磷比红磷稳定 B.Q1 > Q2,红磷比白磷稳定
C.Q1 < Q2,白磷比红磷稳定 D.Q1 < Q2,红磷比白磷稳定
9.(06年广东惠州)根据热化学方程式:S(s) + O2(g)= SO2(g) △H = -297.23 kJ·mol-1,下列说法正确的是:
A.1 mol SO2 (g)的能量总和大于1 mo S(s)和1 mol O2(g)的能量总和
B.1 mol SO2(g)的能量总和小于1 mol S(s)和1 mol O2(g)的能量总和
C.S(g) + O2(g) = SO2(g) △H = -Q kJ·mol-1;Q的值大于297.23
D.S(g) + O2(g)= SO2(g) △H = -Q kJ·mol-1;Q的值等于297.23
10.(06年江苏东海)工业由粗硅制取纯硅有以下反应:
①Si(s) + 3 HCl(g)SiHCl3(g) + H2(g);△H = -318 kJ·mol-l
②SiHCl3(g) + H2(g)Si(s) + 3 HCl(g);
下列关于上述反应的说法中不正确的是
A.反应①、②均为氧化还原反应 B.反应①、②均为置换反应
C.若反应①放热,则反应②一定吸热 D.欲提高SiHCl3产率,可减压或升温
1.(06年广东深圳)1840年前后,俄国科学家盖斯(Hess)指出,一个化学反应的热效应,仅与反应物的最初状态及生成物的最终状态有关,而与中间步骤无关,这就是著名的“盖斯定理”。现已知,在101 KPa下,CH4(g)、H2(g)、C(s)的燃烧热分别为890.83 kJ·mol-1、285.83 kJ·mol-1和393.51 kJ·mol-1,则反应C(s) + 2 H2(g) = CH4(g)的反应热△H =____,根据以上信息,你认为“盖斯定理”在我们确定一些化学反应的反应热时有何重要意义_________________________。
12.(06年东阳)已知:2 H2(g) + O2(g) = 2 H2O(g) △H1;
2 H2(g) + O2(g) = 2 H2O(l) △H2;
2 CO(g) + O2(g) = 2 CO2(g) △H3。
⑴ 写出液态水转化为气态水的热化学方程式 。
⑵ CO和H 2分别燃烧生成CO2(g)和H 2O(g),欲得到相同热量,所需CO和H 2的体积比是 。
13.(06年安徽宿迁)在化学反应中,只有
极少数能量比平均能量高得多的反应物分子发生
碰撞时才可能发生化学反应,这些分子被称为活
化分子。使普通分子变成活化分子所需提供的最
低限度的能量叫活化能,其单位通常用kJ·mol-1
表示。请认真观察右图,然后回答问题。
(1)图中所示反应是________(填“吸热”
或“放热”)反应,该反应_______(填“需要”或“不需要”)加热,该反应的△H =________
(用含E1、E2的代数式表示)。
(2)已知热化学方程式:H2(g)+ O2(g) = H2O(g) △H = - 241.8 kJ·mol-1,该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为____________________。
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子百分数增多,反应速率加快,你认为最可能的原因是_________________________。
答案A, D ,B ,D ,B ,B ,D ,D ,BC ,D
11:△H = - 74.81 kJ·mol-1;对于一些很难用实验方法直接测定热量的化学反应的反应热可以用“盖斯定理”间接测定。
解析:CH4(g)、H2(g)、C(s)在101 KPa下燃烧的热化学方程式分别为:
① CH4(g) + 2 O2(g) = CO2(g) + 2 H2O(l),ΔH1= -890.36 kJ·mol-1
② H2(g) +O2(g) = 2 H2O(l),ΔH2 = -285.83 kJ·mol-1
③ C(s) + O2(g) = CO2(g),ΔH3 = -393.51 kJ·mol-1
根据“盖斯定理”,③ + ② × 2 - ① 得:
④ C(s) + 2 H2(g) = CH4(g),ΔH = ΔH3 + 2 ΔH2–ΔH1 = -74.81 kJ·mol-1
12 ⑴ H2O(l) = H2O(g); ⑵
13 (1)放热; 需要; -(E1 - E2) kJ·mol-1
(2)409 kJ·mol-1; (3)使用了催化剂。
能量变化
化学能转化为热能
放热反应
吸热反应
类型
反应物的总能量大于生成物的总能量
反应物的总能量小于生成物的总能量
遵循能量守恒原理
能量利用
燃料充分燃烧
新能源的开发
减少污染
化学反应中的能量的变化
反应热
含义
与键能的关系
表示方法
种类
单位:kJ/mol
符号:△H
燃烧热
中和热
热化学方程式
意义
书写方法
有关计算
能量
反应过程
反应过程
反应物
生成物
能量
△H<0
△H>0
反应物
生成物
反应过程
能量
(kJ/mol)
反应物
分子
生成物
分子
活化
分子
反应物的
总能量(E1)
生成物的
总能量(E2)
(Ⅰ)
(Ⅱ)
活化分子的最低能量
20
同课章节目录
