得胜中学高三化学第一轮复习教案第十二讲 化学键 非极性分子和极性分子[下学期]
文档属性
| 名称 | 得胜中学高三化学第一轮复习教案第十二讲 化学键 非极性分子和极性分子[下学期] |  | |
| 格式 | rar | ||
| 文件大小 | 964.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2008-07-16 15:28:00 | ||
图片预览



文档简介
第十二讲 化学键 非极性分子和极性分子
丁占华设计(2006年11月)
(一)高考要点:
一、化学键
1、定义:
①
②
2、化学反应的本质
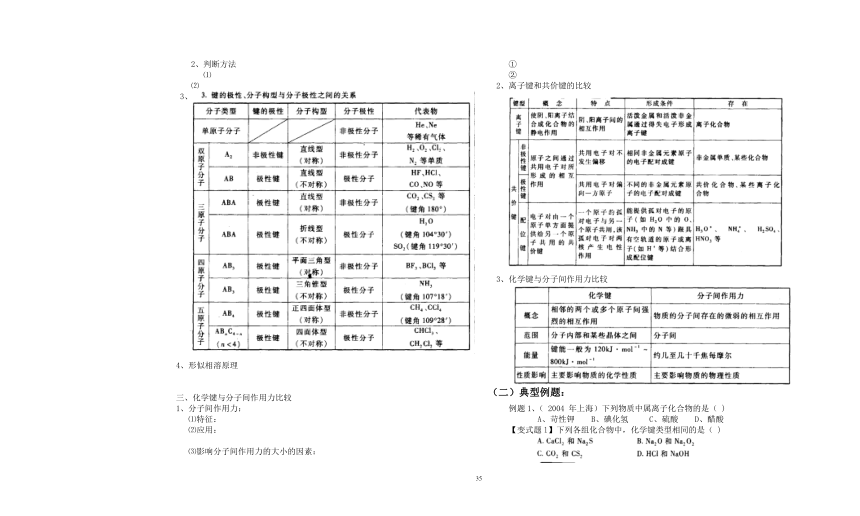
3、化学键的类型:
⑴离子键
①
②
⑵共价键
①共价键的主要性质—键参数
项目 概念 对分子性质的影响
②共价键的类型:
A非极性键:
B、极性键:
C、配位键:
⑶金属键:
4、化学键的表示方法
⑴电子式
①
②
③
⑵结构式
5、常见物质的化学键:
二、非极性分子和极性分子
1、定义:
2、判断方法
⑴
⑵
3、
4、形似相溶原理
三、化学键与分子间作用力比较
1、分子间作用力:
⑴特征:
⑵应用:
⑶影响分子间作用力的大小的因素:
①
②
2、离子键和共价键的比较
3、化学键与分子间作用力比较
(二)典型例题:
例题1、( 2004 年上海)下列物质中属离子化合物的是( )
A、苛性钾 B、碘化氢 C、硫酸 D、醋酸
【变式题l】下列各组化合物中,化学键类型相同的是( )
例题2、( 2004 年江苏)下列各项中表示正确的是( )
【变式题2】下列电子式中,正确的是( )
例题3、( 2003 年江苏)下列分子中,原子的最外层电子稳定结构的是( )
【变式题3】 钡和钠相似,也能形成含O22-的过氧化物,下列叙述中错误的是( )
A、过氧化钡的化学式是 Ba202
B、1 mol 过氧化钡跟足量水反应生成 0.5 mol 氧气
C、
D、过氧化钠和过氧化钡都是强氧化剂
例题4、下列分子中,所有原子的最外层都满足 8 电子稳定结构的是( )
A、光气( COCl2 ) B、六氟化硫
C、二氟化氙 D、三氟化硼
【变式题4】 已知S、Cr 两元素的最高价均为+6价,则下列粒子中,从化合价
分析,可能存在过氧键(—O—0—)的是( )
例题5、(2004 年全国)下列分子有极性的是( )
A、CCl4 B、 C02 C、 NH3 D、C6H6
【变式题5】下列各组分子中,都是由极性键构成极性分子的是( )
A、CH3Cl与Cl2 B、NH3和H20
C、H2S与CS2 D、CO2与Hl
例题6、( 2004 年全国)下列分子中,所有原子不可能共处在同一平面上的是( ) A、C2H2 B、CS2 C、NH3 D、 C6H6
【变式题6】 NH3 分子的空间构型是三角锥型,而不是正三角形的平面结构,其充
分的理由是( )
A、NH3分子是极性分子 B、NH3 分子内3个N—H 键的键长相等,键角相等 C、 NH3分子内3 N—H 键的键长相等, 3 个键角都等于 107。18,
D、NH3分子内3个N—H 键的键长相等, 3 个键角都等于120。
例题7、( 2005 年北京春招模拟)以下关于分子力的说法,正确的是( )
A、分子间既存在引力也存在斥力
B、液体难于被压缩表明液体中分子力总是引力
C、气体分子之间总没有分子力的作用
D、扩散现象表明分子间不存在引力
【变式题7】 下列物质变化过程中所克服的粒子间作用力属同种类型的是( )
A、 I2受热升华和 NH3Cl 受热分解
B、SI02和NaCl的熔化
C、干冰升华和液氧的汽化
D、 Hl和 NH4Cl 受热分解
基础题型
1、下列关于化学键的说法中正确的是( )
A、组成单质的分子内一定含有共价键
B、由非金属元素组成的化合物不一定是共价化合物
C、非极性键只存在于双原子单质分子中
D、不同元素组成的多原子分子里的化学键一定为极性键
2、下列物质的变化过程中,有共价键被破坏的是( )
A、I2升华 B、NaCl熔融
C、HCl溶于水得盐酸 D、从 NH4HC03中闻到刺激性气味
3、下列表达方式错误的是( )
A、氨分子的电子式为 B、S2-结构示意图为
C、氧18原子的符号为188O D、C02分子的结构式为 O=C=O
4、下列含有极性键的非极性分子是( )
A、CH4 B、NH3 C、CO2 D、H20
5、下列说法正确的是( )
A、离子化合物中,各原子间都是以离子键结合的
B、共价化合物中,各原子间都是以共价键结合的
C、非极性分子中,各原子间都是以非极性键结合的
D、极性分子中,各原子间都是以极性键结合的
6、已知 CO2、BF3、CH4、S03都是非极性分子,NH3、H2S、H2O、S02都是极性分
子,由此可推出ABn型分子是非极性分子的经验规律正确的是 ( )
A、分子中所有原子都在同一平面内
B、分子中不含氢原子
C、在 ABn型分子中A元素为最高正价
D、在ABn型分子中A原子最外层的电子都已成键
7、科学家发现铂的两种化合物,a 为, b为
二者具有不同的特性,a 有抗癌作用,而 b 没有,则
(l) a 和 b 互为
A、同分异构体 B、同素异形体 C、同位素 D、同一物质
(2)在a和b分子中,Pt原子与 2个Cl及 2 个 N 原子形成的结构为
A、正四面体型 B、四面体型 C、平面型 D、直线型
8、硼氢化钠(NaBH4)是一种离子化合物,具有很强的还原性,被称为“万能”还原剂。
(l)硼氢化钠中的阴离子是 (用符号表示),其中B、H 两元素的化合价分别是 ;
(2)已知将 NaBH4放人水中,可以生成偏硼酸钠和氢气,表示这个反应的离子方程式是 ;
(3) NaBH4可以从含 Au3+的碱性溶液中回收黄金,其离子方程式是
。
9、已知磷酸分子 中的三个氢原子都可以跟重水分(D2O)
中的D原子发生氢交换,又知次磷酸(H3PO2)也可以跟D2O 进行氢交换,
但次磷酸二氢钠 (NaH2 PO2)却不再跟D2O 进行氢交换,由此可推断出
H3PO2 的分子结构为( )
10、已知在一个分子中,如果结构对称,即电荷分布是均匀的,该分子为非
极性分子;如果结构不对称,即电荷分布不均匀,该分子即为极性分子,
如H2O 的结构式为 ,电荷分布不均匀,为极性分子; CO2的结
构式为O=C=O,电荷分布均匀,为非极性分子。又知非极性分子易溶于
非极性分子中,极性分子易溶于极性分子中,又叫相似相溶原理。
RtCl2(NH3)2为平面正方形结构,它可以形成两种固体:一种为淡黄色,
在水中溶解度小;另一种为黄绿色,在水中溶解度大。请在以下划线处
内画出这两种固体分子的几何构型图 。黄绿色固体在
水中溶解度比淡黄色固体大,原因是 。
11、有X、Y、Z 三种元素,其中 X 的负价阴离子的原子核外电子排布和氙
的原子核外电子排布相同;Y有两种氧化物,其水溶液都呈碱性。在Y 的
两种氧化物中,Y 的质量分数分别为74.19%、58.97%,这两种氧化物
的摩尔质量分别是62g/ mol、78g/mol。在 X和Y化合生成物的水溶液
中滴入Z单质的水溶液,溶液由无色变为深黄色,Z和X在同一主族,
相差2个周期。
(1)写出三种元素的名称X ;Y ;Z
(2)Y的两种氧化物分别为 、 ;
(3) Z的单质溶于水,滴加到X和Y 形成的化合物的水液中,其反应的
离子方程式为(要求标明电子转移的方和总数)
(4)X与Y形成的化合物熔点比Z和Y 形成的化合物点 (填“高”
或“低) ;其原因是
(5)用电子式表示Y的质量分数为 58.97%的氧化物形成过程
12、若短周期中的两种元素可以形成原子个数比为2:3的化合物,则这两种
元素的原子序数之差不可能是
A、1 B、3 C、5 D、6
13、关于化学键的下列叙述中,正确的是( ).
A、离子化合物可能含共价键 B、共价化合物可能含离子键
C、离子化合物中只含离子键 D、共价化合物中不含离子键
第十二讲 化学键 非极性分子和极性分子
丁占华设计(2006年11月)
(一)高考要点:
一、晶体的类型与结构:
1、离子晶体:
⑴定义:
⑵构成微粒:
⑶作用力:
⑷注意:①
②
2、分子晶体:
⑴定义:
⑵构成微粒:
⑶作用力:
⑷注意:①
②
3、原子晶体:
⑴定义:
⑵构成微粒:
⑶作用力:
4、金属晶体:
⑴定义:
⑵构成微粒:
⑶作用力:
5、四种晶体的比较
二、晶体熔点、沸点比较及其规律
1、不同类型的晶体:
2、同一类型的晶体:
⑴原子晶体:
⑵离子晶体:
⑶金属晶体:
⑷分子晶体:
①
②
③
④
三、晶体类型的判断方法:
1、
2、
3、
4、
5、
四、晶体的几个特殊规律:
1、
2、
3、
4、
5、
6、
7、
五、晶体化学式的确定
1、均摊法:
均摊是指每个晶胞平均拥有的粒子数目。求晶体中粒子个数比的方法是: ⑴⑴处于顶点的粒子,
⑵处于棱上的粒子,
⑶处于面上的粒子,
⑷处于晶胞内部的粒子,
2、常见晶体的空间构型及质点数问题的分析:
⑴金刚石(原子晶体—如图 D 所示)
基本单元是正四面体。每一个碳原子与其他 4 个碳原子等距离紧邻,由共价键结合成的最小环状结构中有 6 个碳原子,但这 6 个碳原子不在同一平面上。
⑵石墨(混合型晶体―如图E所示)为层状结构。
每一层内由 6 个碳原子通过非极性键结合成的平面正六边形结构组成,其中每一个碳原子与其他3个碳原子等距离紧邻,即每个碳原子为三个六边形共用,故同一平面中备任何一个六边形占据了该六边形中的每一个碳原子的,因此,每一个六边形占有的碳原子数为6×= 2 个。
⑶石英—二氧化硅(原子晶体)
晶体中重复单元是硅氧四面体。每一个硅原子紧邻 4 个氧原子,每一个氧原子紧邻 2 个硅原子,形成了由 Si—O 极性键构成十二元环的最小环状结构。与金刚石相同,十二元环中的 6 个硅原子和 6 个氧原子不在同一平面上。
⑷氯化钠(离子晶体―如图A 所示)
晶体内重复单元为简单立方。每一个 Na+紧邻 6个Cl-,每个 Cl-又紧邻6个Na+若从正方形的对角线观察,与每一个 Na+等距离围绕的且又最近的Na+为 12 个;同理,与每一个 Cl-等距离围绕的且又最近的 Cl-为 12 个。
典型例题
例题1、有关晶体的下列说法正确的是
A、晶体中分子间作用力越大,分子越稳定
B、原子晶体中共价键越强,熔点越高
C、冰融化成水分子时,共价键发生断列
D、氯化钠融化时,离子键未被破坏
例题2、(2 004 年广东) X是核外电子数最少的兀素,Y是地壳中含量最丰富的元素,Z在地壳中的含量仅次于Y, W可以形成自然界最硬的原子晶体, 下列叙述错误的是( )
A、 WX4是沼气的主要成分 B、固态X2Y是分子品体
C、ZW是原子晶体 D、ZY2的水溶液俗称“水玻璃”
【变式题2】氢叠氮酸(HN3)与醋酸酸性相近,其盐稳定,但遭撞击可迅速分解生
成氮气,有关氢叠氮酸的叙述有
例题3、下列各组物质中,按熔点由低到高的顺序排列正确的是( )
【变式题3】已知几种物质的熔点和沸点(℃)
例题4、水的状态除了气态、液态和固态外,还有玻璃态。它是由液态水急速冷却
到165K时形成的。玻璃态的水无固定形状,不存在晶体结构,且密度与普
通液态水相同,有关玻璃态水的叙述中正确的是( )
A、水由液态变为玻璃态,体积缩小 B、水由液态变为玻璃态,体积膨胀
C、玻璃态是水的一种特殊状态 D、玻璃态水是分子晶体
【变式题4】 用激光将置于铁室中石墨靶上的碳原子炸松,同时用射频电火喷射
氮气,此时碳、氮原子结合成碳氮化合物薄膜,这种化合物比金刚石更坚
硬,其原因可能是 ( )
A、碳、氮原子构成平面网状结构的晶体
B、碳、氮单质的化学性质均不活泼
C、碳氮键比金刚石中的碳碳键更短
D、氮原子最外层电子数比碳原子多
例题5、(2005年黄冈模拟)下列说法中正确的是( )
A、含有化学键的纯净物一定是化合物
B、离子晶体中一定有离子键
C、由不同种原子所形成的纯净物一定是化合物
D、分子晶体中一定不含离子键哑函
例题6、⑴如图所示为固态 C02的晶体结构示意图。
通过观察分析,可得出每个 CO2分子周围
与之紧邻等距的C02分子有 个。
⑵试判断: ① SiO2 ② C02 CS2晶体的熔
点由高到低排列的顺序是 (填相应物质的编号)。
基础题型:
1、下列晶体中均为分子晶体的是
2、氮化硅是一种新制得的无机非金属材料,它是一种超硬、耐磨、耐高温的物质。
下列各组物质熔化时,所克服粒子间的相互作用与氮化硅熔化时所克服粒子间
的相互作用都相同的是( )
A、碘和白磷 B、硫和硅晶体 C、碳化硅和水晶 D、硝酸钾和氧化镁
3、SiCl4的分子结构与 CCl2类似,对其作出如下推测,其中不正确的是( )
A、SiCl4晶体是分子晶体 B、常温、常压下SiCl4是气体
C、SiCl4的分子是由极性键形成的非极性分子 D、SiCl4熔点高于C Cl4
4、某离子晶体结构如图所示, X (○表示)位于立方体的顶点,Y(○表示)位于
立方体的中心。该晶体的化学式应为( )
5、图是氯化钠晶体的结构示意图,其中,
与每个Na+距离最近且等距离的几个Cl-
所围成的空间的构型为( )
A、正四面体
B、正六面体
C、正八面体
D、三角锥
6、单质硼有无定形体和晶体两种,参考下表数据。
⑴晶体硼的晶体类型属于 晶体,理由是
⑵已知晶体硼的基本结构单元是由硼原子组成的正二十面体(如图所示),其中有 20 个等边三角形的面和一定数目的顶点,每个顶点上各有l个硼原子。通过观察图形及推算,此基本结构单元由 个硼原子构成, B— B 键的夹角为 ,有个 B—B 键。
7、已知 C3N4晶体具有比金刚石还大的硬度,且构成该晶体的粒子间只以单键结合,
下列关于 C3N4晶体的说法错误的是( )
A、该晶体属于原子晶体,其化学键比金刚石更牢固
B、该晶体中每个碳原子连接4个氮原子、每个氮原子连接3个碳原子
C、该晶体中碳原子和氮原子的最外层都满足8电子结构
D、该晶体与金刚石相似,原子间都是以非极性键形成的空间网状结构
8、2001 年报道硼和镁形成的化合物刷新了金属化合物超导温度的最高记录。图13—8 所示为该化合物的晶体结构单元:镁原子间形成正六棱柱,且棱柱的上下底面还各有l个镁原子; 6个硼原子位于棱柱内。则该化合物的化学式可表示为( )
9、最近发现一种由钛原子和碳原子构成的气态簇分子,如图13—9所示。顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式是( )
A、 Til4C13 B、Ti4C4 C、TiC D、Ti4C8
10、晶体具有规则的几何外形,晶体中最基本的重复单元称为晶胞。 NaCl 晶体结构如图 13—10 所示。已知 FexO晶体晶胞结构为NaCl型,由于晶体缺陷,x值小于1。测知 Fex 0 晶体密度,,晶胞边参为 4.28×10-10m。 ⑴ FexO中x值(精确至 0 . 01 )为
⑵晶体中的 re ”奋分别为 reZ ’、 Fe ,十,在 Fe , ’和 Fe , ‘的总数中, Fen+所占分数(用小数表示,精确至 0 . 001 )为 _。
⑶此晶体化学式为 '
⑷与某个Fe2+(或 Fe3+)距离最近且等距离的O2-围成的空间几何构型是 。
⑸在晶体中、铁元素的离子间最短距离为 m 。
11、—羧乙基锗倍半氧化物(即 Ge—132 )是与人
健康有关的最重要的有机锗化合物,其片层结构
如图 所示。每个结构相同的基团都是由6个锗
原子和6个氧原子构成的十二元环。每个锗原
子还同时与3个氧原子相连接,形成可以任意延
伸的片层。每个锗原子连接一个羧乙基
(—CH2CH2COOH) , 各片层间存在相互作用,连接
成三维网状结构。
⑴每个正六边形拥有个 锗原子, 个氧原子。
⑵试写出 Ge—132 的化学式
12、
PAGE
41
丁占华设计(2006年11月)
(一)高考要点:
一、化学键
1、定义:
①
②
2、化学反应的本质
3、化学键的类型:
⑴离子键
①
②
⑵共价键
①共价键的主要性质—键参数
项目 概念 对分子性质的影响
②共价键的类型:
A非极性键:
B、极性键:
C、配位键:
⑶金属键:
4、化学键的表示方法
⑴电子式
①
②
③
⑵结构式
5、常见物质的化学键:
二、非极性分子和极性分子
1、定义:
2、判断方法
⑴
⑵
3、
4、形似相溶原理
三、化学键与分子间作用力比较
1、分子间作用力:
⑴特征:
⑵应用:
⑶影响分子间作用力的大小的因素:
①
②
2、离子键和共价键的比较
3、化学键与分子间作用力比较
(二)典型例题:
例题1、( 2004 年上海)下列物质中属离子化合物的是( )
A、苛性钾 B、碘化氢 C、硫酸 D、醋酸
【变式题l】下列各组化合物中,化学键类型相同的是( )
例题2、( 2004 年江苏)下列各项中表示正确的是( )
【变式题2】下列电子式中,正确的是( )
例题3、( 2003 年江苏)下列分子中,原子的最外层电子稳定结构的是( )
【变式题3】 钡和钠相似,也能形成含O22-的过氧化物,下列叙述中错误的是( )
A、过氧化钡的化学式是 Ba202
B、1 mol 过氧化钡跟足量水反应生成 0.5 mol 氧气
C、
D、过氧化钠和过氧化钡都是强氧化剂
例题4、下列分子中,所有原子的最外层都满足 8 电子稳定结构的是( )
A、光气( COCl2 ) B、六氟化硫
C、二氟化氙 D、三氟化硼
【变式题4】 已知S、Cr 两元素的最高价均为+6价,则下列粒子中,从化合价
分析,可能存在过氧键(—O—0—)的是( )
例题5、(2004 年全国)下列分子有极性的是( )
A、CCl4 B、 C02 C、 NH3 D、C6H6
【变式题5】下列各组分子中,都是由极性键构成极性分子的是( )
A、CH3Cl与Cl2 B、NH3和H20
C、H2S与CS2 D、CO2与Hl
例题6、( 2004 年全国)下列分子中,所有原子不可能共处在同一平面上的是( ) A、C2H2 B、CS2 C、NH3 D、 C6H6
【变式题6】 NH3 分子的空间构型是三角锥型,而不是正三角形的平面结构,其充
分的理由是( )
A、NH3分子是极性分子 B、NH3 分子内3个N—H 键的键长相等,键角相等 C、 NH3分子内3 N—H 键的键长相等, 3 个键角都等于 107。18,
D、NH3分子内3个N—H 键的键长相等, 3 个键角都等于120。
例题7、( 2005 年北京春招模拟)以下关于分子力的说法,正确的是( )
A、分子间既存在引力也存在斥力
B、液体难于被压缩表明液体中分子力总是引力
C、气体分子之间总没有分子力的作用
D、扩散现象表明分子间不存在引力
【变式题7】 下列物质变化过程中所克服的粒子间作用力属同种类型的是( )
A、 I2受热升华和 NH3Cl 受热分解
B、SI02和NaCl的熔化
C、干冰升华和液氧的汽化
D、 Hl和 NH4Cl 受热分解
基础题型
1、下列关于化学键的说法中正确的是( )
A、组成单质的分子内一定含有共价键
B、由非金属元素组成的化合物不一定是共价化合物
C、非极性键只存在于双原子单质分子中
D、不同元素组成的多原子分子里的化学键一定为极性键
2、下列物质的变化过程中,有共价键被破坏的是( )
A、I2升华 B、NaCl熔融
C、HCl溶于水得盐酸 D、从 NH4HC03中闻到刺激性气味
3、下列表达方式错误的是( )
A、氨分子的电子式为 B、S2-结构示意图为
C、氧18原子的符号为188O D、C02分子的结构式为 O=C=O
4、下列含有极性键的非极性分子是( )
A、CH4 B、NH3 C、CO2 D、H20
5、下列说法正确的是( )
A、离子化合物中,各原子间都是以离子键结合的
B、共价化合物中,各原子间都是以共价键结合的
C、非极性分子中,各原子间都是以非极性键结合的
D、极性分子中,各原子间都是以极性键结合的
6、已知 CO2、BF3、CH4、S03都是非极性分子,NH3、H2S、H2O、S02都是极性分
子,由此可推出ABn型分子是非极性分子的经验规律正确的是 ( )
A、分子中所有原子都在同一平面内
B、分子中不含氢原子
C、在 ABn型分子中A元素为最高正价
D、在ABn型分子中A原子最外层的电子都已成键
7、科学家发现铂的两种化合物,a 为, b为
二者具有不同的特性,a 有抗癌作用,而 b 没有,则
(l) a 和 b 互为
A、同分异构体 B、同素异形体 C、同位素 D、同一物质
(2)在a和b分子中,Pt原子与 2个Cl及 2 个 N 原子形成的结构为
A、正四面体型 B、四面体型 C、平面型 D、直线型
8、硼氢化钠(NaBH4)是一种离子化合物,具有很强的还原性,被称为“万能”还原剂。
(l)硼氢化钠中的阴离子是 (用符号表示),其中B、H 两元素的化合价分别是 ;
(2)已知将 NaBH4放人水中,可以生成偏硼酸钠和氢气,表示这个反应的离子方程式是 ;
(3) NaBH4可以从含 Au3+的碱性溶液中回收黄金,其离子方程式是
。
9、已知磷酸分子 中的三个氢原子都可以跟重水分(D2O)
中的D原子发生氢交换,又知次磷酸(H3PO2)也可以跟D2O 进行氢交换,
但次磷酸二氢钠 (NaH2 PO2)却不再跟D2O 进行氢交换,由此可推断出
H3PO2 的分子结构为( )
10、已知在一个分子中,如果结构对称,即电荷分布是均匀的,该分子为非
极性分子;如果结构不对称,即电荷分布不均匀,该分子即为极性分子,
如H2O 的结构式为 ,电荷分布不均匀,为极性分子; CO2的结
构式为O=C=O,电荷分布均匀,为非极性分子。又知非极性分子易溶于
非极性分子中,极性分子易溶于极性分子中,又叫相似相溶原理。
RtCl2(NH3)2为平面正方形结构,它可以形成两种固体:一种为淡黄色,
在水中溶解度小;另一种为黄绿色,在水中溶解度大。请在以下划线处
内画出这两种固体分子的几何构型图 。黄绿色固体在
水中溶解度比淡黄色固体大,原因是 。
11、有X、Y、Z 三种元素,其中 X 的负价阴离子的原子核外电子排布和氙
的原子核外电子排布相同;Y有两种氧化物,其水溶液都呈碱性。在Y 的
两种氧化物中,Y 的质量分数分别为74.19%、58.97%,这两种氧化物
的摩尔质量分别是62g/ mol、78g/mol。在 X和Y化合生成物的水溶液
中滴入Z单质的水溶液,溶液由无色变为深黄色,Z和X在同一主族,
相差2个周期。
(1)写出三种元素的名称X ;Y ;Z
(2)Y的两种氧化物分别为 、 ;
(3) Z的单质溶于水,滴加到X和Y 形成的化合物的水液中,其反应的
离子方程式为(要求标明电子转移的方和总数)
(4)X与Y形成的化合物熔点比Z和Y 形成的化合物点 (填“高”
或“低) ;其原因是
(5)用电子式表示Y的质量分数为 58.97%的氧化物形成过程
12、若短周期中的两种元素可以形成原子个数比为2:3的化合物,则这两种
元素的原子序数之差不可能是
A、1 B、3 C、5 D、6
13、关于化学键的下列叙述中,正确的是( ).
A、离子化合物可能含共价键 B、共价化合物可能含离子键
C、离子化合物中只含离子键 D、共价化合物中不含离子键
第十二讲 化学键 非极性分子和极性分子
丁占华设计(2006年11月)
(一)高考要点:
一、晶体的类型与结构:
1、离子晶体:
⑴定义:
⑵构成微粒:
⑶作用力:
⑷注意:①
②
2、分子晶体:
⑴定义:
⑵构成微粒:
⑶作用力:
⑷注意:①
②
3、原子晶体:
⑴定义:
⑵构成微粒:
⑶作用力:
4、金属晶体:
⑴定义:
⑵构成微粒:
⑶作用力:
5、四种晶体的比较
二、晶体熔点、沸点比较及其规律
1、不同类型的晶体:
2、同一类型的晶体:
⑴原子晶体:
⑵离子晶体:
⑶金属晶体:
⑷分子晶体:
①
②
③
④
三、晶体类型的判断方法:
1、
2、
3、
4、
5、
四、晶体的几个特殊规律:
1、
2、
3、
4、
5、
6、
7、
五、晶体化学式的确定
1、均摊法:
均摊是指每个晶胞平均拥有的粒子数目。求晶体中粒子个数比的方法是: ⑴⑴处于顶点的粒子,
⑵处于棱上的粒子,
⑶处于面上的粒子,
⑷处于晶胞内部的粒子,
2、常见晶体的空间构型及质点数问题的分析:
⑴金刚石(原子晶体—如图 D 所示)
基本单元是正四面体。每一个碳原子与其他 4 个碳原子等距离紧邻,由共价键结合成的最小环状结构中有 6 个碳原子,但这 6 个碳原子不在同一平面上。
⑵石墨(混合型晶体―如图E所示)为层状结构。
每一层内由 6 个碳原子通过非极性键结合成的平面正六边形结构组成,其中每一个碳原子与其他3个碳原子等距离紧邻,即每个碳原子为三个六边形共用,故同一平面中备任何一个六边形占据了该六边形中的每一个碳原子的,因此,每一个六边形占有的碳原子数为6×= 2 个。
⑶石英—二氧化硅(原子晶体)
晶体中重复单元是硅氧四面体。每一个硅原子紧邻 4 个氧原子,每一个氧原子紧邻 2 个硅原子,形成了由 Si—O 极性键构成十二元环的最小环状结构。与金刚石相同,十二元环中的 6 个硅原子和 6 个氧原子不在同一平面上。
⑷氯化钠(离子晶体―如图A 所示)
晶体内重复单元为简单立方。每一个 Na+紧邻 6个Cl-,每个 Cl-又紧邻6个Na+若从正方形的对角线观察,与每一个 Na+等距离围绕的且又最近的Na+为 12 个;同理,与每一个 Cl-等距离围绕的且又最近的 Cl-为 12 个。
典型例题
例题1、有关晶体的下列说法正确的是
A、晶体中分子间作用力越大,分子越稳定
B、原子晶体中共价键越强,熔点越高
C、冰融化成水分子时,共价键发生断列
D、氯化钠融化时,离子键未被破坏
例题2、(2 004 年广东) X是核外电子数最少的兀素,Y是地壳中含量最丰富的元素,Z在地壳中的含量仅次于Y, W可以形成自然界最硬的原子晶体, 下列叙述错误的是( )
A、 WX4是沼气的主要成分 B、固态X2Y是分子品体
C、ZW是原子晶体 D、ZY2的水溶液俗称“水玻璃”
【变式题2】氢叠氮酸(HN3)与醋酸酸性相近,其盐稳定,但遭撞击可迅速分解生
成氮气,有关氢叠氮酸的叙述有
例题3、下列各组物质中,按熔点由低到高的顺序排列正确的是( )
【变式题3】已知几种物质的熔点和沸点(℃)
例题4、水的状态除了气态、液态和固态外,还有玻璃态。它是由液态水急速冷却
到165K时形成的。玻璃态的水无固定形状,不存在晶体结构,且密度与普
通液态水相同,有关玻璃态水的叙述中正确的是( )
A、水由液态变为玻璃态,体积缩小 B、水由液态变为玻璃态,体积膨胀
C、玻璃态是水的一种特殊状态 D、玻璃态水是分子晶体
【变式题4】 用激光将置于铁室中石墨靶上的碳原子炸松,同时用射频电火喷射
氮气,此时碳、氮原子结合成碳氮化合物薄膜,这种化合物比金刚石更坚
硬,其原因可能是 ( )
A、碳、氮原子构成平面网状结构的晶体
B、碳、氮单质的化学性质均不活泼
C、碳氮键比金刚石中的碳碳键更短
D、氮原子最外层电子数比碳原子多
例题5、(2005年黄冈模拟)下列说法中正确的是( )
A、含有化学键的纯净物一定是化合物
B、离子晶体中一定有离子键
C、由不同种原子所形成的纯净物一定是化合物
D、分子晶体中一定不含离子键哑函
例题6、⑴如图所示为固态 C02的晶体结构示意图。
通过观察分析,可得出每个 CO2分子周围
与之紧邻等距的C02分子有 个。
⑵试判断: ① SiO2 ② C02 CS2晶体的熔
点由高到低排列的顺序是 (填相应物质的编号)。
基础题型:
1、下列晶体中均为分子晶体的是
2、氮化硅是一种新制得的无机非金属材料,它是一种超硬、耐磨、耐高温的物质。
下列各组物质熔化时,所克服粒子间的相互作用与氮化硅熔化时所克服粒子间
的相互作用都相同的是( )
A、碘和白磷 B、硫和硅晶体 C、碳化硅和水晶 D、硝酸钾和氧化镁
3、SiCl4的分子结构与 CCl2类似,对其作出如下推测,其中不正确的是( )
A、SiCl4晶体是分子晶体 B、常温、常压下SiCl4是气体
C、SiCl4的分子是由极性键形成的非极性分子 D、SiCl4熔点高于C Cl4
4、某离子晶体结构如图所示, X (○表示)位于立方体的顶点,Y(○表示)位于
立方体的中心。该晶体的化学式应为( )
5、图是氯化钠晶体的结构示意图,其中,
与每个Na+距离最近且等距离的几个Cl-
所围成的空间的构型为( )
A、正四面体
B、正六面体
C、正八面体
D、三角锥
6、单质硼有无定形体和晶体两种,参考下表数据。
⑴晶体硼的晶体类型属于 晶体,理由是
⑵已知晶体硼的基本结构单元是由硼原子组成的正二十面体(如图所示),其中有 20 个等边三角形的面和一定数目的顶点,每个顶点上各有l个硼原子。通过观察图形及推算,此基本结构单元由 个硼原子构成, B— B 键的夹角为 ,有个 B—B 键。
7、已知 C3N4晶体具有比金刚石还大的硬度,且构成该晶体的粒子间只以单键结合,
下列关于 C3N4晶体的说法错误的是( )
A、该晶体属于原子晶体,其化学键比金刚石更牢固
B、该晶体中每个碳原子连接4个氮原子、每个氮原子连接3个碳原子
C、该晶体中碳原子和氮原子的最外层都满足8电子结构
D、该晶体与金刚石相似,原子间都是以非极性键形成的空间网状结构
8、2001 年报道硼和镁形成的化合物刷新了金属化合物超导温度的最高记录。图13—8 所示为该化合物的晶体结构单元:镁原子间形成正六棱柱,且棱柱的上下底面还各有l个镁原子; 6个硼原子位于棱柱内。则该化合物的化学式可表示为( )
9、最近发现一种由钛原子和碳原子构成的气态簇分子,如图13—9所示。顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式是( )
A、 Til4C13 B、Ti4C4 C、TiC D、Ti4C8
10、晶体具有规则的几何外形,晶体中最基本的重复单元称为晶胞。 NaCl 晶体结构如图 13—10 所示。已知 FexO晶体晶胞结构为NaCl型,由于晶体缺陷,x值小于1。测知 Fex 0 晶体密度,,晶胞边参为 4.28×10-10m。 ⑴ FexO中x值(精确至 0 . 01 )为
⑵晶体中的 re ”奋分别为 reZ ’、 Fe ,十,在 Fe , ’和 Fe , ‘的总数中, Fen+所占分数(用小数表示,精确至 0 . 001 )为 _。
⑶此晶体化学式为 '
⑷与某个Fe2+(或 Fe3+)距离最近且等距离的O2-围成的空间几何构型是 。
⑸在晶体中、铁元素的离子间最短距离为 m 。
11、—羧乙基锗倍半氧化物(即 Ge—132 )是与人
健康有关的最重要的有机锗化合物,其片层结构
如图 所示。每个结构相同的基团都是由6个锗
原子和6个氧原子构成的十二元环。每个锗原
子还同时与3个氧原子相连接,形成可以任意延
伸的片层。每个锗原子连接一个羧乙基
(—CH2CH2COOH) , 各片层间存在相互作用,连接
成三维网状结构。
⑴每个正六边形拥有个 锗原子, 个氧原子。
⑵试写出 Ge—132 的化学式
12、
PAGE
41
同课章节目录
