考前重点热点题型[下学期]
图片预览











文档简介
课件32张PPT。2006年高考化学考前重点热点题型 龙游中学考前辅导课件高考重要考点一:有关阿伏加德罗常数的计算1、NA代表阿伏加德罗常数值,下列说法正确的是( )
(A)9g重水所含有的电子数为5NA
(B)1molMgCl2中含有离子数为NA
(C)7.1g氯气与足量NaOH溶液反应转移的电子数为0.2NA
(D)1molC10H22分子中共价键总数为31NA D 2、下列有关阿伏加德罗常数的叙述正确的是( )
(A)17g OH-含有9×6.02×1023个电子
(B)标准状况下,0.5×6.02×1023个甲醛分子所占体积约是11.2L
(C)106g碳酸钠固体中含有6.02×1023个阴离子
(D)标准状况下,含4molHCl的浓盐酸与足量MnO2反应可生成22.4LCl2BC3、下列有关阿伏加德罗常数的叙述正确的是( )
(A)1mol Na2O2与足量水蒸气反应转移电子数为2×6.02×1023个
(B)1mol碳酸钠溶于水所得溶液中所含阴离子数大于0.1×6.02×1023个
(C)25℃时,1g水中约含有6.02×1013个OH-
(D)1molSiO2晶体中约含2×6.02×1023个Si-O键4、下列有关阿伏加德罗常数的叙述正确的是( )
(A)标准状况下,以任意比混合的甲烷和丙烷混合气体22.4L所含
分子数为NA个
(B)1mol冰醋酸中含有6.02×1023个CH3COO-
(C)电解饱和食盐水时,每得到1molNaOH,在阳极反应的离子就
得到1mol电子
(D)标准状况下,1L辛烷完全燃烧后所生成气态产物的分子数为A高考重要考点一:有关阿伏加德罗常数的计算BC高考重要考点二:氧化还原反应 (包括氧化还原反应的基本概念;氧化性还原性强弱的判断;
根据得失电子守恒推断氧化产物或还原产物;配平氧化还原
反应的方程式并标出电子转移的方向和数目)5、常温下,在溶液中可以发生反应:X+2Y3+ =2Y2+ + X2+,则下列叙述
①X被氧化;②X是氧化剂;③X具有还原性;④Y2+是氧化产物;⑤
Y2+具有还原性;⑥Y3+的氧化性比X2+的氧化性强。以下叙述中正确
的是( )
(A)②④⑥ (B)①③④ (C)①③⑤⑥ (D)②⑤C6、已知 I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中
还原性的强弱顺序为 Cl-< Fe2+< H2O2 < I-< SO2,则下列反应不
能发生的是( )
(A)2Fe3+ + SO2 +2H2O = 2Fe2+ +SO42- +4H+
(B)I2 + SO2 + 2H2O = H2SO4 + 2HI
(C)H2O2 + H2SO4 = SO2 + O2 + 2H2O
(D)2Fe2+ + I2 = 2Fe3+ + 2I-高考重要考点二:氧化还原反应 7、某FeCl2 溶液中混有FeI2杂质,根据已知反应:
①2FeCl3 +2KI = 2FeCl2 + 2KCl + I2;②2FeCl2 + Cl2 = 2FeCl3
③F2 + 2KI(固)= 2KF + I2中的有关事实,要除去其中的FeI2,
应选用的试剂是( )
(A)F2 (B)过量Cl2 (C)FeCl3 (D)FeCl2CDC8、24mL0.05mol/L的Na2SO3溶液恰好与20mL0.02mol/L的K2Cr2O7溶液
恰好完全反应,则在还原产物中铬元素的化合价是( )
(A)+6 (B)+3 (C)+2 (D)0
9、羟胺(NH2OH)是一种还原剂,能将某些氧化剂还原。现用25.00mL
0.049mol/L的羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,
生成的Fe2+恰好与24.65mL 0.020mol/L的KMnO4酸性溶液完全作用(已
知:FeSO4 + KMnO4 + H2SO4 = Fe2(SO4)3 + K2SO4 + MnSO4 + H2O(
未配平),则在上述反应中,羟胺的氧化产物是( )
(A)N2 (B)N2O (C)NO (D)NO2高考重要考点二:氧化还原反应 BB高考重要考点三:热化学方程式的书写及正误判断;
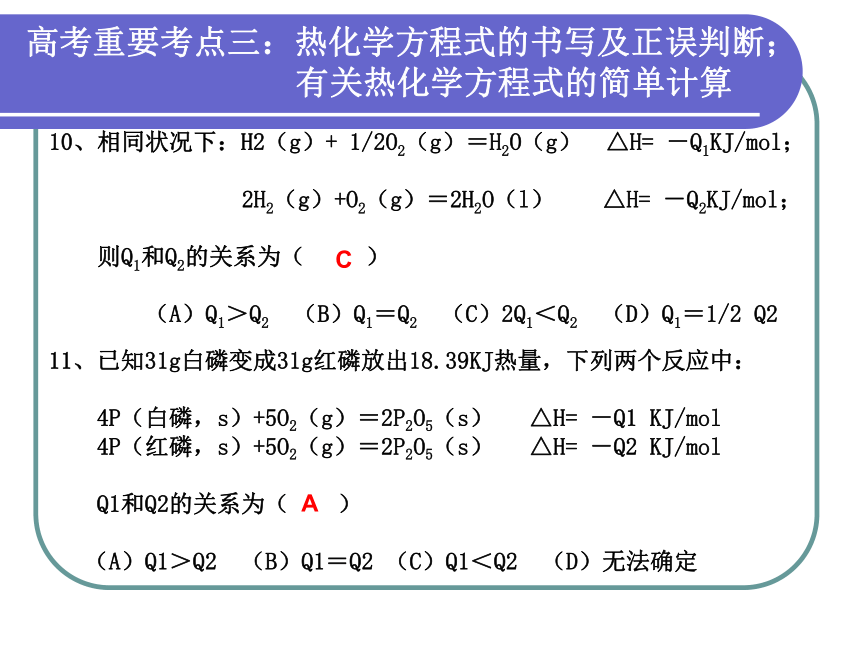
有关热化学方程式的简单计算10、相同状况下:H2(g)+ 1/2O2(g)=H2O(g) △H= -Q1KJ/mol;
2H2(g)+O2(g)=2H2O(l) △H= -Q2KJ/mol;
则Q1和Q2的关系为( )
(A)Q1>Q2 (B)Q1=Q2 (C)2Q1<Q2 (D)Q1=1/2 Q2 11、已知31g白磷变成31g红磷放出18.39KJ热量,下列两个反应中:
4P(白磷,s)+5O2(g)=2P2O5(s) △H= -Q1 KJ/mol
4P(红磷,s)+5O2(g)=2P2O5(s) △H= -Q2 KJ/mol
Q1和Q2的关系为( )
(A)Q1>Q2 (B)Q1=Q2 (C)Q1<Q2 (D)无法确定CA12、已知1g氢气燃烧生成液态水放出142.9KJ的热量,
则反应的热化学方程式为( )
(A)2H2(g)+O2(g)=2H2O(l) △H= -142.9KJ/mol
(B)2H2(g)+O2(g)=2H2 O(l) △H= -571.6KJ/mol
(C)2H2 + O2 = 2H2O △H= -571.6KJ/mol
(D)2H2(g)+O2(g)=2H2O(l) △H= +571.6KJ/mol高考重要考点三:热化学方程式的书写及正误判断;
有关热化学方程式的简单计算B高考重要考点四:离子方程式的书写及正误判断13、下列反应的离子方程式正确的是( )
(A)碳酸钙跟醋酸溶液反应:CaCO3 + 2H+ = Ca2+ + 2H2O + CO2↑
(B)澄清石灰水跟盐酸反应:H+ + OH= = H2O
(C)铜片跟稀硝酸反应:Cu + NO3- + 4H+ = Cu2+ + NO↑+ 2H2O
(D)碳酸氢钠溶液与足量的氢氧化钡溶液混合:
Ba2+ + 2OH- + 2HCO3- = BaCO3↓ + CO32- + 2H2O14、下列反应的离子方程式正确的是( )
(A)金属钠跟水反应:Na+2H2O=Na++2OH—+H2↑
(B)在漂白粉溶液中通入过量SO2 :ClO- +SO2+H2O=HSO3- +HClO
BD15、下列离子方程式错误的是
(A)将少量SO2气体通入NaClO溶液中
SO2+2ClO-+H2O = SO32- + 2HClO
(B)在硫酸氢钾溶液中加入Ba(OH)2溶液至pH=7
2H+ +SO42- +Ba2+ +2OH- = BaSO4↓+2H2O
(C)小苏打溶液和甲酸混合
HCO3- +HCOOH = HCOO-+CO2↑+H2O
(D)澄清石灰水与少量小苏打溶液混合:Ca2+十OH-+HCO3-==CaCO3↓+H2O高考重要考点四:离子方程式的书写及正误判断A
高考重要考点五:判断溶液中的离子能否大量共存16、某溶液中加入金属铝有氢气放出,则在此溶液中可能大量
共存的离子是( )
(A)K+、Mg2+、NO3-、SO42- (B)K+、Na+、Cl-、HCO3-
(C)K+、Na+、AlO2-、SO42- (D)K+、NH4+、Cl-、CO32-17、下列各组离子中,因发生氧化还原反应而不能大量
共存的是( )
(A)Fe3+、H+、SO42-、ClO- (B)Fe3+、Fe2+、SO42-、NO3-
(C)Al3+、Na+、SO42-、CO32- (D)K+ 、H+、Cl-、MnO4- CD高考重要考点六:元素周期律 物质结构 ① 原子序数、核电荷数、质子数、中子数、核外电子数
及质量数之间的相互关系;
质量数、原子的原子量及元素的原子量的区别与联系
③元素周期表中各主族元素的性质及其递变规律;
④微粒半径大小的比较(主要是与原子序数之间的关系)
⑤化学键类型和晶体类型的判断
⑥电子式的书写(关键在于掌握书写方法,以能够写出
陌生物质的电子式)。18、已知元素X、Y的核电荷数分别是a和b,它们的离子Xm+ 和Yn-的核
外电子排布相同,则下列关系式中正确的是( )
(A)a=b+m+n(B)a=b-m+n(C)a=b+m-n(D)a=b-m-n19、科学家最近制造出第112号新元素,其原子的质量数为277,这是
迄今已知元素中最重的原子,关于该元素的下列叙述正确的是
( )
(A)其原子核内中子数和质子数都是112
(B)其原子核内中子数为165,核外电子数为112
(C)其原子质量是12C原子质量的277倍
(D)其原子质量与12C原子质量之比为277∶12高考重要考点六:元素周期律 物质结构 A BD高考重要考点六:元素周期律 物质结构 20、设某元素原子核内的质子数为m,中子数为n,则下列论述正确的是
( )
(A)不能由此确定该元素的原子量
(B)这种元素的原子量为(m+n)
(C)若碳原子的质量为w g,此原子的质量为(m+n)w g
(D)核内中子的总质量小于质子的总质量21、若短周期中的两种元素可以形成原子个数比为2∶3化合物,
则这两种元素的原子序数之差不可能是( )
(A)1 (B)3 (C)5 (D)6AD高考重要考点六:元素周期律 物质结构 22、X元素的阳离子和Y元素的阴离子具有与氩原子相同的电子层结构,
下列叙述正确的是( )
(A)X的原子序数比Y的小 (B)X原子的最外层电子数比Y的大
(C)X的原子半径比Y的大 (D)X元素的最高正价比Y的小23、X、Y、Z、W四种主族元素,若X的阳离子与Y的阴离子具有相同的
电子层结构;W的阳离子的氧化性强于等电荷数的X 阳离子的氧化
性;Z阴离子半径大于等电荷数的Y的阴离子半径,则四种元素的原
子序数由大到小的顺序是( )
(A)Z X Y W (B)W X Y Z (C)X Y Z W (D)Z Y X W24、下列各组物质气化或熔化时,所克服的微粒间的作用(力),属同种
类型的是( )
(A)碘和干冰的升华 (B)二氧化硅和生石灰的熔化
(C)氯化钠和铁的熔化 (D)苯和已烷的蒸发 CD A AD高考重要考点六:元素周期律 物质结构 25、下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是
( )
(A)SO2和SiO2(B)CO2和H2O(C)NaCl和HCl(D)CCl4和KCl26、下列分子中所有原子都满足最外层8电子结构的是( )
(A)光气(COCl2)(B)六氟化硫 (C)二氟化氙(D)三氟化硼B A 高考重要考点七:溶解度的基本知识;
有关饱和溶液溶解度的计算27、在质量为200克的饱和石灰水中,加入5.60克CaO后充分搅
拌,仍保持原来的温度,则下列叙述正确的是( )
(A)石灰水下部有白色固体7.40克
(B)石灰水下部白色固体质量大于7.40克
(C)石灰水的浓度和质量均不会变化
(D)石灰水的质量将会减少,石灰水的pH不会发生变化28、t℃时某盐饱和溶液的浓度为26.8%,取一定量的此饱和溶液,
向其中加入w克无水盐。在t℃时,析出m克含结晶水的该盐的
晶体,则从饱和溶液中析出的溶质的质量为( )
(A) m×26.8% (B) m-w
(C)(w+ m)×26.8% (D)(m-w)×26.8%BDD高考重要考点七:溶解度的基本知识;
有关饱和溶液溶解度的计算29、在一定温度下,物质M的溶解度为A克。向(100+A)克物质M
的饱和溶液中加入A克M,析出带一定结晶水的晶体B克,现取
出B克结晶水合物加水配成相同温度下的饱和溶液,需加水的
质量为( )
(A)100克(B)大于100克(C)小于100克(D)(100+A)克30、t℃时,把一定质量的硝酸钾溶液分成两等份,一份恒温蒸发掉10克
水析出1克硝酸钾晶体,另一份恒温蒸发掉15克水,析出2克硝酸钾
晶体,下列说法错误的是( )
(A)t℃时,若将原溶液恒温蒸发掉25克水,可析出3克硝酸钾晶体
(B)t℃时,若原溶液中再加入2克硝酸钾晶体便成为饱和溶液
(C)t℃时,硝酸钾的溶解度为20克
(D)t℃时,原硝酸钾溶液的质量分数为12% A D高考重要考点七:溶解度的基本知识;
有关饱和溶液溶解度的计算31、硝酸钾在不同温度时的溶解度如下表: 现有60℃时硝酸钾的饱和溶液105克,要得到39.2克晶体,应将溶液冷却到 ℃。32、在某温度下,向25%的硫酸镁饱和溶液中加入1克无水硫酸镁,可
析出3.15克 MgSO4·nH2O,则n值为 。207高考重要考点八:化学反应速率与化学平衡 ①平均反应速率的计算
②外因对化学反应速率及化学平衡的影响
③化学平衡状态的标志
④相同平衡状态的建立
⑤化学平衡移动图象的处理
⑥有关化学平衡的简单计算 高考重要考点八:化学反应速率与化学平衡 33、反应N2(g)+3H2(g) 2NH3(g)在密闭容器中进行,分别用N2、H2、
NH3三种物质在单位时间内浓度的变化表示该反应的速率V(N2)、V(H2)、
V(NH3),则三者之间的关系正确的是( )
(A)V(N2)=V(NH3) (B)3V(H2)=2V(NH3)
(C)V(NH3)=V(H2) (D)V(H2)=3V(N2) 34、将2molSO2, 1molO2充入带活塞的密闭容器中,发生反应
2SO2(g)+ O2(g) 2 SO3(g),达到平衡后,改变下列条件,
SO3的平衡浓度不改变的是( )
(A)保持温度和容器的压强不变,充入1mol SO3(g)
(B)保持温度和容器的容积不变,充入1mol SO3(g)
(C)保持温度和容器的压强不变,充入1mol O2(g)
(D)保持温度和容器的压强不变,充入1mol Ar(g)CDA35、可逆反应:2NO2 2NO+O2在定容密闭容器中反应,达到平衡状态的
标志是( )
①单位时间内生成n molO2的同时生成2 nmolNO2
②单位时间内生成n molO2的同时生成2 nmolNO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率之比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
(A)①④⑥ (B)②③⑤ (C)①③④ (D)①②③④⑤⑥高考重要考点八:化学反应速率与化学平衡 36、在一恒定的容器中充入2 mol A和1 mol B发生反应:2A(g)+
B(g) x C(g),达到平衡后,C的体积分数为W%;若维持容
器的容积和温度不变,按起始物质的量A:0.6 mol、B:0.3
mol、C:1.4 mol充入容器,达到平衡后,C的体积分数仍为
W%,则x值为( )
A.只能为2 B.只能为3 C.可能是2,也可能是3 D.无法确定A A 37、在体积、温度都相同的条件下有如下反应:2A(气)+2B(气)
C(气)+3D(气)。现分别从两条途径建立平衡:
(Ⅰ)A、B的起始物质的量均为2mol;
(Ⅱ)C、D的起始物质的量分别为2mol和6mol。以下叙述正确的
是( )
(A)Ⅰ、Ⅱ两途径最终达到平衡时,体系内混合气体的百分组成
相同
(B)Ⅰ、Ⅱ两途径最终达到平衡时,体系内混合气体的百分组成
不同
(C)达到平衡时,Ⅰ途径的反应速率vA等于Ⅱ途径的反应速率vD
(D)达到平衡时,Ⅰ途径所得混合气体的密度为Ⅱ途径所得混合
气体密度的1/2 高考重要考点八:化学反应速率与化学平衡 AD高考重要考点八:化学反应速率与化学平衡 38、右图表示可逆反应A(g)+B(g) nC(g) ΔH<0,在不同条件下反
应混合物中C的百分含量和反应过程所需时间的关系曲线,有关叙
述一定正确的是( )
(A)a表示有催化剂,而b无催化剂
(B)若其他条件相同,a比b的温度高
(C)若其他条件相同,a比b的压强大,n>2
(D)反应由逆反应方向开始 39、在10℃和200KPa的条件下,反应aA(g) dD(g)+eE(g)建立平
衡后,再逐步增大体系的压强(温度维持不变),下表列出不
同压强下反应建立平衡时物质D的浓度:BC高考重要考点八:化学反应速率与化学平衡 根据表中数据,回答下列问题:
(1)压强从200KPa增大到500KPa时,平衡向 反应方向移动
(填“正”或“逆”),其理由是 。
(2)压强从500KPa增加到1000KPa,平衡向 反应方向移动
(填“正”或“逆”),其理由是 。平衡之所
以向该方向移动,这是由于 。高考重要考点八:化学反应速率与化学平衡 答案:(1)平衡向逆反应方向移动,理由是D浓度增大的倍数(),小于压强增大的倍数( ),平衡之所以向该方向移动,是由于压强的增大,产物
之一可能转化为固体或液体物质。
(2)平衡向正反应方向移动,理由是D浓度增大的倍数(),小于压强增大的倍数()高考重要考点九:弱电解质的电离平衡40、pH相同的盐酸和醋酸溶液分别和锌反应,若最后锌都已完全溶
解,但放出的气体一样多,则下列判断正确的是( )
(A)整个反应阶段平均反应速率:醋酸>盐酸
(B)反应所需时间:醋酸>盐酸
(C)参加反应的锌的质量:醋酸=盐酸
(D)开始反应速率:盐酸>醋酸AC高考重要考点十:水的电离和溶液的pH的简单计算41、在0.01mol/L硫酸溶液中,水电离出的H+浓度是( )
(A)1×10-12mol/L (B)0.02mol/L
(C)1×10-7mol/L (D)5×10-13mol/L42、重水(D2O)的离子积为1.6×10-15,可以用pH一样的
定义来规定pD= -lg[D+],以下关于pD的叙述正确的是
( )
(A)中性溶液的pD=7.0
(B)含0.01mol NaOD的D2O溶液1L,其pD=12.0
(C)溶解0.01molDCl的D2O溶液1L,其pD=2.0
(D)在100mL0.25mol/L的DCl重水溶液中,加入
50mL0.2mol/LNaOD的重水溶液,其pD=1.0DCD高考重要考点十一: 盐类的水解及
离子浓度大小的比较43、将0.1mol下列物质置于1L水中充分搅拌,溶液中阴离子数最多的是
( )
(A)KCl (B)Mg(OH)2 (C)Na2CO3 (D)MgSO444、已知一种[H+]=1×10-3mol/L的酸和一种[OH-] = 1×10-3mol/ L
的碱溶液等体积混合后溶液呈酸性,其原因可能是
( )
(A)浓的强酸和稀的强碱溶液反应
(B)浓的弱酸和稀的强碱溶液反应
(C)等浓度的强酸与弱碱溶液反应
(D)生成了一种强酸弱碱盐 C B 高考重要考点十一: 盐类的水解及
离子浓度大小的比较45、将0.2 mol·L-1HCN溶液和0.1 mol·L-1的NaOH溶液等体积混合后,
溶液显碱性,下列关系中正确的是( )
(A)c(HCN)< c(CN-) (B)c(Na+)>c(CN-)
(C)c(HCN) - c(CN-)= c(OH-) (D)c(HCN)+ c(CN-)=0.1mol·L-146、将pH=2的盐酸和pH=12的氨水等体积混合后,溶液中浓度关系
正确的是( )
(A)c(NH4+)> c (Cl-)> c (H+)> c (OH-)
(B)c (Cl-)> c (NH4+)> c (OH-)> c (H+)
(C)c (NH4+)> c (Cl-)> c (OH-)> c (H+)
(D)c (Cl-)> c (NH4+)> c (H+)> c (OH-)BDC高考重要考点十二:电化学部分常见题型:
①原电池的基本原理
②原电池正负极的判断
③设计原电池,实现某一给定的反应
④原电池电极反应式的书写
⑤电极反应产物的计算(可能会结合生活中的电池或
一些新型电池对2、3、4点内容加以考查)高考重要考点十二:电化学部分47、一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,
然后分别向两极通入乙烷和氧气,其总反应为:2C2H6 +7O2
+8KOH====4K2CO3+10H2O,有关此电池的推断正确的是
( )
A.负极反应为14H2O+7O2+28e- =28OH-
B.放电一段时间后,负极周围的pH升高
C.每消耗1 mol C2H6 ,则电路上转移的电子为14 mol
D.放电过程中KOH的物质的量浓度不变C
(A)9g重水所含有的电子数为5NA
(B)1molMgCl2中含有离子数为NA
(C)7.1g氯气与足量NaOH溶液反应转移的电子数为0.2NA
(D)1molC10H22分子中共价键总数为31NA D 2、下列有关阿伏加德罗常数的叙述正确的是( )
(A)17g OH-含有9×6.02×1023个电子
(B)标准状况下,0.5×6.02×1023个甲醛分子所占体积约是11.2L
(C)106g碳酸钠固体中含有6.02×1023个阴离子
(D)标准状况下,含4molHCl的浓盐酸与足量MnO2反应可生成22.4LCl2BC3、下列有关阿伏加德罗常数的叙述正确的是( )
(A)1mol Na2O2与足量水蒸气反应转移电子数为2×6.02×1023个
(B)1mol碳酸钠溶于水所得溶液中所含阴离子数大于0.1×6.02×1023个
(C)25℃时,1g水中约含有6.02×1013个OH-
(D)1molSiO2晶体中约含2×6.02×1023个Si-O键4、下列有关阿伏加德罗常数的叙述正确的是( )
(A)标准状况下,以任意比混合的甲烷和丙烷混合气体22.4L所含
分子数为NA个
(B)1mol冰醋酸中含有6.02×1023个CH3COO-
(C)电解饱和食盐水时,每得到1molNaOH,在阳极反应的离子就
得到1mol电子
(D)标准状况下,1L辛烷完全燃烧后所生成气态产物的分子数为A高考重要考点一:有关阿伏加德罗常数的计算BC高考重要考点二:氧化还原反应 (包括氧化还原反应的基本概念;氧化性还原性强弱的判断;
根据得失电子守恒推断氧化产物或还原产物;配平氧化还原
反应的方程式并标出电子转移的方向和数目)5、常温下,在溶液中可以发生反应:X+2Y3+ =2Y2+ + X2+,则下列叙述
①X被氧化;②X是氧化剂;③X具有还原性;④Y2+是氧化产物;⑤
Y2+具有还原性;⑥Y3+的氧化性比X2+的氧化性强。以下叙述中正确
的是( )
(A)②④⑥ (B)①③④ (C)①③⑤⑥ (D)②⑤C6、已知 I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中
还原性的强弱顺序为 Cl-< Fe2+< H2O2 < I-< SO2,则下列反应不
能发生的是( )
(A)2Fe3+ + SO2 +2H2O = 2Fe2+ +SO42- +4H+
(B)I2 + SO2 + 2H2O = H2SO4 + 2HI
(C)H2O2 + H2SO4 = SO2 + O2 + 2H2O
(D)2Fe2+ + I2 = 2Fe3+ + 2I-高考重要考点二:氧化还原反应 7、某FeCl2 溶液中混有FeI2杂质,根据已知反应:
①2FeCl3 +2KI = 2FeCl2 + 2KCl + I2;②2FeCl2 + Cl2 = 2FeCl3
③F2 + 2KI(固)= 2KF + I2中的有关事实,要除去其中的FeI2,
应选用的试剂是( )
(A)F2 (B)过量Cl2 (C)FeCl3 (D)FeCl2CDC8、24mL0.05mol/L的Na2SO3溶液恰好与20mL0.02mol/L的K2Cr2O7溶液
恰好完全反应,则在还原产物中铬元素的化合价是( )
(A)+6 (B)+3 (C)+2 (D)0
9、羟胺(NH2OH)是一种还原剂,能将某些氧化剂还原。现用25.00mL
0.049mol/L的羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,
生成的Fe2+恰好与24.65mL 0.020mol/L的KMnO4酸性溶液完全作用(已
知:FeSO4 + KMnO4 + H2SO4 = Fe2(SO4)3 + K2SO4 + MnSO4 + H2O(
未配平),则在上述反应中,羟胺的氧化产物是( )
(A)N2 (B)N2O (C)NO (D)NO2高考重要考点二:氧化还原反应 BB高考重要考点三:热化学方程式的书写及正误判断;
有关热化学方程式的简单计算10、相同状况下:H2(g)+ 1/2O2(g)=H2O(g) △H= -Q1KJ/mol;
2H2(g)+O2(g)=2H2O(l) △H= -Q2KJ/mol;
则Q1和Q2的关系为( )
(A)Q1>Q2 (B)Q1=Q2 (C)2Q1<Q2 (D)Q1=1/2 Q2 11、已知31g白磷变成31g红磷放出18.39KJ热量,下列两个反应中:
4P(白磷,s)+5O2(g)=2P2O5(s) △H= -Q1 KJ/mol
4P(红磷,s)+5O2(g)=2P2O5(s) △H= -Q2 KJ/mol
Q1和Q2的关系为( )
(A)Q1>Q2 (B)Q1=Q2 (C)Q1<Q2 (D)无法确定CA12、已知1g氢气燃烧生成液态水放出142.9KJ的热量,
则反应的热化学方程式为( )
(A)2H2(g)+O2(g)=2H2O(l) △H= -142.9KJ/mol
(B)2H2(g)+O2(g)=2H2 O(l) △H= -571.6KJ/mol
(C)2H2 + O2 = 2H2O △H= -571.6KJ/mol
(D)2H2(g)+O2(g)=2H2O(l) △H= +571.6KJ/mol高考重要考点三:热化学方程式的书写及正误判断;
有关热化学方程式的简单计算B高考重要考点四:离子方程式的书写及正误判断13、下列反应的离子方程式正确的是( )
(A)碳酸钙跟醋酸溶液反应:CaCO3 + 2H+ = Ca2+ + 2H2O + CO2↑
(B)澄清石灰水跟盐酸反应:H+ + OH= = H2O
(C)铜片跟稀硝酸反应:Cu + NO3- + 4H+ = Cu2+ + NO↑+ 2H2O
(D)碳酸氢钠溶液与足量的氢氧化钡溶液混合:
Ba2+ + 2OH- + 2HCO3- = BaCO3↓ + CO32- + 2H2O14、下列反应的离子方程式正确的是( )
(A)金属钠跟水反应:Na+2H2O=Na++2OH—+H2↑
(B)在漂白粉溶液中通入过量SO2 :ClO- +SO2+H2O=HSO3- +HClO
BD15、下列离子方程式错误的是
(A)将少量SO2气体通入NaClO溶液中
SO2+2ClO-+H2O = SO32- + 2HClO
(B)在硫酸氢钾溶液中加入Ba(OH)2溶液至pH=7
2H+ +SO42- +Ba2+ +2OH- = BaSO4↓+2H2O
(C)小苏打溶液和甲酸混合
HCO3- +HCOOH = HCOO-+CO2↑+H2O
(D)澄清石灰水与少量小苏打溶液混合:Ca2+十OH-+HCO3-==CaCO3↓+H2O高考重要考点四:离子方程式的书写及正误判断A
高考重要考点五:判断溶液中的离子能否大量共存16、某溶液中加入金属铝有氢气放出,则在此溶液中可能大量
共存的离子是( )
(A)K+、Mg2+、NO3-、SO42- (B)K+、Na+、Cl-、HCO3-
(C)K+、Na+、AlO2-、SO42- (D)K+、NH4+、Cl-、CO32-17、下列各组离子中,因发生氧化还原反应而不能大量
共存的是( )
(A)Fe3+、H+、SO42-、ClO- (B)Fe3+、Fe2+、SO42-、NO3-
(C)Al3+、Na+、SO42-、CO32- (D)K+ 、H+、Cl-、MnO4- CD高考重要考点六:元素周期律 物质结构 ① 原子序数、核电荷数、质子数、中子数、核外电子数
及质量数之间的相互关系;
质量数、原子的原子量及元素的原子量的区别与联系
③元素周期表中各主族元素的性质及其递变规律;
④微粒半径大小的比较(主要是与原子序数之间的关系)
⑤化学键类型和晶体类型的判断
⑥电子式的书写(关键在于掌握书写方法,以能够写出
陌生物质的电子式)。18、已知元素X、Y的核电荷数分别是a和b,它们的离子Xm+ 和Yn-的核
外电子排布相同,则下列关系式中正确的是( )
(A)a=b+m+n(B)a=b-m+n(C)a=b+m-n(D)a=b-m-n19、科学家最近制造出第112号新元素,其原子的质量数为277,这是
迄今已知元素中最重的原子,关于该元素的下列叙述正确的是
( )
(A)其原子核内中子数和质子数都是112
(B)其原子核内中子数为165,核外电子数为112
(C)其原子质量是12C原子质量的277倍
(D)其原子质量与12C原子质量之比为277∶12高考重要考点六:元素周期律 物质结构 A BD高考重要考点六:元素周期律 物质结构 20、设某元素原子核内的质子数为m,中子数为n,则下列论述正确的是
( )
(A)不能由此确定该元素的原子量
(B)这种元素的原子量为(m+n)
(C)若碳原子的质量为w g,此原子的质量为(m+n)w g
(D)核内中子的总质量小于质子的总质量21、若短周期中的两种元素可以形成原子个数比为2∶3化合物,
则这两种元素的原子序数之差不可能是( )
(A)1 (B)3 (C)5 (D)6AD高考重要考点六:元素周期律 物质结构 22、X元素的阳离子和Y元素的阴离子具有与氩原子相同的电子层结构,
下列叙述正确的是( )
(A)X的原子序数比Y的小 (B)X原子的最外层电子数比Y的大
(C)X的原子半径比Y的大 (D)X元素的最高正价比Y的小23、X、Y、Z、W四种主族元素,若X的阳离子与Y的阴离子具有相同的
电子层结构;W的阳离子的氧化性强于等电荷数的X 阳离子的氧化
性;Z阴离子半径大于等电荷数的Y的阴离子半径,则四种元素的原
子序数由大到小的顺序是( )
(A)Z X Y W (B)W X Y Z (C)X Y Z W (D)Z Y X W24、下列各组物质气化或熔化时,所克服的微粒间的作用(力),属同种
类型的是( )
(A)碘和干冰的升华 (B)二氧化硅和生石灰的熔化
(C)氯化钠和铁的熔化 (D)苯和已烷的蒸发 CD A AD高考重要考点六:元素周期律 物质结构 25、下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是
( )
(A)SO2和SiO2(B)CO2和H2O(C)NaCl和HCl(D)CCl4和KCl26、下列分子中所有原子都满足最外层8电子结构的是( )
(A)光气(COCl2)(B)六氟化硫 (C)二氟化氙(D)三氟化硼B A 高考重要考点七:溶解度的基本知识;
有关饱和溶液溶解度的计算27、在质量为200克的饱和石灰水中,加入5.60克CaO后充分搅
拌,仍保持原来的温度,则下列叙述正确的是( )
(A)石灰水下部有白色固体7.40克
(B)石灰水下部白色固体质量大于7.40克
(C)石灰水的浓度和质量均不会变化
(D)石灰水的质量将会减少,石灰水的pH不会发生变化28、t℃时某盐饱和溶液的浓度为26.8%,取一定量的此饱和溶液,
向其中加入w克无水盐。在t℃时,析出m克含结晶水的该盐的
晶体,则从饱和溶液中析出的溶质的质量为( )
(A) m×26.8% (B) m-w
(C)(w+ m)×26.8% (D)(m-w)×26.8%BDD高考重要考点七:溶解度的基本知识;
有关饱和溶液溶解度的计算29、在一定温度下,物质M的溶解度为A克。向(100+A)克物质M
的饱和溶液中加入A克M,析出带一定结晶水的晶体B克,现取
出B克结晶水合物加水配成相同温度下的饱和溶液,需加水的
质量为( )
(A)100克(B)大于100克(C)小于100克(D)(100+A)克30、t℃时,把一定质量的硝酸钾溶液分成两等份,一份恒温蒸发掉10克
水析出1克硝酸钾晶体,另一份恒温蒸发掉15克水,析出2克硝酸钾
晶体,下列说法错误的是( )
(A)t℃时,若将原溶液恒温蒸发掉25克水,可析出3克硝酸钾晶体
(B)t℃时,若原溶液中再加入2克硝酸钾晶体便成为饱和溶液
(C)t℃时,硝酸钾的溶解度为20克
(D)t℃时,原硝酸钾溶液的质量分数为12% A D高考重要考点七:溶解度的基本知识;
有关饱和溶液溶解度的计算31、硝酸钾在不同温度时的溶解度如下表: 现有60℃时硝酸钾的饱和溶液105克,要得到39.2克晶体,应将溶液冷却到 ℃。32、在某温度下,向25%的硫酸镁饱和溶液中加入1克无水硫酸镁,可
析出3.15克 MgSO4·nH2O,则n值为 。207高考重要考点八:化学反应速率与化学平衡 ①平均反应速率的计算
②外因对化学反应速率及化学平衡的影响
③化学平衡状态的标志
④相同平衡状态的建立
⑤化学平衡移动图象的处理
⑥有关化学平衡的简单计算 高考重要考点八:化学反应速率与化学平衡 33、反应N2(g)+3H2(g) 2NH3(g)在密闭容器中进行,分别用N2、H2、
NH3三种物质在单位时间内浓度的变化表示该反应的速率V(N2)、V(H2)、
V(NH3),则三者之间的关系正确的是( )
(A)V(N2)=V(NH3) (B)3V(H2)=2V(NH3)
(C)V(NH3)=V(H2) (D)V(H2)=3V(N2) 34、将2molSO2, 1molO2充入带活塞的密闭容器中,发生反应
2SO2(g)+ O2(g) 2 SO3(g),达到平衡后,改变下列条件,
SO3的平衡浓度不改变的是( )
(A)保持温度和容器的压强不变,充入1mol SO3(g)
(B)保持温度和容器的容积不变,充入1mol SO3(g)
(C)保持温度和容器的压强不变,充入1mol O2(g)
(D)保持温度和容器的压强不变,充入1mol Ar(g)CDA35、可逆反应:2NO2 2NO+O2在定容密闭容器中反应,达到平衡状态的
标志是( )
①单位时间内生成n molO2的同时生成2 nmolNO2
②单位时间内生成n molO2的同时生成2 nmolNO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率之比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
(A)①④⑥ (B)②③⑤ (C)①③④ (D)①②③④⑤⑥高考重要考点八:化学反应速率与化学平衡 36、在一恒定的容器中充入2 mol A和1 mol B发生反应:2A(g)+
B(g) x C(g),达到平衡后,C的体积分数为W%;若维持容
器的容积和温度不变,按起始物质的量A:0.6 mol、B:0.3
mol、C:1.4 mol充入容器,达到平衡后,C的体积分数仍为
W%,则x值为( )
A.只能为2 B.只能为3 C.可能是2,也可能是3 D.无法确定A A 37、在体积、温度都相同的条件下有如下反应:2A(气)+2B(气)
C(气)+3D(气)。现分别从两条途径建立平衡:
(Ⅰ)A、B的起始物质的量均为2mol;
(Ⅱ)C、D的起始物质的量分别为2mol和6mol。以下叙述正确的
是( )
(A)Ⅰ、Ⅱ两途径最终达到平衡时,体系内混合气体的百分组成
相同
(B)Ⅰ、Ⅱ两途径最终达到平衡时,体系内混合气体的百分组成
不同
(C)达到平衡时,Ⅰ途径的反应速率vA等于Ⅱ途径的反应速率vD
(D)达到平衡时,Ⅰ途径所得混合气体的密度为Ⅱ途径所得混合
气体密度的1/2 高考重要考点八:化学反应速率与化学平衡 AD高考重要考点八:化学反应速率与化学平衡 38、右图表示可逆反应A(g)+B(g) nC(g) ΔH<0,在不同条件下反
应混合物中C的百分含量和反应过程所需时间的关系曲线,有关叙
述一定正确的是( )
(A)a表示有催化剂,而b无催化剂
(B)若其他条件相同,a比b的温度高
(C)若其他条件相同,a比b的压强大,n>2
(D)反应由逆反应方向开始 39、在10℃和200KPa的条件下,反应aA(g) dD(g)+eE(g)建立平
衡后,再逐步增大体系的压强(温度维持不变),下表列出不
同压强下反应建立平衡时物质D的浓度:BC高考重要考点八:化学反应速率与化学平衡 根据表中数据,回答下列问题:
(1)压强从200KPa增大到500KPa时,平衡向 反应方向移动
(填“正”或“逆”),其理由是 。
(2)压强从500KPa增加到1000KPa,平衡向 反应方向移动
(填“正”或“逆”),其理由是 。平衡之所
以向该方向移动,这是由于 。高考重要考点八:化学反应速率与化学平衡 答案:(1)平衡向逆反应方向移动,理由是D浓度增大的倍数(),小于压强增大的倍数( ),平衡之所以向该方向移动,是由于压强的增大,产物
之一可能转化为固体或液体物质。
(2)平衡向正反应方向移动,理由是D浓度增大的倍数(),小于压强增大的倍数()高考重要考点九:弱电解质的电离平衡40、pH相同的盐酸和醋酸溶液分别和锌反应,若最后锌都已完全溶
解,但放出的气体一样多,则下列判断正确的是( )
(A)整个反应阶段平均反应速率:醋酸>盐酸
(B)反应所需时间:醋酸>盐酸
(C)参加反应的锌的质量:醋酸=盐酸
(D)开始反应速率:盐酸>醋酸AC高考重要考点十:水的电离和溶液的pH的简单计算41、在0.01mol/L硫酸溶液中,水电离出的H+浓度是( )
(A)1×10-12mol/L (B)0.02mol/L
(C)1×10-7mol/L (D)5×10-13mol/L42、重水(D2O)的离子积为1.6×10-15,可以用pH一样的
定义来规定pD= -lg[D+],以下关于pD的叙述正确的是
( )
(A)中性溶液的pD=7.0
(B)含0.01mol NaOD的D2O溶液1L,其pD=12.0
(C)溶解0.01molDCl的D2O溶液1L,其pD=2.0
(D)在100mL0.25mol/L的DCl重水溶液中,加入
50mL0.2mol/LNaOD的重水溶液,其pD=1.0DCD高考重要考点十一: 盐类的水解及
离子浓度大小的比较43、将0.1mol下列物质置于1L水中充分搅拌,溶液中阴离子数最多的是
( )
(A)KCl (B)Mg(OH)2 (C)Na2CO3 (D)MgSO444、已知一种[H+]=1×10-3mol/L的酸和一种[OH-] = 1×10-3mol/ L
的碱溶液等体积混合后溶液呈酸性,其原因可能是
( )
(A)浓的强酸和稀的强碱溶液反应
(B)浓的弱酸和稀的强碱溶液反应
(C)等浓度的强酸与弱碱溶液反应
(D)生成了一种强酸弱碱盐 C B 高考重要考点十一: 盐类的水解及
离子浓度大小的比较45、将0.2 mol·L-1HCN溶液和0.1 mol·L-1的NaOH溶液等体积混合后,
溶液显碱性,下列关系中正确的是( )
(A)c(HCN)< c(CN-) (B)c(Na+)>c(CN-)
(C)c(HCN) - c(CN-)= c(OH-) (D)c(HCN)+ c(CN-)=0.1mol·L-146、将pH=2的盐酸和pH=12的氨水等体积混合后,溶液中浓度关系
正确的是( )
(A)c(NH4+)> c (Cl-)> c (H+)> c (OH-)
(B)c (Cl-)> c (NH4+)> c (OH-)> c (H+)
(C)c (NH4+)> c (Cl-)> c (OH-)> c (H+)
(D)c (Cl-)> c (NH4+)> c (H+)> c (OH-)BDC高考重要考点十二:电化学部分常见题型:
①原电池的基本原理
②原电池正负极的判断
③设计原电池,实现某一给定的反应
④原电池电极反应式的书写
⑤电极反应产物的计算(可能会结合生活中的电池或
一些新型电池对2、3、4点内容加以考查)高考重要考点十二:电化学部分47、一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,
然后分别向两极通入乙烷和氧气,其总反应为:2C2H6 +7O2
+8KOH====4K2CO3+10H2O,有关此电池的推断正确的是
( )
A.负极反应为14H2O+7O2+28e- =28OH-
B.放电一段时间后,负极周围的pH升高
C.每消耗1 mol C2H6 ,则电路上转移的电子为14 mol
D.放电过程中KOH的物质的量浓度不变C
同课章节目录
