人教版高中化学选修一第3章第2节 金属的腐蚀与防护 课件46张PPT
文档属性
| 名称 | 人教版高中化学选修一第3章第2节 金属的腐蚀与防护 课件46张PPT |  | |
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-11-18 21:19:51 | ||
图片预览











文档简介
课件46张PPT。
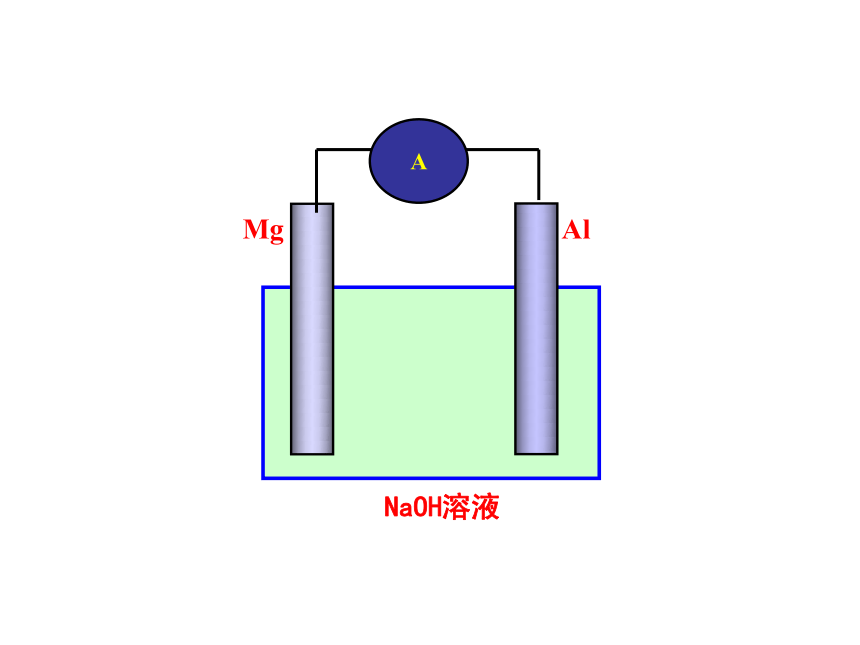
第二单元:金属的腐蚀与防护 金属的腐蚀与防护 专题一:化学反应与能量变化一、原电池原理的应用1、比较金属活动性强弱。(C)Mg AlNaOH溶液A2、比较反应速率
( D )3、设计实用电池例3、市场上经常见到的标记为Li-ion的电池称为“锂离子电池”。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料。这种锂离子电池的电池反应式为:Li+2Li0.35NiO2
2Li0.85NiO2。下列说法不正确的是
A.放电时,负极的电极反应式:Li - e-=Li+
B.充电时,Li0.85NiO2既发生氧化反应又发生
还原反应
C.该电池不能用水溶液作为电解质
D.放电过程中Li+向负极移动 D因为金属腐蚀而使桥梁坍塌金属腐蚀所带来的损失非常巨大 金属生产设备的腐蚀会导致工厂停工,
金属腐蚀还会使桥梁、建筑物等损坏甚至
坍塌,地下金属管道会因腐蚀而泄露,金
属船体会因腐蚀而损失,许多场所的金属
腐蚀还会导致火灾、爆炸等安全事故的发
生。据报道,全世界每年因金属腐蚀成的
直经济损失约占各国国内生产总值的
2%-4%,超过地震、水灾、台风等自然
灾害造成损失的总和。
是金属或合金与周围接触到的气体(Cl2 SO2 H2S O2等)或液体发生氧化还原反应,金属被氧化而引起损耗的过程。
即:M - ne- = Mn+4、金属的腐蚀(1)金属腐蚀的本质:
金属 电子被 。失去氧化铜器表面生成铜绿,主要成分:Cu2(OH)2CO32Cu+CO2+O2+H2O=Cu2 (OH)2 CO3钢铁(铁碳合金)在干燥的空气里长时间不易被腐蚀,但在潮湿的空气里却很快被腐蚀,这是什么原因呢?思考?在潮湿的空气里,钢铁表面吸附了一层薄薄的水膜。水膜中溶解有来自大气中的CO2、SO2、H2S等气体 使水膜中含有一定量的H+
H2O + CO2 ? H2CO3 ? H+ +HCO3— H2O ? H+ +OH—
这样在钢铁表面形成了一层电解质溶液的薄膜,它跟钢铁里的铁和少量的碳构成无数微小的原电池。铁碳原电池,铁做负极,失电子,被氧化被腐蚀。 2)金属腐蚀的类型:
(1)化学腐蚀
金属跟接触到的物质直接发生化学反应而引起的腐蚀叫做化学腐蚀。
(2)电化学腐蚀(电化腐蚀)
不纯的金属跟电解质溶液接触时,会发生原电池反应,比较活泼的金属失电子而被氧化的腐蚀叫做电化学腐蚀。
钢铁的析氢腐蚀示意图钢铁的吸氧腐蚀示意图钢铁在潮湿的空气中发生的电化学腐蚀的原理:
负极(Fe) Fe—2e— = Fe2+
正极(C)2H++2e— = H2↑
负极(Fe)Fe—2e— = Fe2+正极(C)2H2O+O2+4e—=4OH— 钢铁的析氢腐蚀和吸氧腐蚀比较水膜呈酸性水膜酸性很弱或呈中性2Fe+2H2O+O2= 2 Fe(OH)2
4Fe(OH)2+2H2O+O2=4Fe(OH)3
Fe2O3 · nH2O通常两种腐蚀同时存在,但以吸氧腐蚀为主。
化学腐蚀和电化学腐蚀的比较化学腐蚀和电化学腐蚀同时发生,但电化学腐蚀更普遍例1、分析右图,按要求写出有关反应方程式:
(1)、铁棒上的电极反应式为:
(2)、碳棒上的电极反应式为:
(3)、溶液中发生反应的化学方程式:
2Fe+2H2O+O2= 2 Fe(OH)24Fe(OH)2+2H2O+O2=4Fe(OH)3O2+2H2O+4e-=4OH-2Fe–4e-=2Fe2+电化反应比普通的化学反应要快,如果要加快某种金属的腐蚀速度,应该做原电池的什么极?电解池的什么极?那个腐蚀更快?思考?2018/11/19
第二单元:金属的腐蚀与防护金属的腐蚀与防护 专题一:化学反应与能量变化钢铁的析氢腐蚀和吸氧腐蚀比较水膜呈酸性水膜酸性很弱或呈中性2Fe+2H2O+O2= 2 Fe(OH)2
4Fe(OH)2+2H2O+O2=4Fe(OH)3
Fe2O3 · nH2O通常两种腐蚀同时存在,但以吸氧腐蚀为主。
化学腐蚀和电化学腐蚀的比较化学腐蚀和电化学腐蚀同时发生,但电化学腐蚀更普遍 在我们日常生产生活中有哪些常用的金属防护的方法?思考与交流健身器材刷油漆以防锈汽车喷漆船身、车厢、水桶等常涂油漆,汽车外壳常喷漆机器轮轴涂矿物油脂防护镀铬的保险杠镀锌搪瓷反应罐搪瓷器皿 搪瓷是含SiO2量较高的玻璃瓷釉,有极好的耐腐蚀性能,因此作为耐腐蚀非金属涂层,广泛用于石油化工、医药、仪器等工业部门和日常生活用品中。
二、金属的防护方法 1、在金属表面覆盖保护层
在金属表面喷漆、涂矿物油脂、喷涂塑料、搪瓷、镀上一层纯金属(如铁上镀锌、锡、铬等)、生成氧化膜等 衣架和电线的外面
包上一层塑料层小资料
用塑料(如聚乙烯、聚氯乙烯、聚氨酯等)喷涂金属表面,比喷油漆效果更佳。塑料这种覆盖层致密光洁,色泽艳丽,兼具防蚀与装饰的双重功能。 2、改变金属的内部组成和结构如:制成合金:不锈钢(钢中加入一定量的镍和铬)不锈钢 在铁的表面镀上一层金属是常见的防止铁生锈的方法,常见的有镀锡(马口铁)和镀锌(白铁皮),当马口铁和白铁皮上的金属镀层损坏时,镀层金属和铁在潮湿的空气中会形成原电池。试分析上述两种原电池中,哪一种情况下铁不容易被腐蚀?为什么?交流与讨论 在马口铁镀层被破坏后构成原电池中,铁、锡作为两极,由于铁的金属活动性大于锡,因此,铁作为负极,更易失去电子而被腐蚀;在白铁皮镀层被破坏后构成原电池中,铁、锌作为两极,由于锌的金属活动性大于铁,因此,锌作负极失去电子,而铁作正极,不易被腐蚀。用牺牲锌块的方法来保护船身,锌块必须定期更换锌块用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块必须定期更换
这是应用什么原理呢?3、电化学防护方法 电化学腐蚀的原因是在金属表面形成原电池,因此我们可以利用原电池原理来保护金属,以防止金属腐蚀。
金属在发生电化学腐蚀的过程中,总是作为原电池负极(阳极)的金属被氧化(失去电子)而腐蚀,作为原电池正极(阴极)的金属不被腐蚀。因此,使被保护金属作为正极,是有效地保护金属腐蚀的方法之一。1)、牺牲阳极阴极保护法 将被保护金属与比其更活泼的金属连接在一起,更活泼的金属(如镁、锌等)作为阳极(负极)不断被腐蚀,可定期更换,而作为阴极(正极)的金属就能不被腐蚀而得到保护 牺牲阳极一般常用的材料有铝、锌、镁等。
此法常用于保护海轮外壳,海水中的各种金属设备、构件和防止巨型设备(如贮油罐)以及石油管路的腐蚀。 将被保护的钢铁设备作为阴极,另一附加惰性电极作为阳极,两者都处在电解质溶液(如海水)中,接上外加直流电源。接通后,电子流向被保护的钢铁设备,在钢铁表面积累了大量的负电荷,从而抑制钢铁失去电子,阻止钢铁被腐蚀。
外加电流的阴极保护法主要用于防止土壤、海水及河水中的金属设备的腐蚀。2)、外加电流的阴极保护法1、下列装置中四块相同的Zn片,放置一段时间后腐蚀速
率由慢到快的顺序是(4)(2)(1)(3)例题:(5)(2)(1)(3)(4) 在同一电解质溶液中,金属腐蚀的快慢规律如下:
电解原理引起的腐蚀>原电池原理引起的腐蚀 >化学腐蚀>有防腐措施的腐蚀
防腐措施由好到坏的顺序如下:
外接电流的阴极保护法>牺牲阳极的阴极保护法>有一般防腐条件保护>无防腐条件
三、金属腐蚀快慢的判断1、下列防腐措施中,属于电化学保护法的是( )
A、用氧化剂使金属表面生成一层致密稳定的氧化物保护膜
B、在金属中加入一些铬或镍支撑金属或合金
C、在轮船的船壳水线以下部分装上一锌锭
D、金属表面喷漆C随堂练习2. 下列有关金属腐蚀与防护的说法正确的是( )
A. 纯银器表面在空气中因化学腐蚀渐渐变暗
B. 当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
C. 在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
D. 可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀AC 3、下列金属防护的方法不正确的是( )
A 、对健身器材刷油漆以防锈
B 、对某些工具的“机械转动部位”选用刷
油漆方法来防锈
C 、用牺牲锌块的方法来保护船身
D 、自行车的钢圈上镀上一层Cr防锈B4.铜制品上的铝质铆钉,在潮湿空气中易腐蚀的原因可描述为( ).
A.形成原电池时铝作负极
B.形成原电池时铜作负极
C.形成原电池时,电流由铝经导线流向铜
D.铝铆钉发生了化学腐蚀5.以下现象与电化腐蚀无关的是( ).
A.黄铜(铜锌合金)制作的铜锣不易产生铜绿
B.生铁比软铁蕊(几乎是纯铁)容易生锈
C.铁质器件附着铜质配件,在接触处易生铁锈
D.银质奖牌久置后表面变暗AD
第二单元:金属的腐蚀与防护 金属的腐蚀与防护 专题一:化学反应与能量变化一、原电池原理的应用1、比较金属活动性强弱。(C)Mg AlNaOH溶液A2、比较反应速率
( D )3、设计实用电池例3、市场上经常见到的标记为Li-ion的电池称为“锂离子电池”。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料。这种锂离子电池的电池反应式为:Li+2Li0.35NiO2
2Li0.85NiO2。下列说法不正确的是
A.放电时,负极的电极反应式:Li - e-=Li+
B.充电时,Li0.85NiO2既发生氧化反应又发生
还原反应
C.该电池不能用水溶液作为电解质
D.放电过程中Li+向负极移动 D因为金属腐蚀而使桥梁坍塌金属腐蚀所带来的损失非常巨大 金属生产设备的腐蚀会导致工厂停工,
金属腐蚀还会使桥梁、建筑物等损坏甚至
坍塌,地下金属管道会因腐蚀而泄露,金
属船体会因腐蚀而损失,许多场所的金属
腐蚀还会导致火灾、爆炸等安全事故的发
生。据报道,全世界每年因金属腐蚀成的
直经济损失约占各国国内生产总值的
2%-4%,超过地震、水灾、台风等自然
灾害造成损失的总和。
是金属或合金与周围接触到的气体(Cl2 SO2 H2S O2等)或液体发生氧化还原反应,金属被氧化而引起损耗的过程。
即:M - ne- = Mn+4、金属的腐蚀(1)金属腐蚀的本质:
金属 电子被 。失去氧化铜器表面生成铜绿,主要成分:Cu2(OH)2CO32Cu+CO2+O2+H2O=Cu2 (OH)2 CO3钢铁(铁碳合金)在干燥的空气里长时间不易被腐蚀,但在潮湿的空气里却很快被腐蚀,这是什么原因呢?思考?在潮湿的空气里,钢铁表面吸附了一层薄薄的水膜。水膜中溶解有来自大气中的CO2、SO2、H2S等气体 使水膜中含有一定量的H+
H2O + CO2 ? H2CO3 ? H+ +HCO3— H2O ? H+ +OH—
这样在钢铁表面形成了一层电解质溶液的薄膜,它跟钢铁里的铁和少量的碳构成无数微小的原电池。铁碳原电池,铁做负极,失电子,被氧化被腐蚀。 2)金属腐蚀的类型:
(1)化学腐蚀
金属跟接触到的物质直接发生化学反应而引起的腐蚀叫做化学腐蚀。
(2)电化学腐蚀(电化腐蚀)
不纯的金属跟电解质溶液接触时,会发生原电池反应,比较活泼的金属失电子而被氧化的腐蚀叫做电化学腐蚀。
钢铁的析氢腐蚀示意图钢铁的吸氧腐蚀示意图钢铁在潮湿的空气中发生的电化学腐蚀的原理:
负极(Fe) Fe—2e— = Fe2+
正极(C)2H++2e— = H2↑
负极(Fe)Fe—2e— = Fe2+正极(C)2H2O+O2+4e—=4OH— 钢铁的析氢腐蚀和吸氧腐蚀比较水膜呈酸性水膜酸性很弱或呈中性2Fe+2H2O+O2= 2 Fe(OH)2
4Fe(OH)2+2H2O+O2=4Fe(OH)3
Fe2O3 · nH2O通常两种腐蚀同时存在,但以吸氧腐蚀为主。
化学腐蚀和电化学腐蚀的比较化学腐蚀和电化学腐蚀同时发生,但电化学腐蚀更普遍例1、分析右图,按要求写出有关反应方程式:
(1)、铁棒上的电极反应式为:
(2)、碳棒上的电极反应式为:
(3)、溶液中发生反应的化学方程式:
2Fe+2H2O+O2= 2 Fe(OH)24Fe(OH)2+2H2O+O2=4Fe(OH)3O2+2H2O+4e-=4OH-2Fe–4e-=2Fe2+电化反应比普通的化学反应要快,如果要加快某种金属的腐蚀速度,应该做原电池的什么极?电解池的什么极?那个腐蚀更快?思考?2018/11/19
第二单元:金属的腐蚀与防护金属的腐蚀与防护 专题一:化学反应与能量变化钢铁的析氢腐蚀和吸氧腐蚀比较水膜呈酸性水膜酸性很弱或呈中性2Fe+2H2O+O2= 2 Fe(OH)2
4Fe(OH)2+2H2O+O2=4Fe(OH)3
Fe2O3 · nH2O通常两种腐蚀同时存在,但以吸氧腐蚀为主。
化学腐蚀和电化学腐蚀的比较化学腐蚀和电化学腐蚀同时发生,但电化学腐蚀更普遍 在我们日常生产生活中有哪些常用的金属防护的方法?思考与交流健身器材刷油漆以防锈汽车喷漆船身、车厢、水桶等常涂油漆,汽车外壳常喷漆机器轮轴涂矿物油脂防护镀铬的保险杠镀锌搪瓷反应罐搪瓷器皿 搪瓷是含SiO2量较高的玻璃瓷釉,有极好的耐腐蚀性能,因此作为耐腐蚀非金属涂层,广泛用于石油化工、医药、仪器等工业部门和日常生活用品中。
二、金属的防护方法 1、在金属表面覆盖保护层
在金属表面喷漆、涂矿物油脂、喷涂塑料、搪瓷、镀上一层纯金属(如铁上镀锌、锡、铬等)、生成氧化膜等 衣架和电线的外面
包上一层塑料层小资料
用塑料(如聚乙烯、聚氯乙烯、聚氨酯等)喷涂金属表面,比喷油漆效果更佳。塑料这种覆盖层致密光洁,色泽艳丽,兼具防蚀与装饰的双重功能。 2、改变金属的内部组成和结构如:制成合金:不锈钢(钢中加入一定量的镍和铬)不锈钢 在铁的表面镀上一层金属是常见的防止铁生锈的方法,常见的有镀锡(马口铁)和镀锌(白铁皮),当马口铁和白铁皮上的金属镀层损坏时,镀层金属和铁在潮湿的空气中会形成原电池。试分析上述两种原电池中,哪一种情况下铁不容易被腐蚀?为什么?交流与讨论 在马口铁镀层被破坏后构成原电池中,铁、锡作为两极,由于铁的金属活动性大于锡,因此,铁作为负极,更易失去电子而被腐蚀;在白铁皮镀层被破坏后构成原电池中,铁、锌作为两极,由于锌的金属活动性大于铁,因此,锌作负极失去电子,而铁作正极,不易被腐蚀。用牺牲锌块的方法来保护船身,锌块必须定期更换锌块用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块必须定期更换
这是应用什么原理呢?3、电化学防护方法 电化学腐蚀的原因是在金属表面形成原电池,因此我们可以利用原电池原理来保护金属,以防止金属腐蚀。
金属在发生电化学腐蚀的过程中,总是作为原电池负极(阳极)的金属被氧化(失去电子)而腐蚀,作为原电池正极(阴极)的金属不被腐蚀。因此,使被保护金属作为正极,是有效地保护金属腐蚀的方法之一。1)、牺牲阳极阴极保护法 将被保护金属与比其更活泼的金属连接在一起,更活泼的金属(如镁、锌等)作为阳极(负极)不断被腐蚀,可定期更换,而作为阴极(正极)的金属就能不被腐蚀而得到保护 牺牲阳极一般常用的材料有铝、锌、镁等。
此法常用于保护海轮外壳,海水中的各种金属设备、构件和防止巨型设备(如贮油罐)以及石油管路的腐蚀。 将被保护的钢铁设备作为阴极,另一附加惰性电极作为阳极,两者都处在电解质溶液(如海水)中,接上外加直流电源。接通后,电子流向被保护的钢铁设备,在钢铁表面积累了大量的负电荷,从而抑制钢铁失去电子,阻止钢铁被腐蚀。
外加电流的阴极保护法主要用于防止土壤、海水及河水中的金属设备的腐蚀。2)、外加电流的阴极保护法1、下列装置中四块相同的Zn片,放置一段时间后腐蚀速
率由慢到快的顺序是(4)(2)(1)(3)例题:(5)(2)(1)(3)(4) 在同一电解质溶液中,金属腐蚀的快慢规律如下:
电解原理引起的腐蚀>原电池原理引起的腐蚀 >化学腐蚀>有防腐措施的腐蚀
防腐措施由好到坏的顺序如下:
外接电流的阴极保护法>牺牲阳极的阴极保护法>有一般防腐条件保护>无防腐条件
三、金属腐蚀快慢的判断1、下列防腐措施中,属于电化学保护法的是( )
A、用氧化剂使金属表面生成一层致密稳定的氧化物保护膜
B、在金属中加入一些铬或镍支撑金属或合金
C、在轮船的船壳水线以下部分装上一锌锭
D、金属表面喷漆C随堂练习2. 下列有关金属腐蚀与防护的说法正确的是( )
A. 纯银器表面在空气中因化学腐蚀渐渐变暗
B. 当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
C. 在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
D. 可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀AC 3、下列金属防护的方法不正确的是( )
A 、对健身器材刷油漆以防锈
B 、对某些工具的“机械转动部位”选用刷
油漆方法来防锈
C 、用牺牲锌块的方法来保护船身
D 、自行车的钢圈上镀上一层Cr防锈B4.铜制品上的铝质铆钉,在潮湿空气中易腐蚀的原因可描述为( ).
A.形成原电池时铝作负极
B.形成原电池时铜作负极
C.形成原电池时,电流由铝经导线流向铜
D.铝铆钉发生了化学腐蚀5.以下现象与电化腐蚀无关的是( ).
A.黄铜(铜锌合金)制作的铜锣不易产生铜绿
B.生铁比软铁蕊(几乎是纯铁)容易生锈
C.铁质器件附着铜质配件,在接触处易生铁锈
D.银质奖牌久置后表面变暗AD
