人教版高中化学选修四 1.1 化学反应与能量的变化 课件49张PPT
文档属性
| 名称 | 人教版高中化学选修四 1.1 化学反应与能量的变化 课件49张PPT |  | |
| 格式 | zip | ||
| 文件大小 | 338.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-11-19 19:55:15 | ||
图片预览


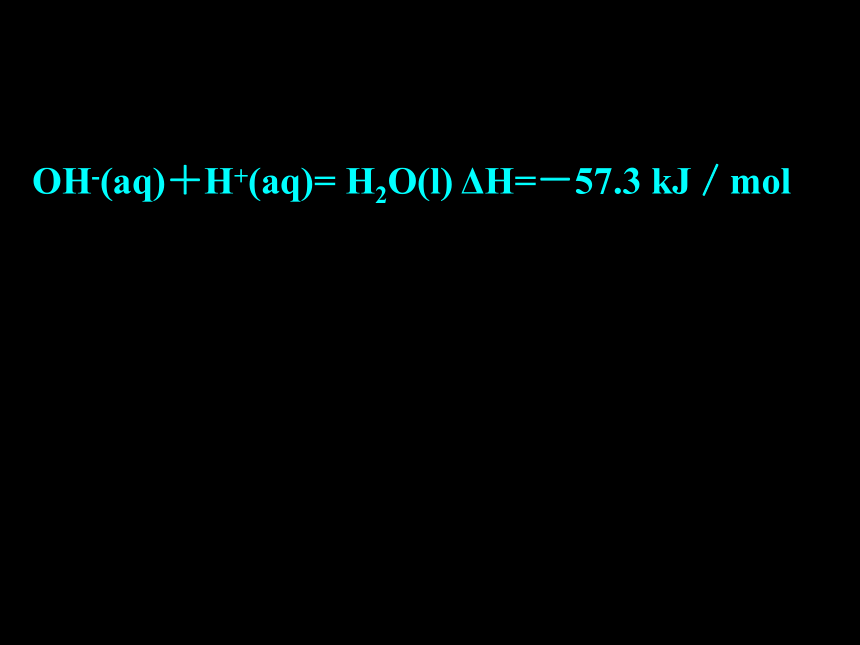









文档简介
课件49张PPT。化学反应与能量的变化[课前练习] 写出下列反应的热化学方程式1、酸和碱的中和反应有热量放出,可以通过实验测得中和反应的反应热。当1L1mol/L的稀盐酸跟1L1 mol/L的NaOH溶液起中和反应时,能放出57.3kJ的热量。2、如果用1L1mol/L的 KOH溶液中和1L1mol/L的HNO3溶液,也能放出57.3 kJ的热量。OH-(aq)+H+(aq)= H2O(l) ΔH=-57.3 kJ/molOH-(aq)+H+(aq)= H2O(l) ΔH=-57.3 kJ/mol中和热
在稀溶液中, 强酸和强碱发生中和反应, 只生成1mol水时的反应热叫做中和热。中和热的要点中和热的要点
①条件:稀溶液。中和热的要点
①条件:稀溶液。
稀溶液是指溶于大量水中的酸碱溶液。中和热的要点
①条件:稀溶液。
稀溶液是指溶于大量水中的酸碱溶液。
②反应物:(强)酸与(强)碱。
中和热的要点
①条件:稀溶液。
稀溶液是指溶于大量水中的酸碱溶液。
②反应物:(强)酸与(强)碱。
中和热不包括离子在水溶液中的生成热、电解质电离时的吸热等所伴随的热效应。
③必须以生成1mol水为基准
中和热的要点
①条件:稀溶液。
稀溶液是指溶于大量水中的酸碱溶液。
②反应物:(强)酸与(强)碱。
中和热不包括离子在水溶液中的生成热、电解质电离时的吸热等所伴随的热效应。
③必须以生成1mol水为基准
中和反应的实质是H+和OH-化合生成H2O,若反应过程中有其他物质生成,这部分反应热不包括在中和热内。中和热的要点
①条件:稀溶液。
稀溶液是指溶于大量水中的酸碱溶液。
②反应物:(强)酸与(强)碱。
中和热不包括离子在水溶液中的生成热、电解质电离时的吸热等所伴随的热效应。
③必须以生成1mol水为基准
中和反应的实质是H+和OH-化合生成H2O,若反应过程中有其他物质生成,这部分反应热不包括在中和热内。
④反应热:三、中和反应反应热的测定三、中和反应反应热的测定
1.实验目的三、中和反应反应热的测定
1.实验目的 测定强酸、强碱反应的中和热三、中和反应反应热的测定
1.实验目的 测定强酸、强碱反应的中和热
2.实验用品 三、中和反应反应热的测定
1.实验目的 测定强酸、强碱反应的中和热
2.实验用品 三、中和反应反应热的测定
1.实验目的 测定强酸、强碱反应的中和热
2.实验用品 大烧杯(500mL)、小烧杯 (100mL)、 温度计、量筒(50 mL)两个、环形玻璃搅拌棒 三、中和反应反应热的测定
1.实验目的 测定强酸、强碱反应的中和热
2.实验用品 大烧杯(500mL)、小烧杯 (100mL)、 温度计、量筒(50 mL)两个、环形玻璃搅拌棒 泡沫塑料 或纸条、泡沫 塑料板或硬纸板(中心有两个小孔)。 0.50 mol/L 盐酸、0.55 mol/L NaOH溶液3.实验步骤:阅读书本P5 实验步骤中和热的测定3.实验步骤:阅读书本P5 实验步骤中和热的测定4.实验注意事项:4.实验注意事项:①整个装置要保证热量尽量不散失。4.实验注意事项:①整个装置要保证热量尽量不散失。
防止对流:4.实验注意事项:①整个装置要保证热量尽量不散失。
防止对流:
A、大小烧杯杯口相平4.实验注意事项:①整个装置要保证热量尽量不散失。
防止对流:
A、大小烧杯杯口相平
B、用硬纸板作盖板4.实验注意事项:①整个装置要保证热量尽量不散失。
防止对流:
A、大小烧杯杯口相平
B、用硬纸板作盖板
防止传导:4.实验注意事项:①整个装置要保证热量尽量不散失。
防止对流:
A、大小烧杯杯口相平
B、用硬纸板作盖板
防止传导:
A、大小烧杯间填满碎泡沫塑料②反应要充分②反应要充分
A、使用环形玻璃棒搅拌②反应要充分
A、使用环形玻璃棒搅拌
B、让NaOH溶液稍过量②反应要充分
A、使用环形玻璃棒搅拌
B、让NaOH溶液稍过量
③平行做3次实验②反应要充分
A、使用环形玻璃棒搅拌
B、让NaOH溶液稍过量
③平行做3次实验
其温度采用平均值进行计算。②反应要充分
A、使用环形玻璃棒搅拌
B、让NaOH溶液稍过量
③平行做3次实验
其温度采用平均值进行计算。
④计算式:②反应要充分
A、使用环形玻璃棒搅拌
B、让NaOH溶液稍过量
③平行做3次实验
其温度采用平均值进行计算。
④计算式:
△H= - 0.418(t2 - t1)/n(H2O) kJ/mol②反应要充分
A、使用环形玻璃棒搅拌
B、让NaOH溶液稍过量
③平行做3次实验
其温度采用平均值进行计算。
④计算式:
△H= - 0.418(t2 - t1)/n(H2O) kJ/mol
[注意酸溶液与碱溶液的体积均为50mL] 50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L -1NaOH溶液在图示的装置中进行中和 反应。通过测定反应过程中所放出的热量可计 算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻 璃用品是__________________ (2)烧杯间填满碎纸条的作用 是_________________________
(3)大烧杯上如不盖硬纸板, 求得的中和热数值________(填 “偏大”“偏小”“无影响”)。环形玻璃搅拌棒练习: 50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L -1NaOH溶液在图示的装置中进行中和 反应。通过测定反应过程中所放出的热量可计 算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻 璃用品是__________________ (2)烧杯间填满碎纸条的作用 是_________________________
(3)大烧杯上如不盖硬纸板, 求得的中和热数值________(填 “偏大”“偏小”“无影响”)。环形玻璃搅拌棒减少实验过程中的热量损失练习: 50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L -1NaOH溶液在图示的装置中进行中和 反应。通过测定反应过程中所放出的热量可计 算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻 璃用品是__________________ (2)烧杯间填满碎纸条的作用 是_________________________
(3)大烧杯上如不盖硬纸板, 求得的中和热数值________(填 “偏大”“偏小”“无影响”)。环形玻璃搅拌棒减少实验过程中的热量损失偏小练习: (4)实验中改用60mL0.50mol/L盐酸跟50 mL0.55mol/L NaOH溶液进行反应,与上述 实验相比,所放出的热量_________(填“相 等”“不相等”),所求中和热________(填 “相等”“不相等”),简述理由: ________ _______________________________________ ___________________________________
(5)用相同浓度和体积的氨水代替NaOH溶 液进行上述实验,测得的中和热的数值会 ________.(均填“偏大”“偏小”“无影响”) (4)实验中改用60mL0.50mol/L盐酸跟50 mL0.55mol/L NaOH溶液进行反应,与上述 实验相比,所放出的热量_________(填“相 等”“不相等”),所求中和热________(填 “相等”“不相等”),简述理由: ________ _______________________________________ ___________________________________
(5)用相同浓度和体积的氨水代替NaOH溶 液进行上述实验,测得的中和热的数值会 ________.(均填“偏大”“偏小”“无影响”)不等 (4)实验中改用60mL0.50mol/L盐酸跟50 mL0.55mol/L NaOH溶液进行反应,与上述 实验相比,所放出的热量_________(填“相 等”“不相等”),所求中和热________(填 “相等”“不相等”),简述理由: ________ _______________________________________ ___________________________________
(5)用相同浓度和体积的氨水代替NaOH溶 液进行上述实验,测得的中和热的数值会 ________.(均填“偏大”“偏小”“无影响”)不等相等 1.已知强酸与强碱发生中和反应时: H+(aq)+OH-(aq)=H2O(l);?H=-57.3kJ/mol
求下列中和反应中放出的热量。
(1)用20gNaOH配稀溶液跟足量稀盐酸反 应放出____________kJ的热量。
(2)用34.2gBa(OH) 2配稀溶液跟足量稀硝 酸反应,放出__________kJ的热量。拓展训练1.已知强酸与强碱发生中和反应时: H+(aq)+OH-(aq)=H2O(l);?H=-57.3kJ/mol
求下列中和反应中放出的热量。
(1)用20gNaOH配稀溶液跟足量稀盐酸反 应放出____________kJ的热量。
(2)用34.2gBa(OH) 2配稀溶液跟足量稀硝 酸反应,放出__________kJ的热量。28.7拓展训练1.已知强酸与强碱发生中和反应时: H+(aq)+OH-(aq)=H2O(l);?H=-57.3kJ/mol
求下列中和反应中放出的热量。
(1)用20gNaOH配稀溶液跟足量稀盐酸反 应放出____________kJ的热量。
(2)用34.2gBa(OH) 2配稀溶液跟足量稀硝 酸反应,放出__________kJ的热量。28.722.92拓展训练2.将V1 mL 1.00 mol/L HCl溶液和V2 mL未知 浓度的NaOH溶液混合均匀后测量并记录溶液 温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。下列叙述正确的是( )A.做该实验时环境温度为22℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约为1.00 mol/L
D.该实验表明有水生成的反应都是放热反应2.将V1 mL 1.00 mol/L HCl溶液和V2 mL未知 浓度的NaOH溶液混合均匀后测量并记录溶液 温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。下列叙述正确的是( )CA.做该实验时环境温度为22℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约为1.00 mol/L
D.该实验表明有水生成的反应都是放热反应3、某实验小组做中和热测定实验,每次取0.50 mol·L-1 HCl 和0.55 mol·L-1 的NaOH 溶液各100 mL ,并记录如下原始数据。
若上述HCl、NaOH 溶液的密度都近似为1 g/cm3,中和后生成的溶液的比热容C=4.18 J/(g·℃),求该中和反应的ΔH。4.某实验小组用0.5mol/L一元酸HA与0.55mol/L NaOH做中和热测定实验,实验时所用HA及NaOH溶液的体积均为50mL,各溶液密度为1g/cm3 ,生成溶液的比热容c=4.18J/(g·℃),某次实验某学生所测实验数据如下。求该中和反应的ΔH并对结果进行误差分析4.某实验小组用0.5mol/L一元酸HA与0.55mol/L NaOH做中和热测定实验,实验时所用HA及NaOH溶液的体积均为50mL,各溶液密度为1g/cm3 ,生成溶液的比热容c=4.18J/(g·℃),某次实验某学生所测实验数据如下。求该中和反应的ΔH并对结果进行误差分析-53.5kJ/mol
在稀溶液中, 强酸和强碱发生中和反应, 只生成1mol水时的反应热叫做中和热。中和热的要点中和热的要点
①条件:稀溶液。中和热的要点
①条件:稀溶液。
稀溶液是指溶于大量水中的酸碱溶液。中和热的要点
①条件:稀溶液。
稀溶液是指溶于大量水中的酸碱溶液。
②反应物:(强)酸与(强)碱。
中和热的要点
①条件:稀溶液。
稀溶液是指溶于大量水中的酸碱溶液。
②反应物:(强)酸与(强)碱。
中和热不包括离子在水溶液中的生成热、电解质电离时的吸热等所伴随的热效应。
③必须以生成1mol水为基准
中和热的要点
①条件:稀溶液。
稀溶液是指溶于大量水中的酸碱溶液。
②反应物:(强)酸与(强)碱。
中和热不包括离子在水溶液中的生成热、电解质电离时的吸热等所伴随的热效应。
③必须以生成1mol水为基准
中和反应的实质是H+和OH-化合生成H2O,若反应过程中有其他物质生成,这部分反应热不包括在中和热内。中和热的要点
①条件:稀溶液。
稀溶液是指溶于大量水中的酸碱溶液。
②反应物:(强)酸与(强)碱。
中和热不包括离子在水溶液中的生成热、电解质电离时的吸热等所伴随的热效应。
③必须以生成1mol水为基准
中和反应的实质是H+和OH-化合生成H2O,若反应过程中有其他物质生成,这部分反应热不包括在中和热内。
④反应热:三、中和反应反应热的测定三、中和反应反应热的测定
1.实验目的三、中和反应反应热的测定
1.实验目的 测定强酸、强碱反应的中和热三、中和反应反应热的测定
1.实验目的 测定强酸、强碱反应的中和热
2.实验用品 三、中和反应反应热的测定
1.实验目的 测定强酸、强碱反应的中和热
2.实验用品 三、中和反应反应热的测定
1.实验目的 测定强酸、强碱反应的中和热
2.实验用品 大烧杯(500mL)、小烧杯 (100mL)、 温度计、量筒(50 mL)两个、环形玻璃搅拌棒 三、中和反应反应热的测定
1.实验目的 测定强酸、强碱反应的中和热
2.实验用品 大烧杯(500mL)、小烧杯 (100mL)、 温度计、量筒(50 mL)两个、环形玻璃搅拌棒 泡沫塑料 或纸条、泡沫 塑料板或硬纸板(中心有两个小孔)。 0.50 mol/L 盐酸、0.55 mol/L NaOH溶液3.实验步骤:阅读书本P5 实验步骤中和热的测定3.实验步骤:阅读书本P5 实验步骤中和热的测定4.实验注意事项:4.实验注意事项:①整个装置要保证热量尽量不散失。4.实验注意事项:①整个装置要保证热量尽量不散失。
防止对流:4.实验注意事项:①整个装置要保证热量尽量不散失。
防止对流:
A、大小烧杯杯口相平4.实验注意事项:①整个装置要保证热量尽量不散失。
防止对流:
A、大小烧杯杯口相平
B、用硬纸板作盖板4.实验注意事项:①整个装置要保证热量尽量不散失。
防止对流:
A、大小烧杯杯口相平
B、用硬纸板作盖板
防止传导:4.实验注意事项:①整个装置要保证热量尽量不散失。
防止对流:
A、大小烧杯杯口相平
B、用硬纸板作盖板
防止传导:
A、大小烧杯间填满碎泡沫塑料②反应要充分②反应要充分
A、使用环形玻璃棒搅拌②反应要充分
A、使用环形玻璃棒搅拌
B、让NaOH溶液稍过量②反应要充分
A、使用环形玻璃棒搅拌
B、让NaOH溶液稍过量
③平行做3次实验②反应要充分
A、使用环形玻璃棒搅拌
B、让NaOH溶液稍过量
③平行做3次实验
其温度采用平均值进行计算。②反应要充分
A、使用环形玻璃棒搅拌
B、让NaOH溶液稍过量
③平行做3次实验
其温度采用平均值进行计算。
④计算式:②反应要充分
A、使用环形玻璃棒搅拌
B、让NaOH溶液稍过量
③平行做3次实验
其温度采用平均值进行计算。
④计算式:
△H= - 0.418(t2 - t1)/n(H2O) kJ/mol②反应要充分
A、使用环形玻璃棒搅拌
B、让NaOH溶液稍过量
③平行做3次实验
其温度采用平均值进行计算。
④计算式:
△H= - 0.418(t2 - t1)/n(H2O) kJ/mol
[注意酸溶液与碱溶液的体积均为50mL] 50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L -1NaOH溶液在图示的装置中进行中和 反应。通过测定反应过程中所放出的热量可计 算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻 璃用品是__________________ (2)烧杯间填满碎纸条的作用 是_________________________
(3)大烧杯上如不盖硬纸板, 求得的中和热数值________(填 “偏大”“偏小”“无影响”)。环形玻璃搅拌棒练习: 50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L -1NaOH溶液在图示的装置中进行中和 反应。通过测定反应过程中所放出的热量可计 算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻 璃用品是__________________ (2)烧杯间填满碎纸条的作用 是_________________________
(3)大烧杯上如不盖硬纸板, 求得的中和热数值________(填 “偏大”“偏小”“无影响”)。环形玻璃搅拌棒减少实验过程中的热量损失练习: 50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L -1NaOH溶液在图示的装置中进行中和 反应。通过测定反应过程中所放出的热量可计 算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻 璃用品是__________________ (2)烧杯间填满碎纸条的作用 是_________________________
(3)大烧杯上如不盖硬纸板, 求得的中和热数值________(填 “偏大”“偏小”“无影响”)。环形玻璃搅拌棒减少实验过程中的热量损失偏小练习: (4)实验中改用60mL0.50mol/L盐酸跟50 mL0.55mol/L NaOH溶液进行反应,与上述 实验相比,所放出的热量_________(填“相 等”“不相等”),所求中和热________(填 “相等”“不相等”),简述理由: ________ _______________________________________ ___________________________________
(5)用相同浓度和体积的氨水代替NaOH溶 液进行上述实验,测得的中和热的数值会 ________.(均填“偏大”“偏小”“无影响”) (4)实验中改用60mL0.50mol/L盐酸跟50 mL0.55mol/L NaOH溶液进行反应,与上述 实验相比,所放出的热量_________(填“相 等”“不相等”),所求中和热________(填 “相等”“不相等”),简述理由: ________ _______________________________________ ___________________________________
(5)用相同浓度和体积的氨水代替NaOH溶 液进行上述实验,测得的中和热的数值会 ________.(均填“偏大”“偏小”“无影响”)不等 (4)实验中改用60mL0.50mol/L盐酸跟50 mL0.55mol/L NaOH溶液进行反应,与上述 实验相比,所放出的热量_________(填“相 等”“不相等”),所求中和热________(填 “相等”“不相等”),简述理由: ________ _______________________________________ ___________________________________
(5)用相同浓度和体积的氨水代替NaOH溶 液进行上述实验,测得的中和热的数值会 ________.(均填“偏大”“偏小”“无影响”)不等相等 1.已知强酸与强碱发生中和反应时: H+(aq)+OH-(aq)=H2O(l);?H=-57.3kJ/mol
求下列中和反应中放出的热量。
(1)用20gNaOH配稀溶液跟足量稀盐酸反 应放出____________kJ的热量。
(2)用34.2gBa(OH) 2配稀溶液跟足量稀硝 酸反应,放出__________kJ的热量。拓展训练1.已知强酸与强碱发生中和反应时: H+(aq)+OH-(aq)=H2O(l);?H=-57.3kJ/mol
求下列中和反应中放出的热量。
(1)用20gNaOH配稀溶液跟足量稀盐酸反 应放出____________kJ的热量。
(2)用34.2gBa(OH) 2配稀溶液跟足量稀硝 酸反应,放出__________kJ的热量。28.7拓展训练1.已知强酸与强碱发生中和反应时: H+(aq)+OH-(aq)=H2O(l);?H=-57.3kJ/mol
求下列中和反应中放出的热量。
(1)用20gNaOH配稀溶液跟足量稀盐酸反 应放出____________kJ的热量。
(2)用34.2gBa(OH) 2配稀溶液跟足量稀硝 酸反应,放出__________kJ的热量。28.722.92拓展训练2.将V1 mL 1.00 mol/L HCl溶液和V2 mL未知 浓度的NaOH溶液混合均匀后测量并记录溶液 温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。下列叙述正确的是( )A.做该实验时环境温度为22℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约为1.00 mol/L
D.该实验表明有水生成的反应都是放热反应2.将V1 mL 1.00 mol/L HCl溶液和V2 mL未知 浓度的NaOH溶液混合均匀后测量并记录溶液 温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。下列叙述正确的是( )CA.做该实验时环境温度为22℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约为1.00 mol/L
D.该实验表明有水生成的反应都是放热反应3、某实验小组做中和热测定实验,每次取0.50 mol·L-1 HCl 和0.55 mol·L-1 的NaOH 溶液各100 mL ,并记录如下原始数据。
若上述HCl、NaOH 溶液的密度都近似为1 g/cm3,中和后生成的溶液的比热容C=4.18 J/(g·℃),求该中和反应的ΔH。4.某实验小组用0.5mol/L一元酸HA与0.55mol/L NaOH做中和热测定实验,实验时所用HA及NaOH溶液的体积均为50mL,各溶液密度为1g/cm3 ,生成溶液的比热容c=4.18J/(g·℃),某次实验某学生所测实验数据如下。求该中和反应的ΔH并对结果进行误差分析4.某实验小组用0.5mol/L一元酸HA与0.55mol/L NaOH做中和热测定实验,实验时所用HA及NaOH溶液的体积均为50mL,各溶液密度为1g/cm3 ,生成溶液的比热容c=4.18J/(g·℃),某次实验某学生所测实验数据如下。求该中和反应的ΔH并对结果进行误差分析-53.5kJ/mol
