人教版高中化学选修四 3-4-1难溶电解质的溶解平衡教学课件21张PPT
文档属性
| 名称 | 人教版高中化学选修四 3-4-1难溶电解质的溶解平衡教学课件21张PPT |  | |
| 格式 | zip | ||
| 文件大小 | 498.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-11-19 19:55:59 | ||
图片预览






文档简介
课件21张PPT。石灰石岩层在经历了数万年的岁月侵蚀之后,会形成
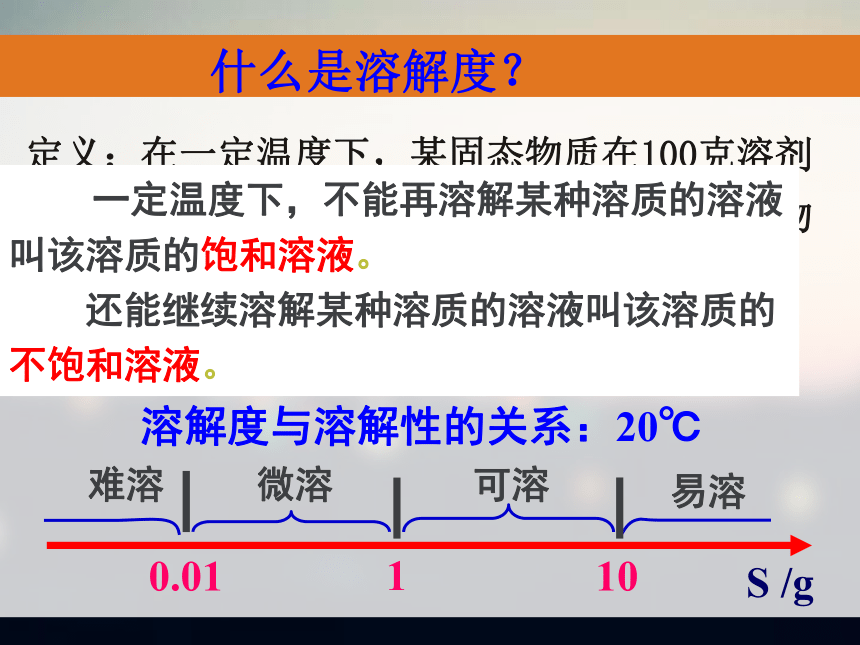
各种奇形异状的溶洞。你知道它们是如何形成的吗?"世界奇观,一级洞穴景点","一座地下艺术宫殿和洞穴科学博物馆"。溶洞 第4节 难溶电解质的溶解平衡 第三章 水溶液中的离子平衡什么是溶解度?定义:在一定温度下,某固态物质在100克溶剂
里达到饱和状态时所溶解的质量。 叫做这种物质在这种溶剂里的溶解度。 一定温度下,不能再溶解某种溶质的溶液
叫该溶质的饱和溶液。
还能继续溶解某种溶质的溶液叫该溶质的
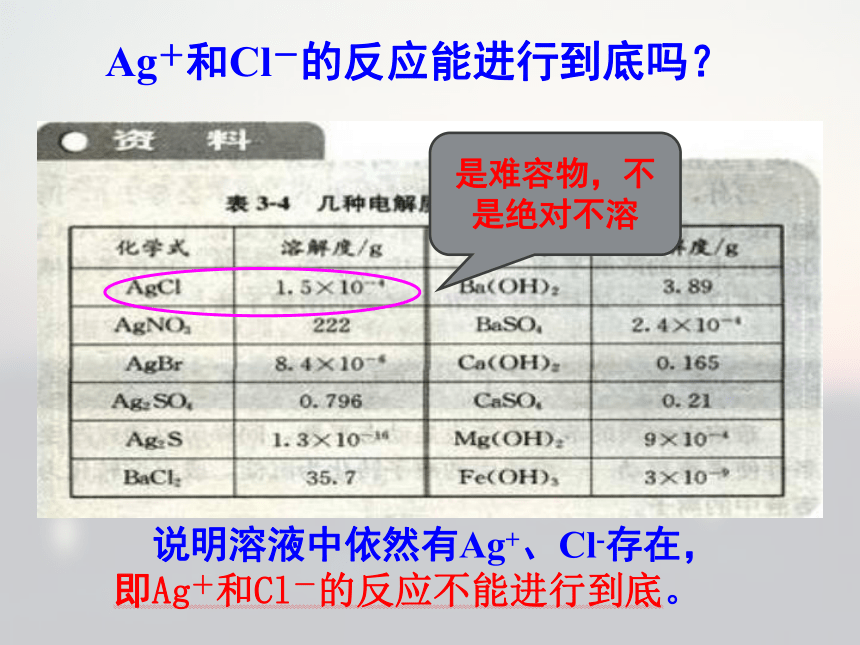
不饱和溶液。溶解度与溶解性的关系:20℃AgNO3与NaCl反应生成难溶AgCl,如果上述两种溶液是等物质的量浓度、等体积的,一般认为反应可以进行到底。
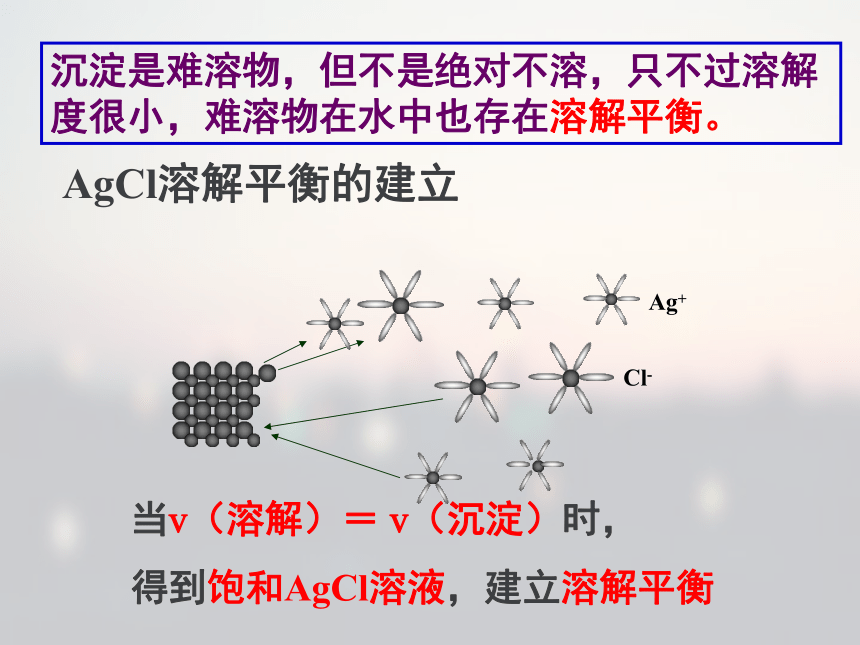
交流研讨Ag+和Cl-的反应能进行到底吗? 说明溶液中依然有Ag+、Cl-存在,即Ag+和Cl-的反应不能进行到底。Ag+和Cl-的反应能进行到底吗?是难容物,不是绝对不溶沉淀是难溶物,但不是绝对不溶,只不过溶解 度很小,难溶物在水中也存在溶解平衡。 当v(溶解)= v(沉淀)时,
得到饱和AgCl溶液,建立溶解平衡AgCl溶解平衡的建立一、沉淀的溶解平衡 一定条件下,难溶电解质溶解成离子的速率等于离子重新结
合成沉淀的速率,溶液中离子的浓度保持不变的状态。 1、定义 2、特征:3、表达式: AgCl(s) Ag+ (aq) + Cl-(aq)逆、动、等、定、变。AmBn(s) mAn+ (aq) + nBm-(aq)注意写法我们通常所说“沉淀完全”又如何理解呢?注:化学上通常认为残留在溶液中的离子浓度小于10-5mol/L时,沉淀达到完全。
4、影响难溶电解质溶解平衡的因素:a、绝对不溶的电解质是没有的。
b、同是难溶电解质,溶解度差别也很大。
c、易溶电解质做溶质时只要是饱和溶液也可 存在溶解平衡。①内因:电解质本身的性质 ②外因: a、浓度:加水,平衡向溶解方向移动。b、温度:升温,多数平衡向溶解方向移动。特例:
Ca(OH)2c、同离子效应:向溶液中加入含难溶电解质电离的
某离子的电解质,平衡向生成沉淀的方向移动。d、化学反应:若加入的物质使难溶电解质生成更难容的电解质、弱电解质或气体时,平衡向沉淀溶解的方向移动。思考:对于平衡 AgCl Ag++Cl- 若改变条件,对其有何影响?→ 不移动 ← → ← ↑ ↑ 不变 不变 ↓ ↑ ↓ ↑↑ ↓当氢氧化钙固体在水中达到溶解平衡时,为使氢氧化钙固体的量减少,需要加入少量的( )
A NH4NO3固体
B NaOH固体
C CaCl2固体
D NaHSO4固体AD【思考与交流】
怎样判断难溶电解质已经达到溶解平衡?交流研讨二、沉淀溶解平衡常数—溶度积KSP对于溶解平衡:
例如:Mg(OH)2(s) Mg2+(aq) + 2OH-(aq)有:
KSP=[c(Mg2+)]·[c(OH-)]2
在一定温度下, KSP是一个常数。
2、溶液中有关离子浓度幂的乘积—离子积QC(任意时刻溶液中离子浓度幂的乘积)。溶液过饱和,有沉淀析出溶液饱和,沉淀与溶解处于平衡状态溶液未饱和,可继续溶解该难溶电解质1、定义:难溶电解质的溶解平衡中,离子浓度幂的乘积。
难溶电解质已达溶解平衡二、沉淀反应的应用1、沉淀的生成应用:生成难溶电解质的沉淀,是工业生产、环保工程和科学研究中除杂或提纯物质的重要方法之一。沉淀生成的方法① 调pH值如:工业原料氯化铵中混有氯化铁,使其溶解于水,再加氨水调pH值至7~8,可使Fe3+转变为Fe(OH)3沉淀而除去。Fe3+ + 3NH3?H2O=Fe(OH)3↓+3NH4+ ② 加沉淀剂
如:要沉淀Cu2+、Hg2+等离子,可以用Na2S、H2S做沉淀剂Cu2++S2-= CuS↓
Hg2++S2-= HgS↓2、沉淀的溶解(1)原理 设法不断移去溶解平衡体系中的相应离子,使平衡向沉淀溶解的方向移动。(2)举例a、难溶于水的盐溶于酸中
如:CaCO3溶于盐酸,FeS、Al(OH)3、Cu(OH)2溶于强酸。b 、难溶于水的电解质溶于某些盐溶液
如:Mg(OH)2溶于NH4Cl溶液思考与交流 用平衡移动的原理分析Mg(OH)2溶于盐酸和NH4Cl溶液的原因。应用:为什么医学上常用BaSO4作为内服造影剂“钡餐”,而不用BaCO3作为内服造影剂“钡餐”?沉淀溶解的应用举例 3、沉淀的转化(1)沉淀转化的方法
对于一些用酸或其他方法也不能溶解的沉淀,可以先将其转化为另一种用酸或其他方法能溶解的
沉淀。
(2)沉淀转化的实质
沉淀转化的实质是沉淀溶解平衡移动。一般溶解度小的沉淀转化成溶解度更小的沉淀容易实现。(3)沉淀转化的应用
沉淀的转化在科研和生产中具有重要的应用价值。归纳总结
各种奇形异状的溶洞。你知道它们是如何形成的吗?"世界奇观,一级洞穴景点","一座地下艺术宫殿和洞穴科学博物馆"。溶洞 第4节 难溶电解质的溶解平衡 第三章 水溶液中的离子平衡什么是溶解度?定义:在一定温度下,某固态物质在100克溶剂
里达到饱和状态时所溶解的质量。 叫做这种物质在这种溶剂里的溶解度。 一定温度下,不能再溶解某种溶质的溶液
叫该溶质的饱和溶液。
还能继续溶解某种溶质的溶液叫该溶质的
不饱和溶液。溶解度与溶解性的关系:20℃AgNO3与NaCl反应生成难溶AgCl,如果上述两种溶液是等物质的量浓度、等体积的,一般认为反应可以进行到底。
交流研讨Ag+和Cl-的反应能进行到底吗? 说明溶液中依然有Ag+、Cl-存在,即Ag+和Cl-的反应不能进行到底。Ag+和Cl-的反应能进行到底吗?是难容物,不是绝对不溶沉淀是难溶物,但不是绝对不溶,只不过溶解 度很小,难溶物在水中也存在溶解平衡。 当v(溶解)= v(沉淀)时,
得到饱和AgCl溶液,建立溶解平衡AgCl溶解平衡的建立一、沉淀的溶解平衡 一定条件下,难溶电解质溶解成离子的速率等于离子重新结
合成沉淀的速率,溶液中离子的浓度保持不变的状态。 1、定义 2、特征:3、表达式: AgCl(s) Ag+ (aq) + Cl-(aq)逆、动、等、定、变。AmBn(s) mAn+ (aq) + nBm-(aq)注意写法我们通常所说“沉淀完全”又如何理解呢?注:化学上通常认为残留在溶液中的离子浓度小于10-5mol/L时,沉淀达到完全。
4、影响难溶电解质溶解平衡的因素:a、绝对不溶的电解质是没有的。
b、同是难溶电解质,溶解度差别也很大。
c、易溶电解质做溶质时只要是饱和溶液也可 存在溶解平衡。①内因:电解质本身的性质 ②外因: a、浓度:加水,平衡向溶解方向移动。b、温度:升温,多数平衡向溶解方向移动。特例:
Ca(OH)2c、同离子效应:向溶液中加入含难溶电解质电离的
某离子的电解质,平衡向生成沉淀的方向移动。d、化学反应:若加入的物质使难溶电解质生成更难容的电解质、弱电解质或气体时,平衡向沉淀溶解的方向移动。思考:对于平衡 AgCl Ag++Cl- 若改变条件,对其有何影响?→ 不移动 ← → ← ↑ ↑ 不变 不变 ↓ ↑ ↓ ↑↑ ↓当氢氧化钙固体在水中达到溶解平衡时,为使氢氧化钙固体的量减少,需要加入少量的( )
A NH4NO3固体
B NaOH固体
C CaCl2固体
D NaHSO4固体AD【思考与交流】
怎样判断难溶电解质已经达到溶解平衡?交流研讨二、沉淀溶解平衡常数—溶度积KSP对于溶解平衡:
例如:Mg(OH)2(s) Mg2+(aq) + 2OH-(aq)有:
KSP=[c(Mg2+)]·[c(OH-)]2
在一定温度下, KSP是一个常数。
2、溶液中有关离子浓度幂的乘积—离子积QC(任意时刻溶液中离子浓度幂的乘积)。溶液过饱和,有沉淀析出溶液饱和,沉淀与溶解处于平衡状态溶液未饱和,可继续溶解该难溶电解质1、定义:难溶电解质的溶解平衡中,离子浓度幂的乘积。
难溶电解质已达溶解平衡二、沉淀反应的应用1、沉淀的生成应用:生成难溶电解质的沉淀,是工业生产、环保工程和科学研究中除杂或提纯物质的重要方法之一。沉淀生成的方法① 调pH值如:工业原料氯化铵中混有氯化铁,使其溶解于水,再加氨水调pH值至7~8,可使Fe3+转变为Fe(OH)3沉淀而除去。Fe3+ + 3NH3?H2O=Fe(OH)3↓+3NH4+ ② 加沉淀剂
如:要沉淀Cu2+、Hg2+等离子,可以用Na2S、H2S做沉淀剂Cu2++S2-= CuS↓
Hg2++S2-= HgS↓2、沉淀的溶解(1)原理 设法不断移去溶解平衡体系中的相应离子,使平衡向沉淀溶解的方向移动。(2)举例a、难溶于水的盐溶于酸中
如:CaCO3溶于盐酸,FeS、Al(OH)3、Cu(OH)2溶于强酸。b 、难溶于水的电解质溶于某些盐溶液
如:Mg(OH)2溶于NH4Cl溶液思考与交流 用平衡移动的原理分析Mg(OH)2溶于盐酸和NH4Cl溶液的原因。应用:为什么医学上常用BaSO4作为内服造影剂“钡餐”,而不用BaCO3作为内服造影剂“钡餐”?沉淀溶解的应用举例 3、沉淀的转化(1)沉淀转化的方法
对于一些用酸或其他方法也不能溶解的沉淀,可以先将其转化为另一种用酸或其他方法能溶解的
沉淀。
(2)沉淀转化的实质
沉淀转化的实质是沉淀溶解平衡移动。一般溶解度小的沉淀转化成溶解度更小的沉淀容易实现。(3)沉淀转化的应用
沉淀的转化在科研和生产中具有重要的应用价值。归纳总结
