人教版高中化学选修四1-1 反应热 热化学方程式教学课件36张PPT
文档属性
| 名称 | 人教版高中化学选修四1-1 反应热 热化学方程式教学课件36张PPT |  | |
| 格式 | zip | ||
| 文件大小 | 326.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-11-19 20:02:43 | ||
图片预览










文档简介
课件36张PPT。第一章 化学反应与能量第一节 化学反应与能量的变化1.下列反应属于吸热反应的是
① 氢气还原氧化铜 ② 氢气在氧气中燃烧
③ 氢氧化钾和硫酸中和
④ 碳酸钙高温分解成氧化钙和二氧化碳
⑤ 二氧化碳与赤热的碳反应生成一氧化碳
⑥ 葡萄糖在人体内氧化分解
⑦ Ba(OH)2·8H2O与NH4Cl反应
⑧ 锌粒与稀H2SO4反应制取H2
A.①④⑤⑥⑦ B.②③④⑤
C.①④⑤⑦ D.④⑤⑥⑦回顾C 1. 常见的放热反应:
(1)所有的燃烧反应 (2)酸碱中和反应
(3)大多数的化合反应 (4)金属与酸的反应
(5)物质的缓慢氧化 常见的放热过程:浓H2SO4固体NaOH溶于水(6)化学键的形成 2. 常见的吸热反应:
(1)晶体Ba(OH)2?8H2O+NH4Cl的反应
(2)大多数的分解反应
(3)以H2、CO、C为还原剂的反应(4)化学键的断裂常见的吸热过程:硝酸铵溶于水2. 已知反应A+B=C+D为放热反应,对该反应的下列说法中正确的是( )
A. A的能量一定高于C
B. B的能量一定高于D
C. A和B的总能量一定高于C和D的总能量
D. 该反应为放热反应,故不必加热就一定发生C3. 氢气在氧气中燃烧产生蓝色火焰,在反应中,
破坏1molH-H键消耗的能量为Q1kJ,
破坏1molO = O键消耗的能量为Q2kJ,
形成1molH-O键释放的能量为Q3kJ。
下列关系式中正确的是( )
A. 2Q1 + Q2 > 4Q3 B. 2Q1 + Q2 < 4Q3
C. Q1 + Q2 < Q3 D. Q1 + Q2 = Q3B断键吸收总能量 <成键放出总能量断键吸收总能量 > 成键放出总能量反应物的总能量 >生成物的总能量反应物的总能量 <生成物的总能量宏观取决于反应物和生成物的总能量的相对大小。微观取决于化学键的断裂和形成一、反应热 焓变反应热:化学反应过程中所释放或吸收的热量单位:kJ/mol或kJ?mol-1焓变:生成物与反应物的焓值差符号:△H恒压条件下,化学反应的反应热等于焓变 放热反应:
吸热反应:ΔH<0或 ΔH为“-”ΔH>0 或ΔH为“+”放热△H<0吸热△H>0规定:ΔH = ∑ E 生成物–∑ E 反应物△H=∑反应物键能—∑生成物键能例1:1molC与1molH2O(g)反应生成lmolCO(g)和1molH2(g),需要吸收131.5kJ的热量,该反应的反应热为△H= kJ/mol。+131.51molC完全燃烧的反应热为△H1,2molC完全燃烧的反应热为△H2,则△H1 △H2。(<,>,=)>则反应1/2N2(g)+3/2H2(g) NH3(l)的△H= 。思考:已知反应N2+3H2 2NH3的能量变化如下图 : △H=∑反应物键能—∑生成物键能或[a-(b+c)]kJ/mol-[(b+c)-a]kJ/mol例2、已知键能:
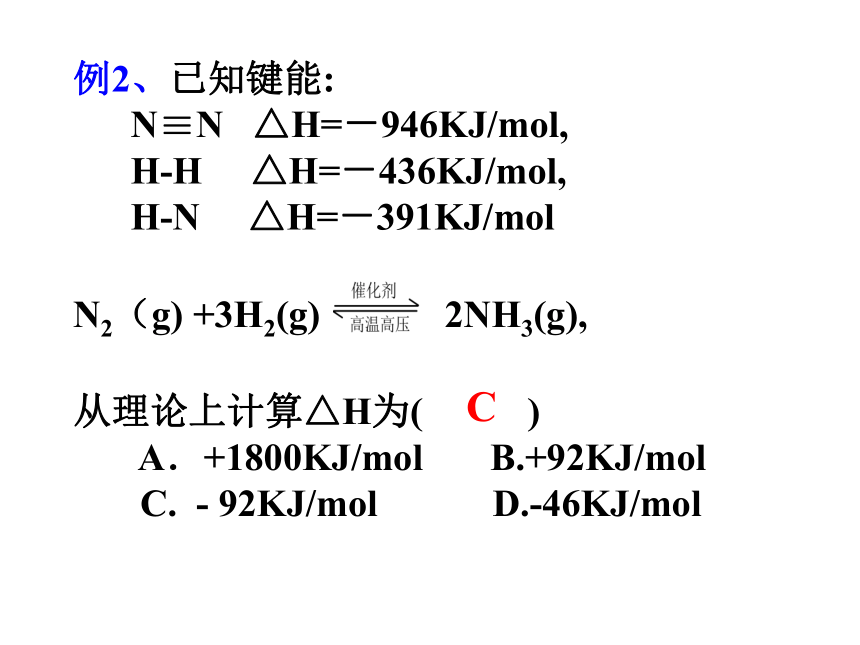
N≡N △H=-946KJ/mol,
H-H △H=-436KJ/mol,
H-N △H=-391KJ/mol
N2(g) +3H2(g) 2NH3(g),
从理论上计算△H为( )
A.+1800KJ/mol B.+92KJ/mol
C. - 92KJ/mol D.-46KJ/mol
C△H = 反应物总键能 - 生成物总键能△H = 生成物总能量 – 反应物总能量△H<0 放热反应△H>0 吸热反应吸热放热小结:键能大→物质稳定→能量低键能小→物质不稳定→能量高1.将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可见
A. NH4HCO3和盐酸的反应是放热反应
B.该反应中,热能转化为产物内部的能量
C.反应物的总能量高于生成物的总能量
D.反应的化学方程式为:NH4HCO3+HCl→NH4Cl+CO2↑+H2O △H<0B课堂巩固 2.(08年海南化学·8)白磷与氧可发生如下反应:
P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量,分别为:
P—P a kJ·mol—1、
P—O b kJ·mol—1、
P=O c kJ·mol—1、
O=O d kJ·mol—1。
根据图示的分子结构和有关数据估算该反应的△H,
其中正确的是
A.(6a+5d-4c-12b)kJ·mol—1
B.(4c+12b-6a-5d)kJ·mol—1
C.(4c+12b-4a-5d)kJ·mol—1A3、已知反应:
S(g)+O2(g)=SO2(g) ΔH=-297.3kJ/mol
分析下列说法中正确的是(多选) ( )
A.S(g)+O2(g)=SO2(l) ΔH>-297.3KJ/mol
B.S(g)+O2(g)=SO2(l) ΔH<-297.3KJ/mol
C.1molSO2(g)的键能总和大于1molS(g)和
1molO2(g)键能之和
D.1molSO2(g)的键能总和小于1molS(g)和
1molO2(g)键能之和B C4、已知金刚石和石墨是两种不同的单质,1mol石墨转化为金刚石时要吸收1.895KJ的热能,则下列说法正确的是(多选) :( )
A、石墨比金刚石稳定
B、金刚石比石墨稳定
C、1mol石墨比1mol金刚石的总能量高
D、1mol金刚石比1mol石墨的总能量高A D我们认识了反应热,那么如何表示某一化学反应是放热还是吸热?放热多少,吸热多少?阅读课本例1与例2,并思考:与化学方程式相比,热化学方程式有哪些不同?
正确书写热化学方程式应注意哪几点?热化学方程式: g—gas(气体) l—liquid(液体) s—solid(固体) 能够表示化学反应热效应的化学方程式 二、热化学方程式 能表示参加反应物质的量和反应热的
关系的化学方程式。1、定义:含义:热化学方程式不仅表示物质变化,还表示了能量变化.(1)写出配平的化学方程式;标明各物质的聚集状态
(s—固体、l—液体、g—气体、aq—溶液)。
(2)注明反应的温度和压强
(在101 kPa和25℃时的数据,可不特别注明) (4)写出△H的值并标明“+”与“─”;单位:KJ/mol。(3) 热化学方程式中,化学计量数只表示分子的物质的
量,它可以是整数,也可以是分数。
检查化学计量数和△H值是否对应(成正比例)。 2、书写热化学方程式的注意事项(5)逆向的反应热与正反应数值相等,符号相反。 如:H2(g) + Cl2(g)=2HCl(g) ?H =-184.6KJ/mol
1/2H2(g)+1/2Cl2(g)= HCl(g) ?H =-92.3KJ/mol但不需要注明反应的条件,不用↑或↓符号。(3)2.00gC2H2完全燃烧生成液态水和CO2放出
的热量为100 KJ则C2H2燃烧的热化学方程式为:2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);△H=-2589.6KJ/mol例1、写出下列反应的热化学方程式(1)1molC(固态)与适量H2O(气态) 反应,生成
CO(气态)和H2(气态),吸收131.3kJ的热量 C(s)+H2O(g)=CO(g)+H2(g); △H=+131.3KJ/mol(2)0.5molCu(固态) 与适量O2(气态) 反应, 生成
CuO(固态), 放出78.5 kJ的热量 2Cu(s)+O2(g)=2CuO(s); △H=-314KJ/mol 热化学方程式的书写热化学方程式的书写步骤:1、写出配平的化学反应方程式
2、注明反应物和生成物的状态
3、标明反应热△H(注意单位和+、-)
4、检查1、沼气的主要成分是甲烷。0.5 mol CH4完全燃烧
生成CO2和H2O时,放出445 kJ的热量。则下列热化学方程式中正确的是( )A、2CH4( g ) + 4O2( g ) = 2CO2( g ) + 4H2O ( l )
ΔH = + 890 kJ/mol B、CH4 + 2O2 = CO2 + H2O ΔH = – 890 kJ/mol C、CH4 ( g ) + 2 O2 ( g ) = CO2 ( g ) + 2 H2O ( l )
ΔH = – 890 kJ/mol D、 1/2CH4 ( g ) + O2 ( g ) = 1/2CO2 ( g ) + H2O ( l )
ΔH = – 890 kJ/mol CΔH = – 445 kJ/mol课堂练习2、已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是
A. H2O(g)=H2(g)+1/2O2(g)
ΔH=+242kJ·mol-1
B. 2H2(g)+O2(g)=2H2O
ΔH=-484kJ·mol-1
C. H2(g)+1/2O2(g)=H2O(g)
ΔH=+242kJ·mol-1
D. 2H2(g)+O2(g)=2H2O(g)
ΔH=+484kJ·mol-1 A课堂练习3、在同温同压下,下列各组热化学方程式中, △H2>△H1的是(多选)
A.2H2(g) + O2(g)= 2H2O(g) △H1
2H2(g) + O2(g) = 2H2O(l) △H2
B.S(g) + O2(g) =SO2(g) △H1
S(s) + O2(g) = SO2(g) △H2
C.CO(g) + 1/2 O2(g) = CO2(g) △H1
2CO(g) + O2(g) = 2CO2(g) △H2
D.H2(g) +Cl2(g)=2HCl(g) △H1
1/2 H2(g) + 1/2 Cl2(g) = HCl(g) △H2 BD4.已知在25℃、101kPa下,1gC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ 热量。
试写出该反应的热化学方程式
C8H18(l)+25/2O2(g)=8CO2 (g) +9H2O(l)
△H= - 5518kJ·mol -15.已知1克氨气完全分解为氮气和氢气时,需吸收2.718 kJ热量,则氮气和氢气化合生成氨气的热化学方程式可表示为 。N2(g)+ 3H2(g) = 2NH3(g) △H=-92.4 kJ·mol-1 三、中和热 1、酸和碱的中和反应有热量放出,可以通过实验测得中和反应的反应热。当1L1mol/L的稀盐酸跟1L1 mol/L的NaOH溶液起中和反应时,能放出57.3kJ的热量。
NaOH(aq)+HCI(aq)=NaCl(aq)+H2O(l)
ΔH=-57.3 kJ/mol2、如果用1L1mol/L的 KOH溶液中和 1L1mol/L的HNO3溶液,也能放出57.3 kJ的热量。
KOH(aq)+HNO3(aq)=KNO3(aq)+H2O(l)
ΔH=-57.3 kJ/mol 本质相同,其离子方程式都是:H++OH- = H2O 三、中和热
1.定义:在稀溶液中,酸跟碱发生中和反应,生成1mol水时释放的热量叫做中和热。
2. 中和热的表示:
H+(aq)+OH-(aq)=H2O (1) △H=-57.3kJ/mol
3.要点:
Ⅰ、条件:稀溶液。稀溶液是指溶于大量水的离子
Ⅱ、反应物: (强)酸与(强)碱。
中和热不包括离子在水溶液中的生成热、电解质电离的吸热所伴随的热效应
Ⅲ、生成1mol水。中和反应的实质是H+和OH-化合生成H2O,若反应过程中有其他物质生成,这部分反应热也不在中和热之内
Ⅳ、放出的热量:57.3kJ/mol理解:已知H+(aq)+OH-(aq)=H2O(l);
?H=-57.3kJ/mol ,则:
(1)用0.5molNaOH配成稀溶液跟足量稀盐酸反应放出 kJ的热量。对应的热化学
反应方程式为 。
(2)用0.5molBa(OH)2配成稀溶液跟足量稀硝酸反应,放出 kJ的热量。
(3)用0.5molNaOH配成稀溶液跟足量稀醋酸反应放出 kJ的热量。
(4)用0.5molBa(OH)2配成稀溶液跟含溶质0.5mol的稀硫酸反应,放出 kJ的热量。
28.757.3少于28.7大于57.3NaOH(aq)+HCl(aq)=KCl(aq)+H2O(l)ΔH=-57.3 kJ/mol此时,与浓硫酸作比较呢? 实践活动
中和热的测定●实验目的
测定强酸与强碱反应的反应热●学习重点
中和反应反应热的测定原理和方法。阅读教材,观看实验视频,了解实验用品及步骤并思考:实验需测定的数据有哪些(即实验原理如何)?中和热的测定实验视频 实验原理: Q=mc△t Q : 中和反应放出的热量 m: 反应混合液的质量 c: 混合液的比热容 △t: 反应前后的温度差●实验用品
大烧杯(500 mL)、小烧杯(100 mL)
温度计、量筒(50 mL)两个、泡沫塑料 或纸条、泡沫塑料板或硬纸板(中心有两个小孔)、环形玻璃搅拌棒。
0.50 mol/L 盐酸、0.55 mol/L NaOH溶液数据处理Q =m c Δt已知 V酸=V碱=50 mL。 c酸=0.50 mol/L
c碱=0.55 mol/L。ρ酸=ρ碱=1 g/cm3 c=4.18 J(g·℃)
请把以上数据代入,得出Q的表示式。 Q = 0.418(t2-t1)kJ 本实验中,我们所用一元酸、一元碱的体积均为50 mL,它 们的浓度均为0.50 mol/L。由于是稀溶液,且为了计算简便,我们近似地认为,所用酸、碱溶液的密度均为1 g/cm3,且中和后所得溶液的比热容为
4.18 J/(g·℃)【小结】
(1)用隔热装置,尽量减少热量散失;
(2)温度计越精确越好
(3)酸与碱的浓度一般为稀溶液,且一般使碱稍微 过量,以确保酸完全反应
(4)注意控制反应时间
(5)多做几次,取平均值
讨论:
要想提高中和热测定的准确性,
实验时应注意什么?练习、50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题:
(1)从实验装置上看,图中尚缺少的
一种玻璃用品是______________;
(2)由图可知该装置有不妥之处,应如何改正?
(3)烧杯间填满碎塑料泡沫的作用是_________________。
(4)大烧杯上如不盖硬纸板,则求得的中和热数值_______
(填“偏大”、“偏小’、“无影响”)。环形玻璃搅拌棒 在大小烧杯间填满碎塑料泡沫(或碎纸条)使小烧杯口与大烧杯口相平 减少热量损失 偏小 练习4、50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题:
(5)实验中改用60 mL 0.50 mol/L的
盐酸跟50mL 0.55 mol/L的NaOH
溶液进行反应,与上述实验相比,
所放出的热量_________(填“相等”或“不相等”),理
由是_________________________________________;
若实验操作均正确,所求中和热的数值会__________
(填“相 等”或“不相等”),不相等 因为酸碱发生中和反应放出的热量与酸碱的用量有关 相等 练习4、50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。(6)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 ;用50 mL 0.50mol/L NaOH溶液进行上述实验,测得的中和热的数值会 。(均填“偏大”“偏小”“无影响”)
偏小偏小
① 氢气还原氧化铜 ② 氢气在氧气中燃烧
③ 氢氧化钾和硫酸中和
④ 碳酸钙高温分解成氧化钙和二氧化碳
⑤ 二氧化碳与赤热的碳反应生成一氧化碳
⑥ 葡萄糖在人体内氧化分解
⑦ Ba(OH)2·8H2O与NH4Cl反应
⑧ 锌粒与稀H2SO4反应制取H2
A.①④⑤⑥⑦ B.②③④⑤
C.①④⑤⑦ D.④⑤⑥⑦回顾C 1. 常见的放热反应:
(1)所有的燃烧反应 (2)酸碱中和反应
(3)大多数的化合反应 (4)金属与酸的反应
(5)物质的缓慢氧化 常见的放热过程:浓H2SO4固体NaOH溶于水(6)化学键的形成 2. 常见的吸热反应:
(1)晶体Ba(OH)2?8H2O+NH4Cl的反应
(2)大多数的分解反应
(3)以H2、CO、C为还原剂的反应(4)化学键的断裂常见的吸热过程:硝酸铵溶于水2. 已知反应A+B=C+D为放热反应,对该反应的下列说法中正确的是( )
A. A的能量一定高于C
B. B的能量一定高于D
C. A和B的总能量一定高于C和D的总能量
D. 该反应为放热反应,故不必加热就一定发生C3. 氢气在氧气中燃烧产生蓝色火焰,在反应中,
破坏1molH-H键消耗的能量为Q1kJ,
破坏1molO = O键消耗的能量为Q2kJ,
形成1molH-O键释放的能量为Q3kJ。
下列关系式中正确的是( )
A. 2Q1 + Q2 > 4Q3 B. 2Q1 + Q2 < 4Q3
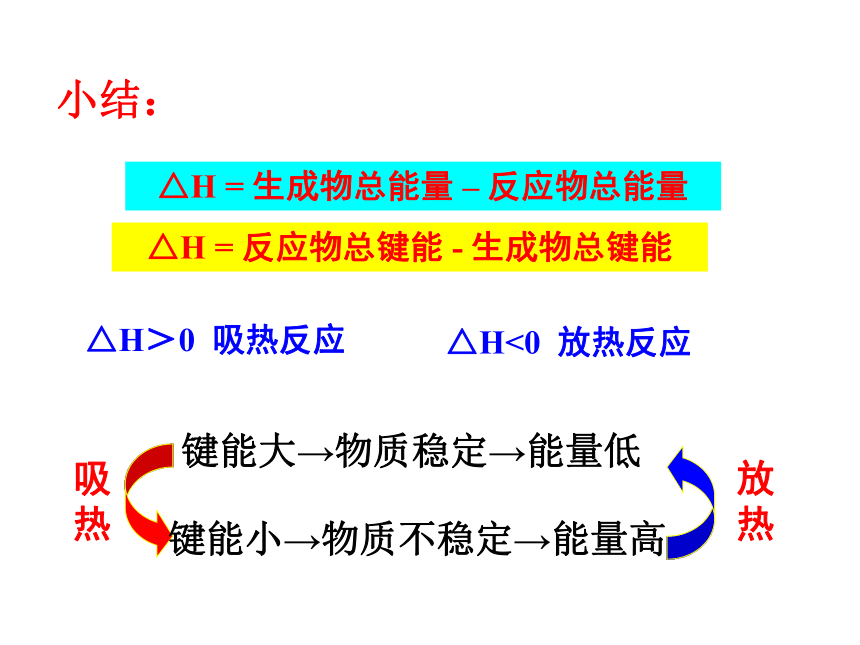
C. Q1 + Q2 < Q3 D. Q1 + Q2 = Q3B断键吸收总能量 <成键放出总能量断键吸收总能量 > 成键放出总能量反应物的总能量 >生成物的总能量反应物的总能量 <生成物的总能量宏观取决于反应物和生成物的总能量的相对大小。微观取决于化学键的断裂和形成一、反应热 焓变反应热:化学反应过程中所释放或吸收的热量单位:kJ/mol或kJ?mol-1焓变:生成物与反应物的焓值差符号:△H恒压条件下,化学反应的反应热等于焓变 放热反应:
吸热反应:ΔH<0或 ΔH为“-”ΔH>0 或ΔH为“+”放热△H<0吸热△H>0规定:ΔH = ∑ E 生成物–∑ E 反应物△H=∑反应物键能—∑生成物键能例1:1molC与1molH2O(g)反应生成lmolCO(g)和1molH2(g),需要吸收131.5kJ的热量,该反应的反应热为△H= kJ/mol。+131.51molC完全燃烧的反应热为△H1,2molC完全燃烧的反应热为△H2,则△H1 △H2。(<,>,=)>则反应1/2N2(g)+3/2H2(g) NH3(l)的△H= 。思考:已知反应N2+3H2 2NH3的能量变化如下图 : △H=∑反应物键能—∑生成物键能或[a-(b+c)]kJ/mol-[(b+c)-a]kJ/mol例2、已知键能:
N≡N △H=-946KJ/mol,
H-H △H=-436KJ/mol,
H-N △H=-391KJ/mol
N2(g) +3H2(g) 2NH3(g),
从理论上计算△H为( )
A.+1800KJ/mol B.+92KJ/mol
C. - 92KJ/mol D.-46KJ/mol
C△H = 反应物总键能 - 生成物总键能△H = 生成物总能量 – 反应物总能量△H<0 放热反应△H>0 吸热反应吸热放热小结:键能大→物质稳定→能量低键能小→物质不稳定→能量高1.将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可见
A. NH4HCO3和盐酸的反应是放热反应
B.该反应中,热能转化为产物内部的能量
C.反应物的总能量高于生成物的总能量
D.反应的化学方程式为:NH4HCO3+HCl→NH4Cl+CO2↑+H2O △H<0B课堂巩固 2.(08年海南化学·8)白磷与氧可发生如下反应:
P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量,分别为:
P—P a kJ·mol—1、
P—O b kJ·mol—1、
P=O c kJ·mol—1、
O=O d kJ·mol—1。
根据图示的分子结构和有关数据估算该反应的△H,
其中正确的是
A.(6a+5d-4c-12b)kJ·mol—1
B.(4c+12b-6a-5d)kJ·mol—1
C.(4c+12b-4a-5d)kJ·mol—1A3、已知反应:
S(g)+O2(g)=SO2(g) ΔH=-297.3kJ/mol
分析下列说法中正确的是(多选) ( )
A.S(g)+O2(g)=SO2(l) ΔH>-297.3KJ/mol
B.S(g)+O2(g)=SO2(l) ΔH<-297.3KJ/mol
C.1molSO2(g)的键能总和大于1molS(g)和
1molO2(g)键能之和
D.1molSO2(g)的键能总和小于1molS(g)和
1molO2(g)键能之和B C4、已知金刚石和石墨是两种不同的单质,1mol石墨转化为金刚石时要吸收1.895KJ的热能,则下列说法正确的是(多选) :( )
A、石墨比金刚石稳定
B、金刚石比石墨稳定
C、1mol石墨比1mol金刚石的总能量高
D、1mol金刚石比1mol石墨的总能量高A D我们认识了反应热,那么如何表示某一化学反应是放热还是吸热?放热多少,吸热多少?阅读课本例1与例2,并思考:与化学方程式相比,热化学方程式有哪些不同?
正确书写热化学方程式应注意哪几点?热化学方程式: g—gas(气体) l—liquid(液体) s—solid(固体) 能够表示化学反应热效应的化学方程式 二、热化学方程式 能表示参加反应物质的量和反应热的
关系的化学方程式。1、定义:含义:热化学方程式不仅表示物质变化,还表示了能量变化.(1)写出配平的化学方程式;标明各物质的聚集状态
(s—固体、l—液体、g—气体、aq—溶液)。
(2)注明反应的温度和压强
(在101 kPa和25℃时的数据,可不特别注明) (4)写出△H的值并标明“+”与“─”;单位:KJ/mol。(3) 热化学方程式中,化学计量数只表示分子的物质的
量,它可以是整数,也可以是分数。
检查化学计量数和△H值是否对应(成正比例)。 2、书写热化学方程式的注意事项(5)逆向的反应热与正反应数值相等,符号相反。 如:H2(g) + Cl2(g)=2HCl(g) ?H =-184.6KJ/mol
1/2H2(g)+1/2Cl2(g)= HCl(g) ?H =-92.3KJ/mol但不需要注明反应的条件,不用↑或↓符号。(3)2.00gC2H2完全燃烧生成液态水和CO2放出
的热量为100 KJ则C2H2燃烧的热化学方程式为:2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);△H=-2589.6KJ/mol例1、写出下列反应的热化学方程式(1)1molC(固态)与适量H2O(气态) 反应,生成
CO(气态)和H2(气态),吸收131.3kJ的热量 C(s)+H2O(g)=CO(g)+H2(g); △H=+131.3KJ/mol(2)0.5molCu(固态) 与适量O2(气态) 反应, 生成
CuO(固态), 放出78.5 kJ的热量 2Cu(s)+O2(g)=2CuO(s); △H=-314KJ/mol 热化学方程式的书写热化学方程式的书写步骤:1、写出配平的化学反应方程式
2、注明反应物和生成物的状态
3、标明反应热△H(注意单位和+、-)
4、检查1、沼气的主要成分是甲烷。0.5 mol CH4完全燃烧
生成CO2和H2O时,放出445 kJ的热量。则下列热化学方程式中正确的是( )A、2CH4( g ) + 4O2( g ) = 2CO2( g ) + 4H2O ( l )
ΔH = + 890 kJ/mol B、CH4 + 2O2 = CO2 + H2O ΔH = – 890 kJ/mol C、CH4 ( g ) + 2 O2 ( g ) = CO2 ( g ) + 2 H2O ( l )
ΔH = – 890 kJ/mol D、 1/2CH4 ( g ) + O2 ( g ) = 1/2CO2 ( g ) + H2O ( l )
ΔH = – 890 kJ/mol CΔH = – 445 kJ/mol课堂练习2、已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是
A. H2O(g)=H2(g)+1/2O2(g)
ΔH=+242kJ·mol-1
B. 2H2(g)+O2(g)=2H2O
ΔH=-484kJ·mol-1
C. H2(g)+1/2O2(g)=H2O(g)
ΔH=+242kJ·mol-1
D. 2H2(g)+O2(g)=2H2O(g)
ΔH=+484kJ·mol-1 A课堂练习3、在同温同压下,下列各组热化学方程式中, △H2>△H1的是(多选)
A.2H2(g) + O2(g)= 2H2O(g) △H1
2H2(g) + O2(g) = 2H2O(l) △H2
B.S(g) + O2(g) =SO2(g) △H1
S(s) + O2(g) = SO2(g) △H2
C.CO(g) + 1/2 O2(g) = CO2(g) △H1
2CO(g) + O2(g) = 2CO2(g) △H2
D.H2(g) +Cl2(g)=2HCl(g) △H1
1/2 H2(g) + 1/2 Cl2(g) = HCl(g) △H2 BD4.已知在25℃、101kPa下,1gC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ 热量。
试写出该反应的热化学方程式
C8H18(l)+25/2O2(g)=8CO2 (g) +9H2O(l)
△H= - 5518kJ·mol -15.已知1克氨气完全分解为氮气和氢气时,需吸收2.718 kJ热量,则氮气和氢气化合生成氨气的热化学方程式可表示为 。N2(g)+ 3H2(g) = 2NH3(g) △H=-92.4 kJ·mol-1 三、中和热 1、酸和碱的中和反应有热量放出,可以通过实验测得中和反应的反应热。当1L1mol/L的稀盐酸跟1L1 mol/L的NaOH溶液起中和反应时,能放出57.3kJ的热量。
NaOH(aq)+HCI(aq)=NaCl(aq)+H2O(l)
ΔH=-57.3 kJ/mol2、如果用1L1mol/L的 KOH溶液中和 1L1mol/L的HNO3溶液,也能放出57.3 kJ的热量。
KOH(aq)+HNO3(aq)=KNO3(aq)+H2O(l)
ΔH=-57.3 kJ/mol 本质相同,其离子方程式都是:H++OH- = H2O 三、中和热
1.定义:在稀溶液中,酸跟碱发生中和反应,生成1mol水时释放的热量叫做中和热。
2. 中和热的表示:
H+(aq)+OH-(aq)=H2O (1) △H=-57.3kJ/mol
3.要点:
Ⅰ、条件:稀溶液。稀溶液是指溶于大量水的离子
Ⅱ、反应物: (强)酸与(强)碱。
中和热不包括离子在水溶液中的生成热、电解质电离的吸热所伴随的热效应
Ⅲ、生成1mol水。中和反应的实质是H+和OH-化合生成H2O,若反应过程中有其他物质生成,这部分反应热也不在中和热之内
Ⅳ、放出的热量:57.3kJ/mol理解:已知H+(aq)+OH-(aq)=H2O(l);
?H=-57.3kJ/mol ,则:
(1)用0.5molNaOH配成稀溶液跟足量稀盐酸反应放出 kJ的热量。对应的热化学
反应方程式为 。
(2)用0.5molBa(OH)2配成稀溶液跟足量稀硝酸反应,放出 kJ的热量。
(3)用0.5molNaOH配成稀溶液跟足量稀醋酸反应放出 kJ的热量。
(4)用0.5molBa(OH)2配成稀溶液跟含溶质0.5mol的稀硫酸反应,放出 kJ的热量。
28.757.3少于28.7大于57.3NaOH(aq)+HCl(aq)=KCl(aq)+H2O(l)ΔH=-57.3 kJ/mol此时,与浓硫酸作比较呢? 实践活动
中和热的测定●实验目的
测定强酸与强碱反应的反应热●学习重点
中和反应反应热的测定原理和方法。阅读教材,观看实验视频,了解实验用品及步骤并思考:实验需测定的数据有哪些(即实验原理如何)?中和热的测定实验视频 实验原理: Q=mc△t Q : 中和反应放出的热量 m: 反应混合液的质量 c: 混合液的比热容 △t: 反应前后的温度差●实验用品
大烧杯(500 mL)、小烧杯(100 mL)
温度计、量筒(50 mL)两个、泡沫塑料 或纸条、泡沫塑料板或硬纸板(中心有两个小孔)、环形玻璃搅拌棒。
0.50 mol/L 盐酸、0.55 mol/L NaOH溶液数据处理Q =m c Δt已知 V酸=V碱=50 mL。 c酸=0.50 mol/L
c碱=0.55 mol/L。ρ酸=ρ碱=1 g/cm3 c=4.18 J(g·℃)
请把以上数据代入,得出Q的表示式。 Q = 0.418(t2-t1)kJ 本实验中,我们所用一元酸、一元碱的体积均为50 mL,它 们的浓度均为0.50 mol/L。由于是稀溶液,且为了计算简便,我们近似地认为,所用酸、碱溶液的密度均为1 g/cm3,且中和后所得溶液的比热容为
4.18 J/(g·℃)【小结】
(1)用隔热装置,尽量减少热量散失;
(2)温度计越精确越好
(3)酸与碱的浓度一般为稀溶液,且一般使碱稍微 过量,以确保酸完全反应
(4)注意控制反应时间
(5)多做几次,取平均值
讨论:
要想提高中和热测定的准确性,
实验时应注意什么?练习、50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题:
(1)从实验装置上看,图中尚缺少的
一种玻璃用品是______________;
(2)由图可知该装置有不妥之处,应如何改正?
(3)烧杯间填满碎塑料泡沫的作用是_________________。
(4)大烧杯上如不盖硬纸板,则求得的中和热数值_______
(填“偏大”、“偏小’、“无影响”)。环形玻璃搅拌棒 在大小烧杯间填满碎塑料泡沫(或碎纸条)使小烧杯口与大烧杯口相平 减少热量损失 偏小 练习4、50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题:
(5)实验中改用60 mL 0.50 mol/L的
盐酸跟50mL 0.55 mol/L的NaOH
溶液进行反应,与上述实验相比,
所放出的热量_________(填“相等”或“不相等”),理
由是_________________________________________;
若实验操作均正确,所求中和热的数值会__________
(填“相 等”或“不相等”),不相等 因为酸碱发生中和反应放出的热量与酸碱的用量有关 相等 练习4、50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。(6)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 ;用50 mL 0.50mol/L NaOH溶液进行上述实验,测得的中和热的数值会 。(均填“偏大”“偏小”“无影响”)
偏小偏小
