人教版高中化学选修四1-3 化学反应热的计算 课件29张PPT
文档属性
| 名称 | 人教版高中化学选修四1-3 化学反应热的计算 课件29张PPT |  | |
| 格式 | zip | ||
| 文件大小 | 312.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-11-19 20:03:21 | ||
图片预览







文档简介
课件29张PPT。第一章 化学反应与能量第三节 化学反应热的计算 已知:H2(g) + Cl2(g) = 2HCl(g)
△H= -184.6kJ/mol
则反应HCl(g)=1/2H2(g)+1/2Cl2(g)的△H为( )A. +184.6 kJ/mol B. -92.3 kJ/mol
C. -369.2 kJ/mol D. +92.3 kJ/mol复习D规律: “正逆”反应反应热数值相等,符号相反 H2(g)+1/2O2(g) = H2O(g) △H1= - 241.8kJ/mol
那么,H2的燃烧热△H究竟是多少?如何计算?
已知: H2O(g)= H2O(l) △H2= - 44 kJ/mol
H2(g)+1/2O2(g)= H2O(l)
△H=△H1+△H2= -285.8kJ/mol
下列数据△H1表示燃烧热吗?判断①②③ ①+②=③ 如何测出下列反应的反应热:
C(s)+1/2O2(g)= CO(g) ΔH1=?思考①C(s)+1/2O2(g)= CO(g) ΔH1=?
②CO(g)+1/2O2(g)= CO2(g) ΔH2= -283.0kJ/mol
③C(s)+O2(g)= CO2(g) ΔH3= -393.5kJ/mol不能很好的控制反应程度,故不能直接通过实验测得△H1① + ② = ③ ,
则 ΔH1 + ΔH2 =ΔH3
所以,ΔH1=ΔH3 - ΔH2 = - 393.5kJ/mol + 283.0kJ/mol
= - 110.5kJ/mol上两例应用了什么规律?盖斯定律不管化学反应是分一步完成或分
几步完成,其反应热是相同的。
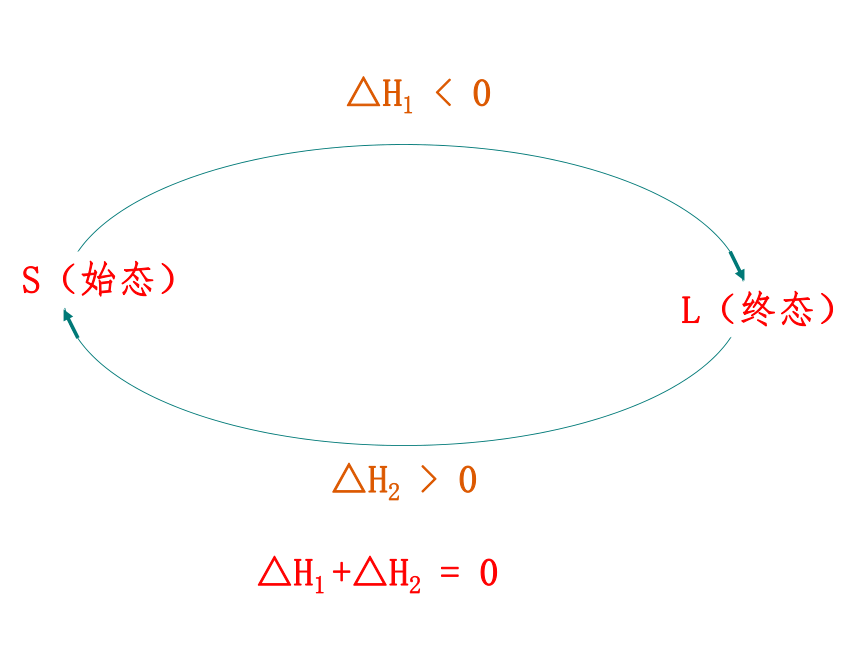
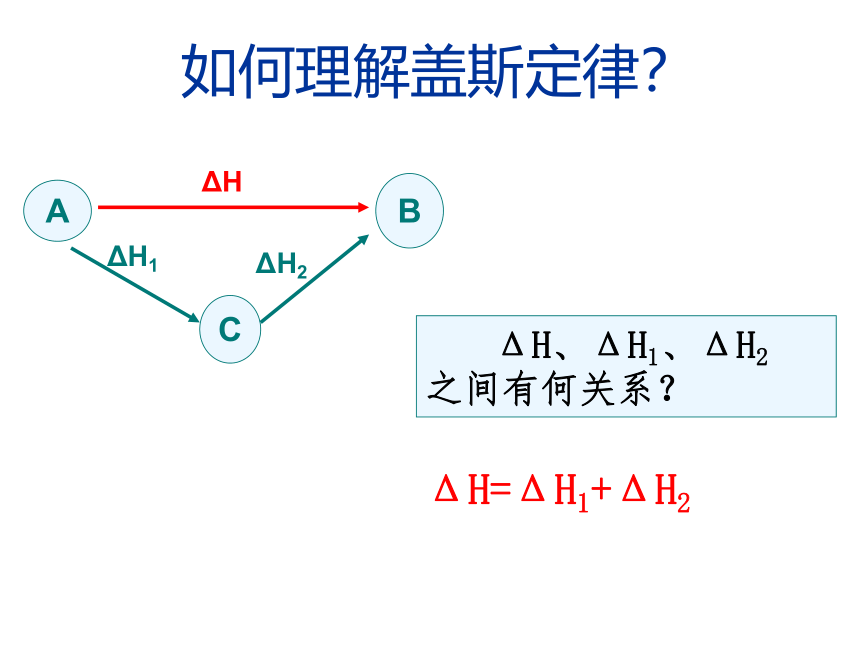
化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。一.换句话说△H2 > 0△H1 < 0S(始态)L(终态)△H1 +△H2 = 0如何理解盖斯定律? ΔH、ΔH1、ΔH2
之间有何关系?ΔH=ΔH1+ΔH2BΔHACΔH1ΔH2例1:已知下列各反应的焓变
①Ca(s)+C(s,石墨)+3/2O2(g)= CaCO3(s)
△H1 = -1206.8 kJ/mol
②Ca(s)+1/2O2(g)= CaO(s)
△H2= -635.1 kJ/mol
③C(s,石墨)+O2(g)= CO2(g)
△H3 = -393.5 kJ/mol
试求④CaCO3(s)= CaO(s)+CO2(g)的焓变△H4= + 178.2kJ/mol④=②+③-①思考与交流:
你认为运用盖斯定律计算反应热的关键在哪里?关键:目标方程式的“四则运算式”的导出。方法:写出目标方程式确定“过渡物质”(要消去的物质)然后用消元法逐一消去“过渡物质,
导出“四则运算式”。例2:按照盖斯定律,结合下述反应方程式回答问题,已知:
①NH3(g)+HCl(g)= NH4Cl(s) △H1= -176kJ/mol
②NH3(g)= NH3(aq) △H2= -35.1kJ/mol
③HCl(g) = HCl(aq) △H3= -72.3kJ/mol
④NH3(aq)+ HCl(aq)= NH4Cl(aq) △H4= -52.3kJ/mol
⑤NH4Cl(s)= NH4Cl(aq) △H5=?
则第⑤个方程式中的反应热△H是________。
根据盖斯定律和上述反应方程式得:
⑤=④+③+②-①,
即△H5 = +16.3kJ/mol例3:同素异形体可以相互转化但反应热相当小而且转化速率慢,有时还很不完全,测定反应热很困难,现在可根据盖斯提出的观点分析。已知:①P4(s、白磷)+5O2(g)=P4O10(s)
△H1= -2983.2 kJ/mol②P(s、红磷)+5/4O2(g)=1/4P4O10(s)
△H2= -738.5 kJ/mol试写出白磷转化为红磷的热化学方程式 。 P4(s、白磷)= 4P(s、红磷) △= - 29.2kJ/mol①-4×②:你知道神六的火箭燃料是什么吗?例4:某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。已知相同状态下:
①N2(g)+2O2(g) = 2NO2(g) △H1= +67.7kJ/mol
②N2H4(g)+O2(g) = N2(g)+2H2O(l) △H2= -534kJ/mol
请写出发射火箭反应的热化学方程式。
2 N2H4(g)+ 2NO2(g)= 3N2(g)+4H2O(l)
△H= - 1135.2kJ/mol 2 × ②-①:1.已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为
C(石墨)+O2(g)= CO2(g) △H=-393.51kJ·mol-1
C(金刚石)+O2(g)= CO2(g) △ H=-395.41kJ·mol-1
据此判断,下列说法中正确的是( )
A、由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低
B、由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高
C、由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低
D、由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高A练习2.已知
① CO(g)+1/2O2(g)= CO2(g) ΔH1= -283.0 kJ/mol
② H2(g)+1/2O2(g)= H2O(l) ΔH2= -285.8 kJ/mol ③C2H5OH(l)+ 3O2(g)= 2CO2(g)+3H2O(l)
ΔH3= -1370 kJ/mol 试计算④2CO(g)+4H2(g)= H2O(l)+C2H5OH(l)的ΔH?
①×2 + ②×4 - ③ = ④ 所以,ΔH=ΔH1×2 +ΔH2×4 -ΔH3 ????? =-283.2×2 -285.8×4 +1370
=-339.2 kJ/mol 3. 在100 g 碳不完全燃烧所得气体中,CO占1/3体积,CO2占2/3体积,且
C(s)+1/2O2(g)= CO(g) △H=-110.35kJ/mol
CO(g)+1/2O2(g)= CO2(g) △H=-282.57kJ/mol
与这些碳完全燃烧相比,损失的热量是( )
392.92 kJ B. 2489.44 kJ
C. 784.92 kJ D. 3274.3 kJC4 .在同温同压下,下列各组热化学方程式中, △H2 >△H1的是(多选)
A.2H2(g) + O2(g)= 2H2O(g) △H1
2H2(g) + O2(g) = 2H2O(l) △H2
B.S(g) + O2(g) =SO2(g) △H1
S(s) + O2(g) = SO2(g) △H2
C.CO(g) + 1/2 O2(g) = CO2(g) △H1
2CO(g) + O2(g) = 2CO2(g) △H2
D.H2(g) +Cl2(g)=2HCl(g) △H1
1/2 H2(g) + 1/2 Cl2(g) = HCl(g) △H2 BD盖斯定律的灵活应用5.已知胆矾溶于水时溶液温度降低,
胆矾分解的热化学方程式为:
CuSO4?5H2O(s) = CuSO4(s)+5H2O(l)
△H=+Q1kJ/mol
室温下,若将1mol无水硫酸铜溶解为溶液
时放热Q2kJ,则( )
A.Q1>Q2 B.Q1=Q2
C. Q1A二. 反应热的计算(P12例题)例1:利用反应热的概念和摩尔质量进行计算
例2:利用燃烧热的概念和摩尔质量进行计算
例3:利用盖斯定律进行计算利用反应热的概念、盖斯定律、热化学方程式进行有关反应热的计算例4:利用键能进行计算
已知某些化学键键能数据如下:H—H:436 kJ·mol-1 Cl—Cl:243 kJ·mol-1 H—Cl :431 kJ·mol-1
则下列热化学方程式不正确的是 ( )
A. 1/2H2(g)+1/2Cl2(g) =HCl (g) ΔH=-91.5 kJ· mol -1
B. H2 (g) +Cl2 (g) =2HCl (g) ΔH=-183 kJ· mol-1
C. H2(g)+Cl2(g) =HCl (g) ΔH=+91.5 kJ· mol -1
D. 2HCl (g) = H2 (g)+Cl2 (g) ΔH=+183 kJ· mol-1
C已知:
欲得到相同的热量,需分别燃烧固体碳和氢气的质量比约为( )
A. 2 : 3.25 B. 12 : 3.25
C. 1 : 1 D. 393.5 : 241.8B变式练习1 变式练习2 氢气、一氧化碳、辛烷、甲烷燃烧的热化学方程式分别为:
H2(g)+1/2O2(g)=H2O(l);△H=-285.8kJ/mol
CO(g)+1/2O2(g)=CO2(g);△H=-283.0kJ/mol
C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l);
△H=-5518kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l);
△H=-890.3kJ/mol
相同质量的氢气、一氧化碳、辛烷、甲烷完全燃烧时放出热量最少的是( )
A. H2(g) B. CO(g) C. C8H18(l) D. CH4(g)B变式练习3 在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g)。反应过程中的能量关系可用右图简单表示(图中的ΔH表示生成1 mol产物的数据)。
(1)写出表示S8燃烧热
的热化学方程式
S8(s)+8O2(g)=8SO2(g)
ΔH=-8a kJ·mol-1
(2)写出SO3分解生成
SO2和O2的热化学方程式
2SO3(g)=2SO2(g)+O2(g) ΔH=+2b kJ·mol-1
(3)若已知1个S8分子中有8个硫硫键,硫氧键的键能为d kJ·mol-1,氧氧键的键能为e kJ·mol-1,则S8分子中硫硫键的键能为(2d-a-e) kJ·mol-1
已知:
2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ/mol CO(g)+1/2O2(g)=CO2(g) △H=-283.0kJ/mol
某H2和CO的混合气体完全燃烧时放出113.74kJ热量,同时生成3.6g液态水,求原混合气体中H2和CO的物质的量之比。提升练习12018-11-191一定条件下,氢气和丙烷燃烧的热化学方程式为:
2H2(g) + O2(g) = 2H2O(l) ΔH =- 571.6 kJ/mol
C3H8(g)+5O2(g)= 3CO2(g)+4H2O(l)
ΔH =- 2220 kJ/mol
5 mol 氢气和丙烷的混合气完全燃烧时放热
3847 kJ 则氢气和甲烷的体积比为 ( )
A. 1:3 B. 3:1 C. 1:4 D. 1:1
B提升练习22018-11-191 解1 :设H2、C3H8的物质的量分别为x,y x + y = 5(571.6/2)(x) + 2220y = 3847 x = 3.75 moly = 1.25 mol1mol H2 燃烧放热 285.8 kJ解2 :1mol 混合气 燃烧放热 3847kJ/5 = 769.4 kJ2018-11-191解3 :( 巧解) 5mol 混合气中,C3H8 物质的量必小于 2mol,H2 物质的量必大于3mol。∵ 2mol C3H8 燃烧放热 4440 kJ,
超过总放热量 3847 kJn (H2) : n (C3H8) 必大于 3 : 2选 B 若取金刚石和石墨的混合晶体共1mol在O2中完全燃烧,产生的热量为Q kJ,则金刚石和石墨的物质的量之比为: 。 已知金刚石和石墨在氧气中完全燃烧的热化学方程式为:
① C(金刚石、s) + O2(g) = CO2(g)
△H1=-395.41kJ/mol
② C(石墨、s) + O2(g) = CO2(g)
△H2=-393.51kJ/mol变式练习:已知下列热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)
△H=-24.8kJ/mol
3Fe2O3(s)+ CO(g)= 2Fe3O4(s)+CO2(g)
△H=-15.73kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)
△H=+640.4kJ/mol
试写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
____________________________________
?
提升练习3课堂完成 P.13 1.2.3.9.10
P.13 4.5.6.7.8做在作业本上
△H= -184.6kJ/mol
则反应HCl(g)=1/2H2(g)+1/2Cl2(g)的△H为( )A. +184.6 kJ/mol B. -92.3 kJ/mol
C. -369.2 kJ/mol D. +92.3 kJ/mol复习D规律: “正逆”反应反应热数值相等,符号相反 H2(g)+1/2O2(g) = H2O(g) △H1= - 241.8kJ/mol
那么,H2的燃烧热△H究竟是多少?如何计算?
已知: H2O(g)= H2O(l) △H2= - 44 kJ/mol
H2(g)+1/2O2(g)= H2O(l)
△H=△H1+△H2= -285.8kJ/mol
下列数据△H1表示燃烧热吗?判断①②③ ①+②=③ 如何测出下列反应的反应热:
C(s)+1/2O2(g)= CO(g) ΔH1=?思考①C(s)+1/2O2(g)= CO(g) ΔH1=?
②CO(g)+1/2O2(g)= CO2(g) ΔH2= -283.0kJ/mol
③C(s)+O2(g)= CO2(g) ΔH3= -393.5kJ/mol不能很好的控制反应程度,故不能直接通过实验测得△H1① + ② = ③ ,
则 ΔH1 + ΔH2 =ΔH3
所以,ΔH1=ΔH3 - ΔH2 = - 393.5kJ/mol + 283.0kJ/mol
= - 110.5kJ/mol上两例应用了什么规律?盖斯定律不管化学反应是分一步完成或分
几步完成,其反应热是相同的。
化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。一.换句话说△H2 > 0△H1 < 0S(始态)L(终态)△H1 +△H2 = 0如何理解盖斯定律? ΔH、ΔH1、ΔH2
之间有何关系?ΔH=ΔH1+ΔH2BΔHACΔH1ΔH2例1:已知下列各反应的焓变
①Ca(s)+C(s,石墨)+3/2O2(g)= CaCO3(s)
△H1 = -1206.8 kJ/mol
②Ca(s)+1/2O2(g)= CaO(s)
△H2= -635.1 kJ/mol
③C(s,石墨)+O2(g)= CO2(g)
△H3 = -393.5 kJ/mol
试求④CaCO3(s)= CaO(s)+CO2(g)的焓变△H4= + 178.2kJ/mol④=②+③-①思考与交流:
你认为运用盖斯定律计算反应热的关键在哪里?关键:目标方程式的“四则运算式”的导出。方法:写出目标方程式确定“过渡物质”(要消去的物质)然后用消元法逐一消去“过渡物质,
导出“四则运算式”。例2:按照盖斯定律,结合下述反应方程式回答问题,已知:
①NH3(g)+HCl(g)= NH4Cl(s) △H1= -176kJ/mol
②NH3(g)= NH3(aq) △H2= -35.1kJ/mol
③HCl(g) = HCl(aq) △H3= -72.3kJ/mol
④NH3(aq)+ HCl(aq)= NH4Cl(aq) △H4= -52.3kJ/mol
⑤NH4Cl(s)= NH4Cl(aq) △H5=?
则第⑤个方程式中的反应热△H是________。
根据盖斯定律和上述反应方程式得:
⑤=④+③+②-①,
即△H5 = +16.3kJ/mol例3:同素异形体可以相互转化但反应热相当小而且转化速率慢,有时还很不完全,测定反应热很困难,现在可根据盖斯提出的观点分析。已知:①P4(s、白磷)+5O2(g)=P4O10(s)
△H1= -2983.2 kJ/mol②P(s、红磷)+5/4O2(g)=1/4P4O10(s)
△H2= -738.5 kJ/mol试写出白磷转化为红磷的热化学方程式 。 P4(s、白磷)= 4P(s、红磷) △= - 29.2kJ/mol①-4×②:你知道神六的火箭燃料是什么吗?例4:某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。已知相同状态下:
①N2(g)+2O2(g) = 2NO2(g) △H1= +67.7kJ/mol
②N2H4(g)+O2(g) = N2(g)+2H2O(l) △H2= -534kJ/mol
请写出发射火箭反应的热化学方程式。
2 N2H4(g)+ 2NO2(g)= 3N2(g)+4H2O(l)
△H= - 1135.2kJ/mol 2 × ②-①:1.已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为
C(石墨)+O2(g)= CO2(g) △H=-393.51kJ·mol-1
C(金刚石)+O2(g)= CO2(g) △ H=-395.41kJ·mol-1
据此判断,下列说法中正确的是( )
A、由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低
B、由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高
C、由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低
D、由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高A练习2.已知
① CO(g)+1/2O2(g)= CO2(g) ΔH1= -283.0 kJ/mol
② H2(g)+1/2O2(g)= H2O(l) ΔH2= -285.8 kJ/mol ③C2H5OH(l)+ 3O2(g)= 2CO2(g)+3H2O(l)
ΔH3= -1370 kJ/mol 试计算④2CO(g)+4H2(g)= H2O(l)+C2H5OH(l)的ΔH?
①×2 + ②×4 - ③ = ④ 所以,ΔH=ΔH1×2 +ΔH2×4 -ΔH3 ????? =-283.2×2 -285.8×4 +1370
=-339.2 kJ/mol 3. 在100 g 碳不完全燃烧所得气体中,CO占1/3体积,CO2占2/3体积,且
C(s)+1/2O2(g)= CO(g) △H=-110.35kJ/mol
CO(g)+1/2O2(g)= CO2(g) △H=-282.57kJ/mol
与这些碳完全燃烧相比,损失的热量是( )
392.92 kJ B. 2489.44 kJ
C. 784.92 kJ D. 3274.3 kJC4 .在同温同压下,下列各组热化学方程式中, △H2 >△H1的是(多选)
A.2H2(g) + O2(g)= 2H2O(g) △H1
2H2(g) + O2(g) = 2H2O(l) △H2
B.S(g) + O2(g) =SO2(g) △H1
S(s) + O2(g) = SO2(g) △H2
C.CO(g) + 1/2 O2(g) = CO2(g) △H1
2CO(g) + O2(g) = 2CO2(g) △H2
D.H2(g) +Cl2(g)=2HCl(g) △H1
1/2 H2(g) + 1/2 Cl2(g) = HCl(g) △H2 BD盖斯定律的灵活应用5.已知胆矾溶于水时溶液温度降低,
胆矾分解的热化学方程式为:
CuSO4?5H2O(s) = CuSO4(s)+5H2O(l)
△H=+Q1kJ/mol
室温下,若将1mol无水硫酸铜溶解为溶液
时放热Q2kJ,则( )
A.Q1>Q2 B.Q1=Q2
C. Q1
例2:利用燃烧热的概念和摩尔质量进行计算
例3:利用盖斯定律进行计算利用反应热的概念、盖斯定律、热化学方程式进行有关反应热的计算例4:利用键能进行计算
已知某些化学键键能数据如下:H—H:436 kJ·mol-1 Cl—Cl:243 kJ·mol-1 H—Cl :431 kJ·mol-1
则下列热化学方程式不正确的是 ( )
A. 1/2H2(g)+1/2Cl2(g) =HCl (g) ΔH=-91.5 kJ· mol -1
B. H2 (g) +Cl2 (g) =2HCl (g) ΔH=-183 kJ· mol-1
C. H2(g)+Cl2(g) =HCl (g) ΔH=+91.5 kJ· mol -1
D. 2HCl (g) = H2 (g)+Cl2 (g) ΔH=+183 kJ· mol-1
C已知:
欲得到相同的热量,需分别燃烧固体碳和氢气的质量比约为( )
A. 2 : 3.25 B. 12 : 3.25
C. 1 : 1 D. 393.5 : 241.8B变式练习1 变式练习2 氢气、一氧化碳、辛烷、甲烷燃烧的热化学方程式分别为:
H2(g)+1/2O2(g)=H2O(l);△H=-285.8kJ/mol
CO(g)+1/2O2(g)=CO2(g);△H=-283.0kJ/mol
C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l);
△H=-5518kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l);
△H=-890.3kJ/mol
相同质量的氢气、一氧化碳、辛烷、甲烷完全燃烧时放出热量最少的是( )
A. H2(g) B. CO(g) C. C8H18(l) D. CH4(g)B变式练习3 在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g)。反应过程中的能量关系可用右图简单表示(图中的ΔH表示生成1 mol产物的数据)。
(1)写出表示S8燃烧热
的热化学方程式
S8(s)+8O2(g)=8SO2(g)
ΔH=-8a kJ·mol-1
(2)写出SO3分解生成
SO2和O2的热化学方程式
2SO3(g)=2SO2(g)+O2(g) ΔH=+2b kJ·mol-1
(3)若已知1个S8分子中有8个硫硫键,硫氧键的键能为d kJ·mol-1,氧氧键的键能为e kJ·mol-1,则S8分子中硫硫键的键能为(2d-a-e) kJ·mol-1
已知:
2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ/mol CO(g)+1/2O2(g)=CO2(g) △H=-283.0kJ/mol
某H2和CO的混合气体完全燃烧时放出113.74kJ热量,同时生成3.6g液态水,求原混合气体中H2和CO的物质的量之比。提升练习12018-11-191一定条件下,氢气和丙烷燃烧的热化学方程式为:
2H2(g) + O2(g) = 2H2O(l) ΔH =- 571.6 kJ/mol
C3H8(g)+5O2(g)= 3CO2(g)+4H2O(l)
ΔH =- 2220 kJ/mol
5 mol 氢气和丙烷的混合气完全燃烧时放热
3847 kJ 则氢气和甲烷的体积比为 ( )
A. 1:3 B. 3:1 C. 1:4 D. 1:1
B提升练习22018-11-191 解1 :设H2、C3H8的物质的量分别为x,y x + y = 5(571.6/2)(x) + 2220y = 3847 x = 3.75 moly = 1.25 mol1mol H2 燃烧放热 285.8 kJ解2 :1mol 混合气 燃烧放热 3847kJ/5 = 769.4 kJ2018-11-191解3 :( 巧解) 5mol 混合气中,C3H8 物质的量必小于 2mol,H2 物质的量必大于3mol。∵ 2mol C3H8 燃烧放热 4440 kJ,
超过总放热量 3847 kJn (H2) : n (C3H8) 必大于 3 : 2选 B 若取金刚石和石墨的混合晶体共1mol在O2中完全燃烧,产生的热量为Q kJ,则金刚石和石墨的物质的量之比为: 。 已知金刚石和石墨在氧气中完全燃烧的热化学方程式为:
① C(金刚石、s) + O2(g) = CO2(g)
△H1=-395.41kJ/mol
② C(石墨、s) + O2(g) = CO2(g)
△H2=-393.51kJ/mol变式练习:已知下列热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)
△H=-24.8kJ/mol
3Fe2O3(s)+ CO(g)= 2Fe3O4(s)+CO2(g)
△H=-15.73kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)
△H=+640.4kJ/mol
试写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
____________________________________
?
提升练习3课堂完成 P.13 1.2.3.9.10
P.13 4.5.6.7.8做在作业本上
