人教版高中化学选修五1.4 研究有机物方法和步骤课件 (两课时)26张PPT
文档属性
| 名称 | 人教版高中化学选修五1.4 研究有机物方法和步骤课件 (两课时)26张PPT |

|
|
| 格式 | zip | ||
| 文件大小 | 692.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-11-19 00:00:00 | ||
图片预览






文档简介
课件26张PPT。第一章 认识有机化学
课题4 研究有机化合物的
一般步骤和方法
第1课时 学习目标
1、了解研究有机化合物的步骤和方法。
2、掌握有机化合物分离提纯的常用方法和分离原理。
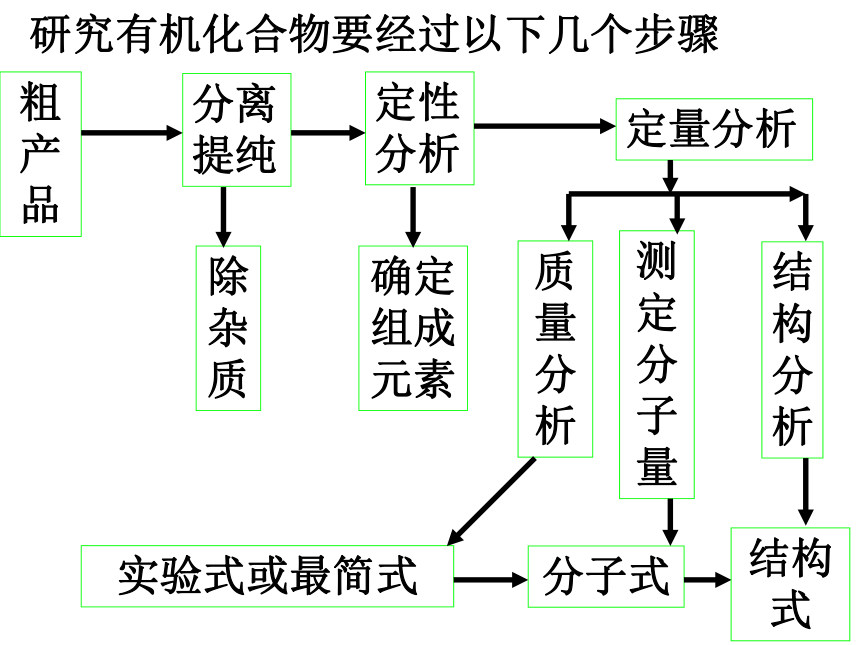
3、掌握蒸馏、重结晶、萃取分液等提纯有机物的原理和操作步骤。 课题4 研究有机化合物的一般方法和步骤研究有机化合物要经过以下几个步骤粗产品分离提纯定性分析定量分析除杂质确定组成元素质量分析测定分子量结构分析实验式或最简式分子式结构式 物质的分离和提纯原则
分离原则:将混合物各种物质逐一分开,尽量减少各物质损失,各组分要尽量纯净。
分离方法:
物理方法—过滤、重结晶、升华、蒸发、蒸馏、分馏、液化、分液、萃取、渗析、汽化、物理洗气等。
化学方法---热分解、氧化还原转化、生成沉淀、酸碱溶解或中和、络合、水解、化学法洗气等。
提纯原则:不增、不减、易分离、易复原
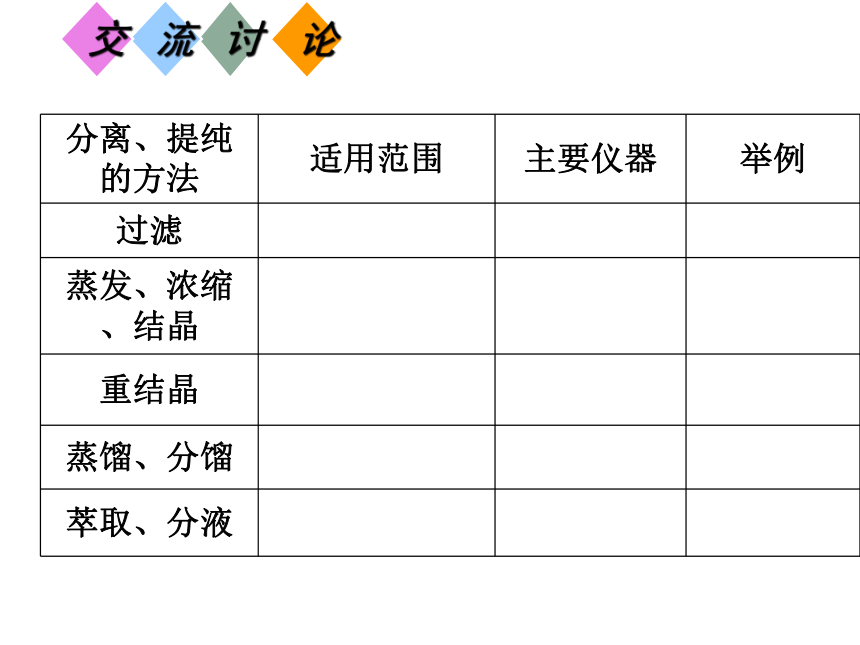
提纯方法:杂变纯,杂变沉、杂变气、溶剂分。1.请快速阅读课本第17-19页内容,了解蒸馏、重结晶、萃取的基本操作和原理。
2.阅读P19页科学视野,了解色谱法的基本原理。
3.将自己解决不了的问题记录下来,以便互帮时提出。
4.知者加速的同学可自行学习。 一、分离、提纯
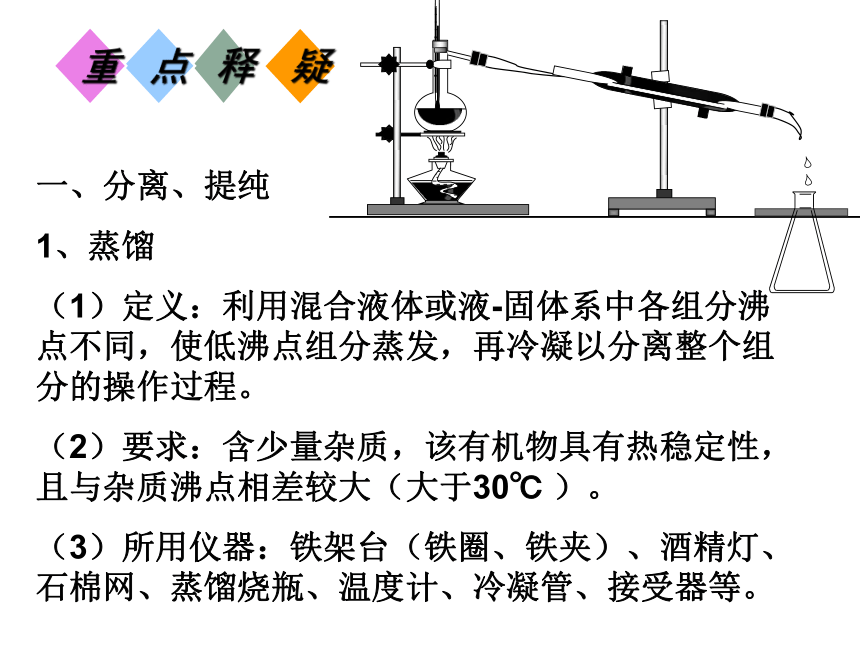
1、蒸馏
(1)定义:利用混合液体或液-固体系中各组分沸点不同,使低沸点组分蒸发,再冷凝以分离整个组分的操作过程。
(2)要求:含少量杂质,该有机物具有热稳定性,且与杂质沸点相差较大(大于30℃ )。
(3)所用仪器:铁架台(铁圈、铁夹)、酒精灯、石棉网、蒸馏烧瓶、温度计、冷凝管、接受器等。 (4)蒸馏的注意事项
◆注意仪器组装的顺序:“先下后上,由左至右”;
◆不得直接加热蒸馏烧瓶,需垫石棉网;
◆蒸馏烧瓶盛装的液体,最多不超过容积的2/3;不得将全部溶液蒸干;
◆需使用沸石(防止暴沸) ;
◆冷凝水水流方向应与蒸汽流方向相反(逆流:低进高出);
◆温度计水银球位置应与蒸馏烧瓶支管口齐平,以测量馏出蒸气的温度; 无水酒精的制取
普通酒精含乙醇95.57%(质量)和水4.43%,这是恒沸点混合物,它的沸点是78.15℃,比纯乙醇的沸点(78.5℃)低。把这种混合物蒸馏时,气相和液相的组成是相同的,即乙醇和水始终以这个混合比率蒸出,不能用蒸馏法制得无水酒精。
实验室制备无水酒精时,在95.57%酒精中加入生石灰(CaO)加热回流,使酒精中的水跟氧化钙反应,生成不挥发的氢氧化钙来除去水分,然后再蒸馏,这样可得99.5%的无水酒精。如果还要去掉这残留的少量的水,可以加入金属镁来处理,可得100%乙醇,叫做绝对酒精。
工业上制备无水酒精的方法是在普通酒精中加入一定量的苯,再进行蒸馏。于64.9℃沸腾,蒸出苯、乙醇和水的三元恒沸混合物(比率为74∶18.5∶7.5),这样可将水全部蒸出。继续升高温度,于68.3℃蒸出苯和乙醇的二元混合物(比率为67.6∶32.4),可将苯全部蒸出。最后升高温度到78.5℃,蒸出的是无水乙醇。
近年来,工业上也使用强酸性阳离子交换树脂(具有极性基团,能强烈吸水)来制取无水酒精. 2、重结晶
(1)定义:重结晶是使固体物质从溶液中以晶体状态析出的过程,是提纯、分离固体物质的重要方法之一。
(2)结晶常见的类型
冷却结晶
蒸发结晶
重结晶冷却结晶:加热使其形成热饱和溶液,然后降温使溶液冷却达到过饱和而析出晶体,此法适合于溶解度随温度变化较大的物质。
蒸发结晶:通过蒸发、减少一部分溶剂使溶液浓缩达到过饱和析出晶体。此法适合于溶解度随温度变化不大的物质,如粗盐的提纯。
重结晶:为了得到纯度较高的晶体,把析出的晶体用蒸馏水重新溶解,再经过滤、蒸发、冷却等步骤,析出晶体,即重结晶。
若杂质的溶解度很小,则加热溶解,趁热过滤,冷却结晶;若溶解度很大,则加热溶解,蒸发结晶。(3)溶剂的选择:
杂质在溶剂中的溶解度很小或很大,易于除去;
被提纯的有机物在此溶液中的溶解度,受温度影响较大。
3、萃取
(1)定义:
萃取:利用溶液在互不相溶的溶剂里溶解度的不同,用一种溶剂把溶质从它与另一种溶剂组成的溶液中提取出来,前者称为萃取剂,一般溶质在萃取剂里的溶解度更大些。
分液:利用互不相溶的液体的密度不同,用分液漏斗将它们一一分离出来。
(2)所用仪器:烧杯、漏斗架、分液漏斗。(3)基本操作:
检漏:检验分液漏斗活塞和上口的玻璃塞是否漏液---将漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准漏斗口上的小孔,使漏斗内外空气相通漏斗里液体能够流出--- 使漏斗下端管口紧靠烧怀内壁---及时关闭活塞,不要让上层液体流出---分液漏斗中的下层液体从下口放出,上层液体从上口倒出。
(4)注意事项:
萃取剂必须具备两个条件:一是与溶剂互不相溶;二是溶质在萃取剂中的溶解度较大。
检漏:检查分液漏斗的瓶塞和旋塞是否严密。
萃取常在分液漏斗中进行,分液是萃取操作的一个步骤,必须经过充分振荡后再静置分层。 ★红对勾课堂练习1-10
★★红对勾课后习题第一章 认识有机化学
课题4 研究有机化合物的
一般步骤和方法
第2课时学习目标 1、掌握有机化合物定性分析和定量分析的基本方法 2、了解鉴定有机化合物结构的一般过程与数据处理方法 教学重点 :
有机化合物组成元素分析与相对分子质量的测定方法课题4 研究有机化合物的一般步骤和方法1.请快速阅读课本第20页内容,思考什么是元素的定性分析及定量分析?元素定量分析有哪几种方法?
2.如何确定有机化合物中C、H元素的存在?
3.总结有机物分子式求解的方法,用公式表示求解过程。
4.完成P21页学与问。
5.将自己解决不了的问题记录下来,以便互帮时提出。 例1、某烃含氢元素的质量分数为17.2%,求此烃的实验式。又测得该烃的相对分子质量是58,求该烃的分子式。C4H10注意:实验式和分子式的区别
实验式表示化合物分子所含元素的原子数目最简单整数比的式子。
分子式表示化合物分子所含元素的原子种类及数目的式子。 例2、燃烧某有机物A 1.50g,生成1.12L(标准状况)CO2 和0.05mol H2O 。该有机物的蒸气对空气的相对密度是1.04,求该有机物的分子式。分析:1.5g A中各元素的质量: 例2、燃烧某有机物A 1.50g,生成1.12L(标准状况)CO2 和0.05mol H2O 。该有机物的蒸气对空气的相对密度是1.04,求该有机物的分子式。分析:最简式为: 因此实验式即为分子式二、元素分析与相对分子量的测定
1.确定有机物分子式的一般方法:
(1)实验式法: 由物质中各原子(元素)的质量分数→ 各原子的个数比(实验式)→由相对分子质量和实验式 → 有机物分子式
(2)直接法:求出M(分子的摩尔质量即相对分子质量) → 1mol物质中m(原子)==M(分子)×w% → N(原子个数)== m(原子) ÷M(原子) →有机物分子式
2.确定相对分子质量的方法有:
(1)M = m/n
(2)根据有机蒸气的相对密度D1 ÷ D2 = M1 ÷ M2
(3)已知标况下有机蒸气的密度为ρg/L,
M = 22.4L/mol × ρg/L6.质谱是近代发展起来的快速、微量、精确测定相对分子质量的方法。请快速阅读课本第21页内容,了解质谱法测定相对分子质量的原理。
思考:质荷比是什么?如何读谱以确定有机物的相对分子质量?
(1)分子离子与碎片离子的相对质量与其电荷的比值。
(2)由于相对质量越大的分子离子的质荷比越大,达到检测器需要的时间越长,因此谱图中的质荷比最大的就是未知物的相对分子质量。 3.质谱法测定有机物的相对分子质量
(1)质谱法的原理:用高能电子流轰击样品,使分子失去电子变成带正电荷的分子离子和碎片离子,在磁场的作用下,由于它们的相对质量不同而使其到达检测器的时间也先后不同,其结果被记录为质谱图。
(2)质荷比:分子离子与碎片离子的相对质量与其电荷的比值。
(3)注意:由于相对质量越大的分子离子的质荷比越大,达到检测器需要的时间越长,因此谱图中的质荷比最大的就是未知物的相对分子质量。乙醇的质谱图相对丰度(RA)——以图中最强的离子峰(基峰)高为100%,其它峰的峰高则用相对于基峰的百分数表示。 29100%060%20%503020 质荷比最大的数据表示未知物A的相对分子质量。谢谢大家再见
课题4 研究有机化合物的
一般步骤和方法
第1课时 学习目标
1、了解研究有机化合物的步骤和方法。
2、掌握有机化合物分离提纯的常用方法和分离原理。
3、掌握蒸馏、重结晶、萃取分液等提纯有机物的原理和操作步骤。 课题4 研究有机化合物的一般方法和步骤研究有机化合物要经过以下几个步骤粗产品分离提纯定性分析定量分析除杂质确定组成元素质量分析测定分子量结构分析实验式或最简式分子式结构式 物质的分离和提纯原则
分离原则:将混合物各种物质逐一分开,尽量减少各物质损失,各组分要尽量纯净。
分离方法:
物理方法—过滤、重结晶、升华、蒸发、蒸馏、分馏、液化、分液、萃取、渗析、汽化、物理洗气等。
化学方法---热分解、氧化还原转化、生成沉淀、酸碱溶解或中和、络合、水解、化学法洗气等。
提纯原则:不增、不减、易分离、易复原
提纯方法:杂变纯,杂变沉、杂变气、溶剂分。1.请快速阅读课本第17-19页内容,了解蒸馏、重结晶、萃取的基本操作和原理。
2.阅读P19页科学视野,了解色谱法的基本原理。
3.将自己解决不了的问题记录下来,以便互帮时提出。
4.知者加速的同学可自行学习。 一、分离、提纯
1、蒸馏
(1)定义:利用混合液体或液-固体系中各组分沸点不同,使低沸点组分蒸发,再冷凝以分离整个组分的操作过程。
(2)要求:含少量杂质,该有机物具有热稳定性,且与杂质沸点相差较大(大于30℃ )。
(3)所用仪器:铁架台(铁圈、铁夹)、酒精灯、石棉网、蒸馏烧瓶、温度计、冷凝管、接受器等。 (4)蒸馏的注意事项
◆注意仪器组装的顺序:“先下后上,由左至右”;
◆不得直接加热蒸馏烧瓶,需垫石棉网;
◆蒸馏烧瓶盛装的液体,最多不超过容积的2/3;不得将全部溶液蒸干;
◆需使用沸石(防止暴沸) ;
◆冷凝水水流方向应与蒸汽流方向相反(逆流:低进高出);
◆温度计水银球位置应与蒸馏烧瓶支管口齐平,以测量馏出蒸气的温度; 无水酒精的制取
普通酒精含乙醇95.57%(质量)和水4.43%,这是恒沸点混合物,它的沸点是78.15℃,比纯乙醇的沸点(78.5℃)低。把这种混合物蒸馏时,气相和液相的组成是相同的,即乙醇和水始终以这个混合比率蒸出,不能用蒸馏法制得无水酒精。
实验室制备无水酒精时,在95.57%酒精中加入生石灰(CaO)加热回流,使酒精中的水跟氧化钙反应,生成不挥发的氢氧化钙来除去水分,然后再蒸馏,这样可得99.5%的无水酒精。如果还要去掉这残留的少量的水,可以加入金属镁来处理,可得100%乙醇,叫做绝对酒精。
工业上制备无水酒精的方法是在普通酒精中加入一定量的苯,再进行蒸馏。于64.9℃沸腾,蒸出苯、乙醇和水的三元恒沸混合物(比率为74∶18.5∶7.5),这样可将水全部蒸出。继续升高温度,于68.3℃蒸出苯和乙醇的二元混合物(比率为67.6∶32.4),可将苯全部蒸出。最后升高温度到78.5℃,蒸出的是无水乙醇。
近年来,工业上也使用强酸性阳离子交换树脂(具有极性基团,能强烈吸水)来制取无水酒精. 2、重结晶
(1)定义:重结晶是使固体物质从溶液中以晶体状态析出的过程,是提纯、分离固体物质的重要方法之一。
(2)结晶常见的类型
冷却结晶
蒸发结晶
重结晶冷却结晶:加热使其形成热饱和溶液,然后降温使溶液冷却达到过饱和而析出晶体,此法适合于溶解度随温度变化较大的物质。
蒸发结晶:通过蒸发、减少一部分溶剂使溶液浓缩达到过饱和析出晶体。此法适合于溶解度随温度变化不大的物质,如粗盐的提纯。
重结晶:为了得到纯度较高的晶体,把析出的晶体用蒸馏水重新溶解,再经过滤、蒸发、冷却等步骤,析出晶体,即重结晶。
若杂质的溶解度很小,则加热溶解,趁热过滤,冷却结晶;若溶解度很大,则加热溶解,蒸发结晶。(3)溶剂的选择:
杂质在溶剂中的溶解度很小或很大,易于除去;
被提纯的有机物在此溶液中的溶解度,受温度影响较大。
3、萃取
(1)定义:
萃取:利用溶液在互不相溶的溶剂里溶解度的不同,用一种溶剂把溶质从它与另一种溶剂组成的溶液中提取出来,前者称为萃取剂,一般溶质在萃取剂里的溶解度更大些。
分液:利用互不相溶的液体的密度不同,用分液漏斗将它们一一分离出来。
(2)所用仪器:烧杯、漏斗架、分液漏斗。(3)基本操作:
检漏:检验分液漏斗活塞和上口的玻璃塞是否漏液---将漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准漏斗口上的小孔,使漏斗内外空气相通漏斗里液体能够流出--- 使漏斗下端管口紧靠烧怀内壁---及时关闭活塞,不要让上层液体流出---分液漏斗中的下层液体从下口放出,上层液体从上口倒出。
(4)注意事项:
萃取剂必须具备两个条件:一是与溶剂互不相溶;二是溶质在萃取剂中的溶解度较大。
检漏:检查分液漏斗的瓶塞和旋塞是否严密。
萃取常在分液漏斗中进行,分液是萃取操作的一个步骤,必须经过充分振荡后再静置分层。 ★红对勾课堂练习1-10
★★红对勾课后习题第一章 认识有机化学
课题4 研究有机化合物的
一般步骤和方法
第2课时学习目标 1、掌握有机化合物定性分析和定量分析的基本方法 2、了解鉴定有机化合物结构的一般过程与数据处理方法 教学重点 :
有机化合物组成元素分析与相对分子质量的测定方法课题4 研究有机化合物的一般步骤和方法1.请快速阅读课本第20页内容,思考什么是元素的定性分析及定量分析?元素定量分析有哪几种方法?
2.如何确定有机化合物中C、H元素的存在?
3.总结有机物分子式求解的方法,用公式表示求解过程。
4.完成P21页学与问。
5.将自己解决不了的问题记录下来,以便互帮时提出。 例1、某烃含氢元素的质量分数为17.2%,求此烃的实验式。又测得该烃的相对分子质量是58,求该烃的分子式。C4H10注意:实验式和分子式的区别
实验式表示化合物分子所含元素的原子数目最简单整数比的式子。
分子式表示化合物分子所含元素的原子种类及数目的式子。 例2、燃烧某有机物A 1.50g,生成1.12L(标准状况)CO2 和0.05mol H2O 。该有机物的蒸气对空气的相对密度是1.04,求该有机物的分子式。分析:1.5g A中各元素的质量: 例2、燃烧某有机物A 1.50g,生成1.12L(标准状况)CO2 和0.05mol H2O 。该有机物的蒸气对空气的相对密度是1.04,求该有机物的分子式。分析:最简式为: 因此实验式即为分子式二、元素分析与相对分子量的测定
1.确定有机物分子式的一般方法:
(1)实验式法: 由物质中各原子(元素)的质量分数→ 各原子的个数比(实验式)→由相对分子质量和实验式 → 有机物分子式
(2)直接法:求出M(分子的摩尔质量即相对分子质量) → 1mol物质中m(原子)==M(分子)×w% → N(原子个数)== m(原子) ÷M(原子) →有机物分子式
2.确定相对分子质量的方法有:
(1)M = m/n
(2)根据有机蒸气的相对密度D1 ÷ D2 = M1 ÷ M2
(3)已知标况下有机蒸气的密度为ρg/L,
M = 22.4L/mol × ρg/L6.质谱是近代发展起来的快速、微量、精确测定相对分子质量的方法。请快速阅读课本第21页内容,了解质谱法测定相对分子质量的原理。
思考:质荷比是什么?如何读谱以确定有机物的相对分子质量?
(1)分子离子与碎片离子的相对质量与其电荷的比值。
(2)由于相对质量越大的分子离子的质荷比越大,达到检测器需要的时间越长,因此谱图中的质荷比最大的就是未知物的相对分子质量。 3.质谱法测定有机物的相对分子质量
(1)质谱法的原理:用高能电子流轰击样品,使分子失去电子变成带正电荷的分子离子和碎片离子,在磁场的作用下,由于它们的相对质量不同而使其到达检测器的时间也先后不同,其结果被记录为质谱图。
(2)质荷比:分子离子与碎片离子的相对质量与其电荷的比值。
(3)注意:由于相对质量越大的分子离子的质荷比越大,达到检测器需要的时间越长,因此谱图中的质荷比最大的就是未知物的相对分子质量。乙醇的质谱图相对丰度(RA)——以图中最强的离子峰(基峰)高为100%,其它峰的峰高则用相对于基峰的百分数表示。 29100%060%20%503020 质荷比最大的数据表示未知物A的相对分子质量。谢谢大家再见
