镁的提取及应用[上学期]
图片预览





文档简介
课件16张PPT。镁的提取及应用复习:钠的化学性质很活泼
Li Na K Rb Cs 称为碱金属,
化性相似,逐渐增强我们这节课来学习结构不同的另一种金属--镁练习:写出过氧化钠与盐酸反应的化学方程式2Na2O2 + 4HCl = 4NaCl + 2H2O + O2↑思考:过氧化钠是碱性氧化物吗? 答:不是。因为过氧化钠与酸反应,除了生成盐和水外,还生成氧气。
1与水反应:Na2O+H2O=2NaOH
2与CO2反应:Na2O+CO2=Na2CO31.与水反应: 2Na2O2+2H2O=4NaOH+O2↑
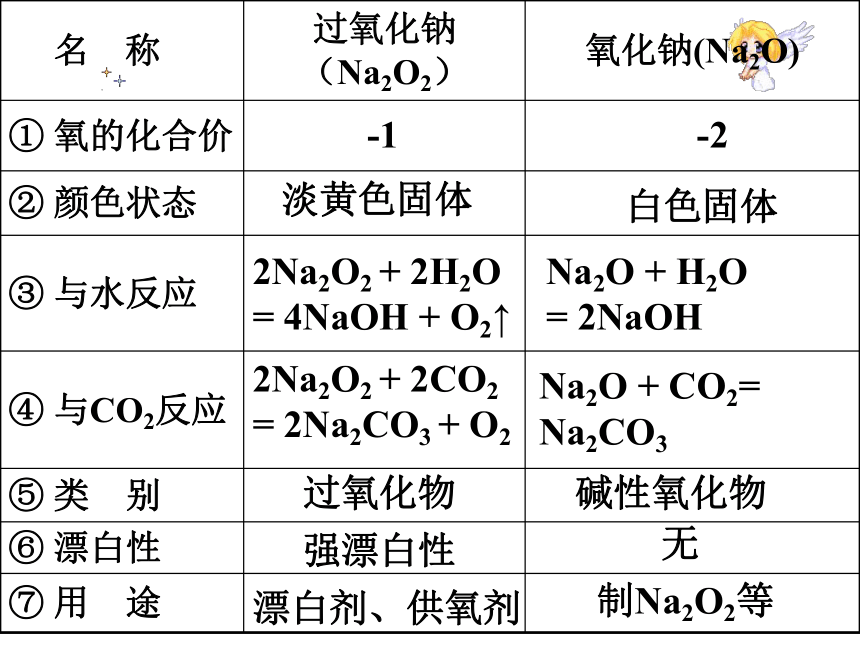
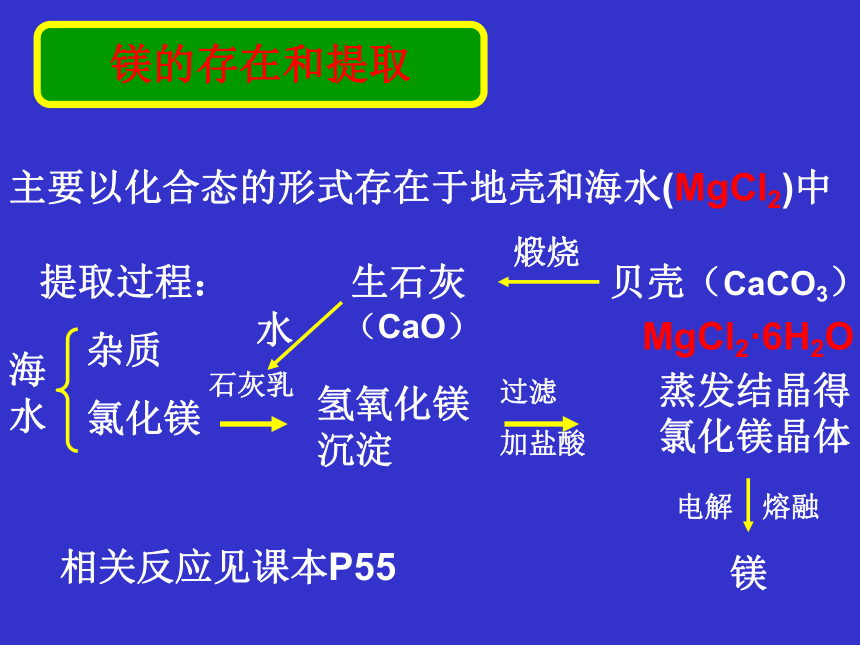
2.与CO2反应: 2Na2O2+2CO2=2Na2CO3 +O2氧化钠(白色)过氧化钠(淡黄色,有强氧化性、漂白性)过氧化物碱性氧化物-1-2淡黄色固体白色固体2Na2O2 + 2H2O = 4NaOH + O2↑Na2O + H2O = 2NaOH2Na2O2 + 2CO2 = 2Na2CO3 + O2Na2O + CO2= Na2CO3强漂白性无漂白剂、供氧剂制Na2O2等镁的存在和提取主要以化合态的形式存在于地壳和海水(MgCl2)中提取过程:海水杂质
氯化镁石灰乳氢氧化镁沉淀过滤
加盐酸蒸发结晶得氯化镁晶体MgCl2·6H2O电解 熔融镁相关反应见课本P55贝壳(CaCO3)煅烧生石灰水(CaO)观察与思考:镁的化学性质探究〖实验1〗 把擦去氧化物保护膜的镁条 点燃后伸入二氧化碳中现象:剧烈燃烧,伴有白烟,在瓶的内壁有黑色的固体生成结论:在点燃或高温条件下,镁能与二氧化碳反应
2Mg+CO2==2MgO+C点燃〖实验2〗 镁与稀硫酸反应现象:迅速反应,生成大量气泡,且放出热量,试管内壁温度升高结论:镁条能与稀硫酸反应,且放出热量化学方程式:Mg+H2SO4=MgSO4+H2↑离子方程式:Mg+2H+=Mg2++H2↑镁的性质与原子结构的关系Mg易失2e-Mg2+因此:镁很活泼,可与活泼的非金属、酸等物质反应镁的化性归纳1、与O2反应常温:生成氧化膜 (发生钝化)3、与水反应Mg+2H2O(热水)== Mg(OH)2+H2↑中强碱,能使酚酞变红4、与氧化物反应S+2MgO若Mg过量:5、与非氧化性酸反应:稀H2SO4 稀HCl、H3PO4Mg+2H+=Mg2++H2↑与氧化性酸发生复杂的反应(HNO3、浓H2SO4)6、与盐溶液反应(置换较不活泼的金属)Mg +Cu2+ = Mg2++Cu 镁的物性: 银白色金属光泽,密度小合金:金属与金属或非金属熔合在一起形成且有金属特性的混合物特性: 熔点低于任何一组分镁的主要用途:1、制合金
2、制耐火材料(MgO)熔点高
3、植物叶绿素组成成分硬水:含Ca2+或Mg2+较多的水你知道吗?暂时硬水:阴离子为HCO3-水垢的成分: CaCO3和Mg(OH)2永久硬水 :阴离子为Cl-、SO42-等,加热后不形成沉淀作业课本:P56 P59~60未做的
导学大课堂相关习题 P57
下节课评讲课本及导学大课堂相关习题
下星期一检查导学大课堂完成情况
侯氏制碱法(联合制碱法)原理与索尔维法(氨碱法)基本相同,其优点在于制碱与合成氨进行联合生产。没有副产物---氯化钙,而且还得到有用的氯化铵。 NH3+CO2+H2O = NH4HCO3 NH4HCO3+NaCl = NaHCO3↓+NH4Cl 2NaHCO3 = Na2CO3+H2O+CO2↑ 根据NH4Cl在常温时的溶解度比NaCl大,而在低温下却比NaCl溶解度小的原理,在常温向母液中加入食盐细粉,通入氨气。搅拌在 5℃~10℃时而使NH4Cl单独结晶析出供做肥。优点:保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高到96﹪;NH4Cl可做氮肥;可与合成氨厂联合,利用了合成氨制原料气时产生的CO,将其转化成CO2,革除了CaCO3制CO2这一工序。 现象: 在澄清石灰水中,有白色沉淀 化学反应:
2 NaHCO3 + Ca(OH)2(少量) = Na2CO3 +CaCO3↓+ 2H2O NaHCO3 + Ca(OH)2(过量) = CaCO3↓+ NaOH +H2O [实验] 在一支试管中分别加2~3ml澄清石灰水, 滴加NaHCO3溶液.
Li Na K Rb Cs 称为碱金属,
化性相似,逐渐增强我们这节课来学习结构不同的另一种金属--镁练习:写出过氧化钠与盐酸反应的化学方程式2Na2O2 + 4HCl = 4NaCl + 2H2O + O2↑思考:过氧化钠是碱性氧化物吗? 答:不是。因为过氧化钠与酸反应,除了生成盐和水外,还生成氧气。
1与水反应:Na2O+H2O=2NaOH
2与CO2反应:Na2O+CO2=Na2CO31.与水反应: 2Na2O2+2H2O=4NaOH+O2↑
2.与CO2反应: 2Na2O2+2CO2=2Na2CO3 +O2氧化钠(白色)过氧化钠(淡黄色,有强氧化性、漂白性)过氧化物碱性氧化物-1-2淡黄色固体白色固体2Na2O2 + 2H2O = 4NaOH + O2↑Na2O + H2O = 2NaOH2Na2O2 + 2CO2 = 2Na2CO3 + O2Na2O + CO2= Na2CO3强漂白性无漂白剂、供氧剂制Na2O2等镁的存在和提取主要以化合态的形式存在于地壳和海水(MgCl2)中提取过程:海水杂质
氯化镁石灰乳氢氧化镁沉淀过滤
加盐酸蒸发结晶得氯化镁晶体MgCl2·6H2O电解 熔融镁相关反应见课本P55贝壳(CaCO3)煅烧生石灰水(CaO)观察与思考:镁的化学性质探究〖实验1〗 把擦去氧化物保护膜的镁条 点燃后伸入二氧化碳中现象:剧烈燃烧,伴有白烟,在瓶的内壁有黑色的固体生成结论:在点燃或高温条件下,镁能与二氧化碳反应
2Mg+CO2==2MgO+C点燃〖实验2〗 镁与稀硫酸反应现象:迅速反应,生成大量气泡,且放出热量,试管内壁温度升高结论:镁条能与稀硫酸反应,且放出热量化学方程式:Mg+H2SO4=MgSO4+H2↑离子方程式:Mg+2H+=Mg2++H2↑镁的性质与原子结构的关系Mg易失2e-Mg2+因此:镁很活泼,可与活泼的非金属、酸等物质反应镁的化性归纳1、与O2反应常温:生成氧化膜 (发生钝化)3、与水反应Mg+2H2O(热水)== Mg(OH)2+H2↑中强碱,能使酚酞变红4、与氧化物反应S+2MgO若Mg过量:5、与非氧化性酸反应:稀H2SO4 稀HCl、H3PO4Mg+2H+=Mg2++H2↑与氧化性酸发生复杂的反应(HNO3、浓H2SO4)6、与盐溶液反应(置换较不活泼的金属)Mg +Cu2+ = Mg2++Cu 镁的物性: 银白色金属光泽,密度小合金:金属与金属或非金属熔合在一起形成且有金属特性的混合物特性: 熔点低于任何一组分镁的主要用途:1、制合金
2、制耐火材料(MgO)熔点高
3、植物叶绿素组成成分硬水:含Ca2+或Mg2+较多的水你知道吗?暂时硬水:阴离子为HCO3-水垢的成分: CaCO3和Mg(OH)2永久硬水 :阴离子为Cl-、SO42-等,加热后不形成沉淀作业课本:P56 P59~60未做的
导学大课堂相关习题 P57
下节课评讲课本及导学大课堂相关习题
下星期一检查导学大课堂完成情况
侯氏制碱法(联合制碱法)原理与索尔维法(氨碱法)基本相同,其优点在于制碱与合成氨进行联合生产。没有副产物---氯化钙,而且还得到有用的氯化铵。 NH3+CO2+H2O = NH4HCO3 NH4HCO3+NaCl = NaHCO3↓+NH4Cl 2NaHCO3 = Na2CO3+H2O+CO2↑ 根据NH4Cl在常温时的溶解度比NaCl大,而在低温下却比NaCl溶解度小的原理,在常温向母液中加入食盐细粉,通入氨气。搅拌在 5℃~10℃时而使NH4Cl单独结晶析出供做肥。优点:保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高到96﹪;NH4Cl可做氮肥;可与合成氨厂联合,利用了合成氨制原料气时产生的CO,将其转化成CO2,革除了CaCO3制CO2这一工序。 现象: 在澄清石灰水中,有白色沉淀 化学反应:
2 NaHCO3 + Ca(OH)2(少量) = Na2CO3 +CaCO3↓+ 2H2O NaHCO3 + Ca(OH)2(过量) = CaCO3↓+ NaOH +H2O [实验] 在一支试管中分别加2~3ml澄清石灰水, 滴加NaHCO3溶液.
