溴、碘的提取[上学期]
图片预览






文档简介
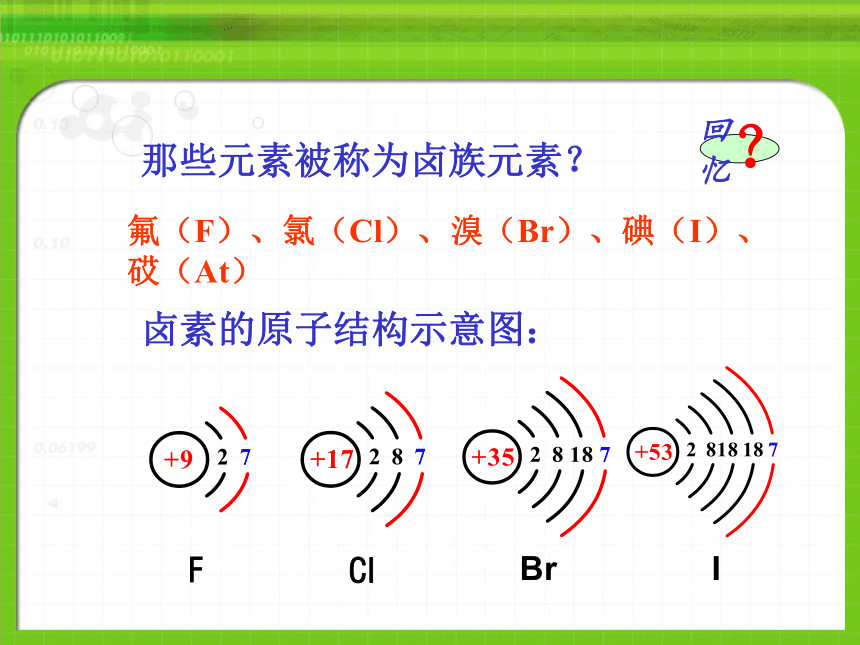
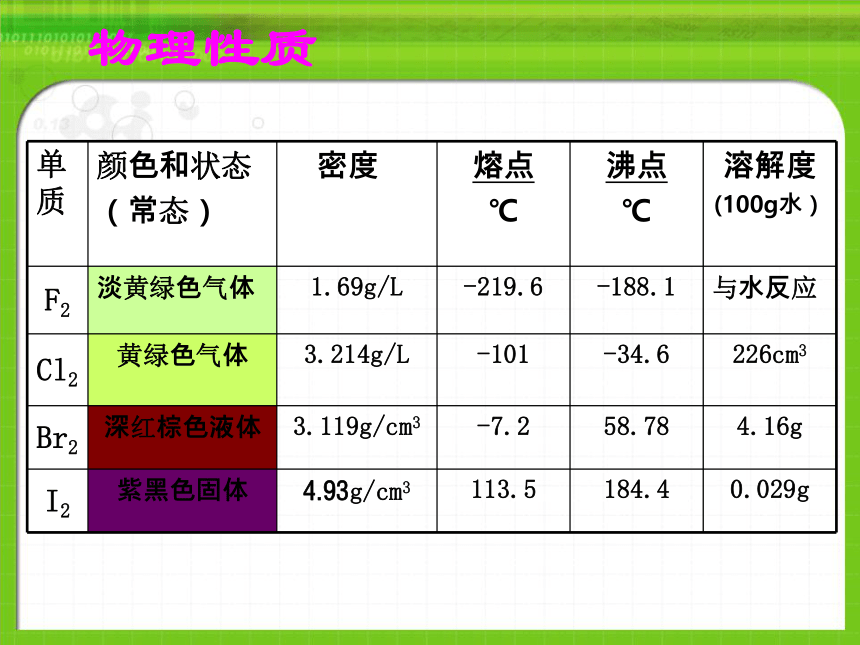
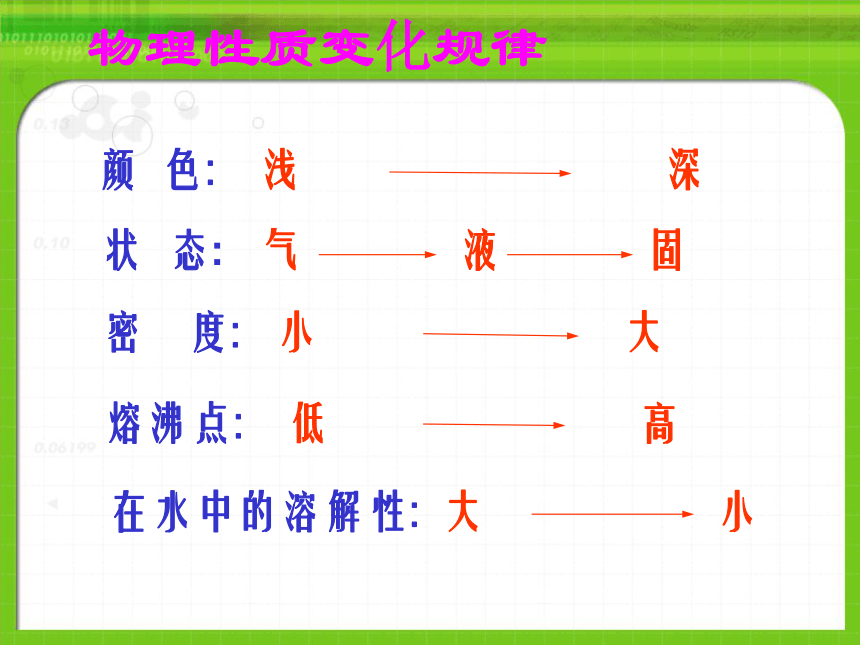
课件20张PPT。氟(F)、氯(Cl)、溴(Br)、碘(I)、砹(At)卤素的原子结构相同点:最外层均有7个电子 物理性质物理性质变化规律第三节 溴 碘的提取物理性质1、溴(Br2):①深红棕色液体(唯一的液态非金属)
②易挥发(刺激性气味,有毒)
③具有强的腐蚀性
④在水中溶解度不大,易 溶于乙醇、CCl4、苯等
⑤ ρBr2 >ρH2O棕色试剂瓶中水封保存2、碘(I2):物理性质①紫黑色晶体 ,有金属光泽
②易升华
③在水中溶解度比溴还小,易溶于乙醇、CCl4、苯等棕色试剂瓶中密封保存实验:①在两支试管分别加入2~3ml KBr 和 KI溶液,滴加少量新制氯水,再滴加少量CCl4,振荡、静置,观察现象。原因:2KBr + Cl2 == 2KCl + Br2
2KI + Cl2 == 2KCl + I2现象:下层溶液颜色分别为橙色、紫色实验:②在一支试管加入2~3ml KI溶液,滴加少量溴水,再滴加少量CCl4,振荡、静置,观察现象原因: 2KI + Br2 == 2KBr + I2现象:下层溶液颜色为 紫色化学性质1、卤族单质间的置换反应2KBr + Cl2 == 2KCl + Br2
2KI + Cl2 == 2KCl + I22KI + Br2 == 2KBr + I2活泼性比较:
Cl2 > Br2 > I2③在三支试管分别加入2~3ml KCl、KBr 和 KI溶液,滴加AgNO3溶液,再滴加稀硝酸,观察现象原因:KCl + AgNO3 == AgCl ↓ + KNO3
KBr + AgNO3 == AgBr ↓ + KNO3
KI + AgNO3 == AgI ↓ + KNO3 现象:都出现不溶于稀硝酸的沉淀,颜色分别为白色、淡黄色、黄色实验:化学性质2、Cl-、Br-、I-的检验所选试剂:AgNO3溶液、稀硝酸 KCl + AgNO3 == AgCl ↓(白) + KNO3
KBr + AgNO3 == AgBr ↓(淡黄) + KNO3
KI + AgNO3 == AgI ↓ (黄) + KNO3 化学性质3、与水的反应(与Cl2相似)通式:化学性质4、与金属的反应注意:溴跟金属的反应类似于氯气与金属的反应,碘单质由于得电子能力(氧化性)弱,所以一般碘和变价金属反应时,产物为中间价态的碘化物。化学性质5、与非金属的反应化学性质6、与碱的反应Cl2 + 2NaOH === NaClO + NaCl + H2OBr2 + 2NaOH === NaBrO + NaBr + H2OI2 + 2NaOH === NaIO + NaI + H2O溴、碘的提取1.提取溴
(树形图)粗盐提取后的母液通入Cl2溶解于水中的Br2热空气水蒸气Br2蒸气 冷 凝粗溴精制 提纯高纯溴溴、碘的提取2.提取碘
(树形图)粉碎的海带水浸泡 通Cl2溶解水中的I2 过 滤滤渣碘水提纯(萃取)碘单质溴、碘的应用 溴可用于生产多种药剂,如薰蒸剂,杀虫剂,抗爆剂;碘也是一种重要的药用元素,可治疗口腔溃疡,如碘甘油,华素片(还可制加碘盐)。1.液溴如何保存?2.如何从食盐和碘的混合物中提取碘?答:应密封保存,并在瓶中加一些水,以防止挥发。(用水封是因为溴的密度比水大,且在水中溶解度不大。)答:加热食盐和碘的混合物。碘易升华,从而可将碘提取出来。
②易挥发(刺激性气味,有毒)
③具有强的腐蚀性
④在水中溶解度不大,易 溶于乙醇、CCl4、苯等
⑤ ρBr2 >ρH2O棕色试剂瓶中水封保存2、碘(I2):物理性质①紫黑色晶体 ,有金属光泽
②易升华
③在水中溶解度比溴还小,易溶于乙醇、CCl4、苯等棕色试剂瓶中密封保存实验:①在两支试管分别加入2~3ml KBr 和 KI溶液,滴加少量新制氯水,再滴加少量CCl4,振荡、静置,观察现象。原因:2KBr + Cl2 == 2KCl + Br2
2KI + Cl2 == 2KCl + I2现象:下层溶液颜色分别为橙色、紫色实验:②在一支试管加入2~3ml KI溶液,滴加少量溴水,再滴加少量CCl4,振荡、静置,观察现象原因: 2KI + Br2 == 2KBr + I2现象:下层溶液颜色为 紫色化学性质1、卤族单质间的置换反应2KBr + Cl2 == 2KCl + Br2
2KI + Cl2 == 2KCl + I22KI + Br2 == 2KBr + I2活泼性比较:
Cl2 > Br2 > I2③在三支试管分别加入2~3ml KCl、KBr 和 KI溶液,滴加AgNO3溶液,再滴加稀硝酸,观察现象原因:KCl + AgNO3 == AgCl ↓ + KNO3
KBr + AgNO3 == AgBr ↓ + KNO3
KI + AgNO3 == AgI ↓ + KNO3 现象:都出现不溶于稀硝酸的沉淀,颜色分别为白色、淡黄色、黄色实验:化学性质2、Cl-、Br-、I-的检验所选试剂:AgNO3溶液、稀硝酸 KCl + AgNO3 == AgCl ↓(白) + KNO3
KBr + AgNO3 == AgBr ↓(淡黄) + KNO3
KI + AgNO3 == AgI ↓ (黄) + KNO3 化学性质3、与水的反应(与Cl2相似)通式:化学性质4、与金属的反应注意:溴跟金属的反应类似于氯气与金属的反应,碘单质由于得电子能力(氧化性)弱,所以一般碘和变价金属反应时,产物为中间价态的碘化物。化学性质5、与非金属的反应化学性质6、与碱的反应Cl2 + 2NaOH === NaClO + NaCl + H2OBr2 + 2NaOH === NaBrO + NaBr + H2OI2 + 2NaOH === NaIO + NaI + H2O溴、碘的提取1.提取溴
(树形图)粗盐提取后的母液通入Cl2溶解于水中的Br2热空气水蒸气Br2蒸气 冷 凝粗溴精制 提纯高纯溴溴、碘的提取2.提取碘
(树形图)粉碎的海带水浸泡 通Cl2溶解水中的I2 过 滤滤渣碘水提纯(萃取)碘单质溴、碘的应用 溴可用于生产多种药剂,如薰蒸剂,杀虫剂,抗爆剂;碘也是一种重要的药用元素,可治疗口腔溃疡,如碘甘油,华素片(还可制加碘盐)。1.液溴如何保存?2.如何从食盐和碘的混合物中提取碘?答:应密封保存,并在瓶中加一些水,以防止挥发。(用水封是因为溴的密度比水大,且在水中溶解度不大。)答:加热食盐和碘的混合物。碘易升华,从而可将碘提取出来。
