苏教版化学1专题二复习课件[上学期]
图片预览







文档简介
课件21张PPT。氯、溴、碘的制备与性质一、氯气的制备与性质(一)氯碱工业——电解食盐水生产氯气和烧碱的化学工业
2NaCl + 2H2O == 2NaOH + H2↑ +Cl2↑工业装置(二)氯气的实验室制备
氯自1774年被舍勒发现,到1810年被戴维确认为一种元素,经历了36年。
实验室制备:
①原理:
MnO2+4HCl(浓) = MnCl2+Cl2↑+2H2O
②装置:固液加热型
③收集:向上排空气法
④验满:湿润的淀粉-碘化钾试纸等
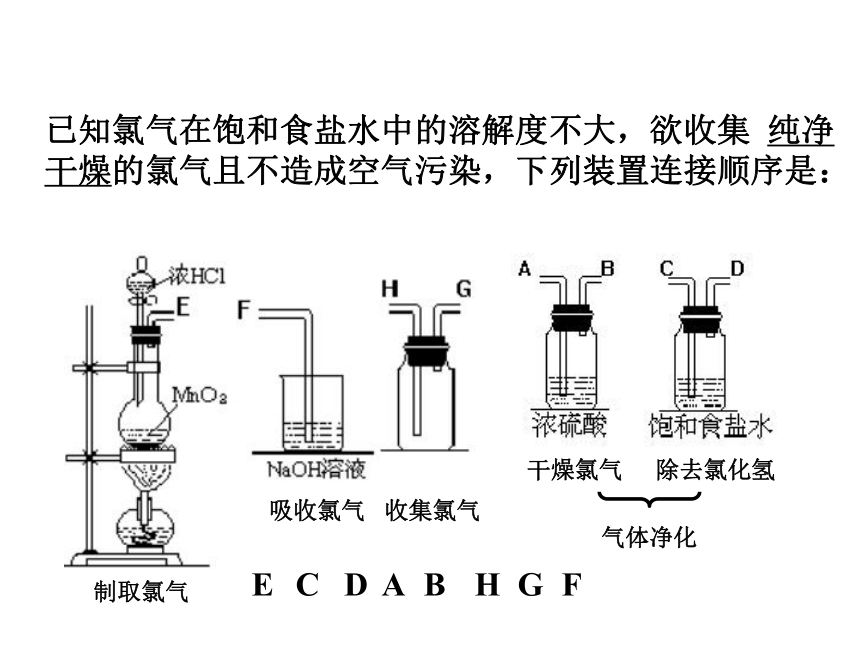
⑤尾气吸收:NaOH溶液。已知氯气在饱和食盐水中的溶解度不大,欲收集 纯净干燥的氯气且不造成空气污染,下列装置连接顺序是:C D A H GFBE除去氯化氢干燥氯气收集氯气吸收氯气制取氯气气体净化(三)氯气的物理性质 通常情况下,氯气是 色气体,有 气味的气体,密度比空气 ,有 ,容易 ,能溶于水。黄绿刺激性毒大液化(四)氯气的化学性质 1、与金属反应(与变价金属反应,均使金属达到最高价态)2、与非金属反应3、与水反应Cl2 + H2O = HCl + HClO注意:1、光照氯水,黄绿色逐渐退色,溶液的PH值逐渐减小;
2、保存氯水时,应避光照,实验室通常将氯水保存在棕色瓶中密封保存。 氯水是氯气的水溶液,通常情况下,1体积水能溶解约2体积氯气,形成淡黄绿色液体。溶解于水中的氯气部分(新制氯水中约39%氯分子反应)与水反应生成盐酸和次氯酸。
新制氯水成分: H2O、 Cl2、HClO、
H+、Cl-、ClO-、OH-
久置氯水成分:H2O、H+、Cl-、OH-、
氯水是混合物,液氯是纯净物。
氯水的成分2NaOH + Cl2 == NaCl + NaClO + H2O
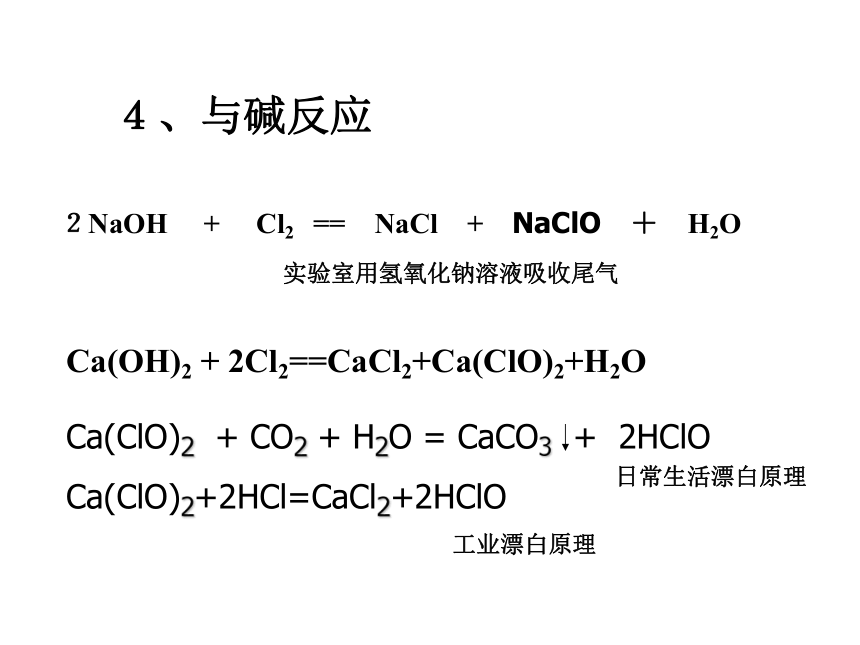
4、与碱反应实验室用氢氧化钠溶液吸收尾气Ca(OH)2 + 2Cl2==CaCl2+Ca(ClO)2+H2O
日常生活漂白原理工业漂白原理拓展1:氯水
氯水为黄绿色,所含Cl2有少量与水反应(Cl2+H2OHCl+HClO),大部分仍以分子形式存在,氯水的主要溶质是Cl2。新制氯水含Cl2、H2O、HClO、H+、Cl-、ClO-、OH-等微粒。
拓展2:次氯酸
次氯酸(HClO)是比H2CO3还弱的酸,溶液中主要以HClO分子形式存在。性质:①易分解(2HClO==2HCl+O2↑),光照时会加速。②是强氧化剂:能杀菌 ;能使某些有机色素褪色。
拓展3:漂白粉
次氯酸盐比次氯酸稳定,容易保存,工业上以Cl2和石灰乳为原料制成漂白粉;漂白粉的有效成分 【Ca(ClO) 2】,须和酸(或空气中CO2)作用产生次氯酸,才能发挥漂白作用。
二、溴、碘的制备与性质
2NaBr+Cl2=2Br2+2NaCl
2NaI+Cl2 == I2+2NaCl
2NaI+Br2 == I2+2NaBr(一)溴、碘的制备(二)溴、碘的性质和用途钠及其化合物(一) 钠700~800oC
?钠在氯气中燃烧,黄色火焰,白烟:
2Na+Cl2 ==== 2NaCl通电(二) 钠的化合物相互转换侯德榜制碱法 向饱和食盐水中通入足量氨气至饱和,然后在加压下通入CO2,利用NaHCO3溶解度较小,析出NaHCO3,将析出的NaHCO3晶体煅烧,即得Na2CO3。点燃
点燃
点燃
2Mg+O2====2MgO
Mg+2HCl=MgCl2+H2↑
镁的提取和性质
2Mg+CO2====2MgO+C
镁的制备氧化还原反应
1、氧化还原反应的有关概念
氧化还原反应的实质:发生电子转移(电子的得失或电子对的偏移)。
化合价降低 , 得 ne- , 被还原
?
氧化剂+还原剂= 还原产物 + 氧化产物
化合价升高 , 失 ne- , 被氧化
2、氧化还原反应的一般规律
同一反应中:①氧化反应与还原反应同时发生,相互依存。②氧化剂得电子总数与还原剂失电子总数相等。即氧化剂化合价降低总数与还原剂化合价升高总数相等。
3、氧化还原反应中电子转移的表示方法(双线桥法)
书写要求:①箭头是由反应物中的某一元素指向对应的生成物中的同一元素。
②一定要标出得、失电子的总数,并且数值相等。
写——写出对应的发生的反应的 化学方程式; 拆——把易溶于水,易电离的物质拆成离子形式 删——将不参加反应的离子从方程式两端删去。 查——检查方程式两端各元素的原子个数和电荷数是否相等。(此内容我们已复习) 离子方程式书写方法:
2NaCl + 2H2O == 2NaOH + H2↑ +Cl2↑工业装置(二)氯气的实验室制备
氯自1774年被舍勒发现,到1810年被戴维确认为一种元素,经历了36年。
实验室制备:
①原理:
MnO2+4HCl(浓) = MnCl2+Cl2↑+2H2O
②装置:固液加热型
③收集:向上排空气法
④验满:湿润的淀粉-碘化钾试纸等
⑤尾气吸收:NaOH溶液。已知氯气在饱和食盐水中的溶解度不大,欲收集 纯净干燥的氯气且不造成空气污染,下列装置连接顺序是:C D A H GFBE除去氯化氢干燥氯气收集氯气吸收氯气制取氯气气体净化(三)氯气的物理性质 通常情况下,氯气是 色气体,有 气味的气体,密度比空气 ,有 ,容易 ,能溶于水。黄绿刺激性毒大液化(四)氯气的化学性质 1、与金属反应(与变价金属反应,均使金属达到最高价态)2、与非金属反应3、与水反应Cl2 + H2O = HCl + HClO注意:1、光照氯水,黄绿色逐渐退色,溶液的PH值逐渐减小;
2、保存氯水时,应避光照,实验室通常将氯水保存在棕色瓶中密封保存。 氯水是氯气的水溶液,通常情况下,1体积水能溶解约2体积氯气,形成淡黄绿色液体。溶解于水中的氯气部分(新制氯水中约39%氯分子反应)与水反应生成盐酸和次氯酸。
新制氯水成分: H2O、 Cl2、HClO、
H+、Cl-、ClO-、OH-
久置氯水成分:H2O、H+、Cl-、OH-、
氯水是混合物,液氯是纯净物。
氯水的成分2NaOH + Cl2 == NaCl + NaClO + H2O
4、与碱反应实验室用氢氧化钠溶液吸收尾气Ca(OH)2 + 2Cl2==CaCl2+Ca(ClO)2+H2O
日常生活漂白原理工业漂白原理拓展1:氯水
氯水为黄绿色,所含Cl2有少量与水反应(Cl2+H2OHCl+HClO),大部分仍以分子形式存在,氯水的主要溶质是Cl2。新制氯水含Cl2、H2O、HClO、H+、Cl-、ClO-、OH-等微粒。
拓展2:次氯酸
次氯酸(HClO)是比H2CO3还弱的酸,溶液中主要以HClO分子形式存在。性质:①易分解(2HClO==2HCl+O2↑),光照时会加速。②是强氧化剂:能杀菌 ;能使某些有机色素褪色。
拓展3:漂白粉
次氯酸盐比次氯酸稳定,容易保存,工业上以Cl2和石灰乳为原料制成漂白粉;漂白粉的有效成分 【Ca(ClO) 2】,须和酸(或空气中CO2)作用产生次氯酸,才能发挥漂白作用。
二、溴、碘的制备与性质
2NaBr+Cl2=2Br2+2NaCl
2NaI+Cl2 == I2+2NaCl
2NaI+Br2 == I2+2NaBr(一)溴、碘的制备(二)溴、碘的性质和用途钠及其化合物(一) 钠700~800oC
?钠在氯气中燃烧,黄色火焰,白烟:
2Na+Cl2 ==== 2NaCl通电(二) 钠的化合物相互转换侯德榜制碱法 向饱和食盐水中通入足量氨气至饱和,然后在加压下通入CO2,利用NaHCO3溶解度较小,析出NaHCO3,将析出的NaHCO3晶体煅烧,即得Na2CO3。点燃
点燃
点燃
2Mg+O2====2MgO
Mg+2HCl=MgCl2+H2↑
镁的提取和性质
2Mg+CO2====2MgO+C
镁的制备氧化还原反应
1、氧化还原反应的有关概念
氧化还原反应的实质:发生电子转移(电子的得失或电子对的偏移)。
化合价降低 , 得 ne- , 被还原
?
氧化剂+还原剂= 还原产物 + 氧化产物
化合价升高 , 失 ne- , 被氧化
2、氧化还原反应的一般规律
同一反应中:①氧化反应与还原反应同时发生,相互依存。②氧化剂得电子总数与还原剂失电子总数相等。即氧化剂化合价降低总数与还原剂化合价升高总数相等。
3、氧化还原反应中电子转移的表示方法(双线桥法)
书写要求:①箭头是由反应物中的某一元素指向对应的生成物中的同一元素。
②一定要标出得、失电子的总数,并且数值相等。
写——写出对应的发生的反应的 化学方程式; 拆——把易溶于水,易电离的物质拆成离子形式 删——将不参加反应的离子从方程式两端删去。 查——检查方程式两端各元素的原子个数和电荷数是否相等。(此内容我们已复习) 离子方程式书写方法:
