氯、溴、碘的制备与性质的复习[上学期]
图片预览






文档简介
课件20张PPT。氯、溴、碘的制备与性质
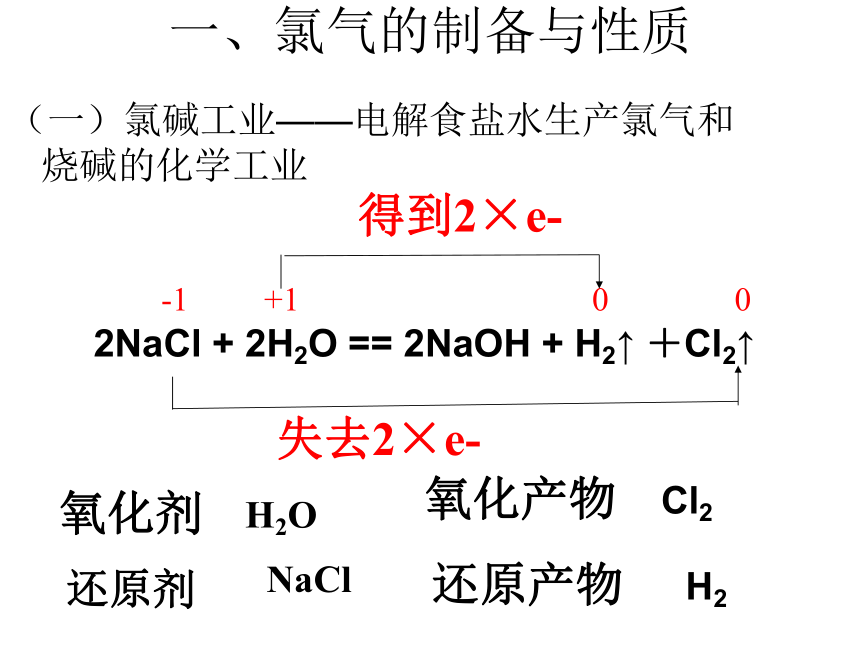
复习一、氯气的制备与性质(一)氯碱工业——电解食盐水生产氯气和烧碱的化学工业2NaCl + 2H2O == 2NaOH + H2↑ +Cl2↑-1 +1 0 0 失去2×e-得到2×e-氧化剂还原剂H2ONaCl氧化产物还原产物Cl2 H2两极均产生气泡通电后有新的气体物质生成将铁棒上方收集到的气体靠近火焰,有轻微的爆鸣声有氢气生成黄绿色、刺激性气味的气体产生,湿润的淀粉碘化钾试纸变蓝有氯气生成铁棒周围的颜色变红有碱性物质生成(二)氯气的实验室制备
氯自1774年被舍勒发现,到1810年被戴维确认为一种元素,经历了36年。
实验室制备:
①原理:
②装置:
③收集:
④验满:
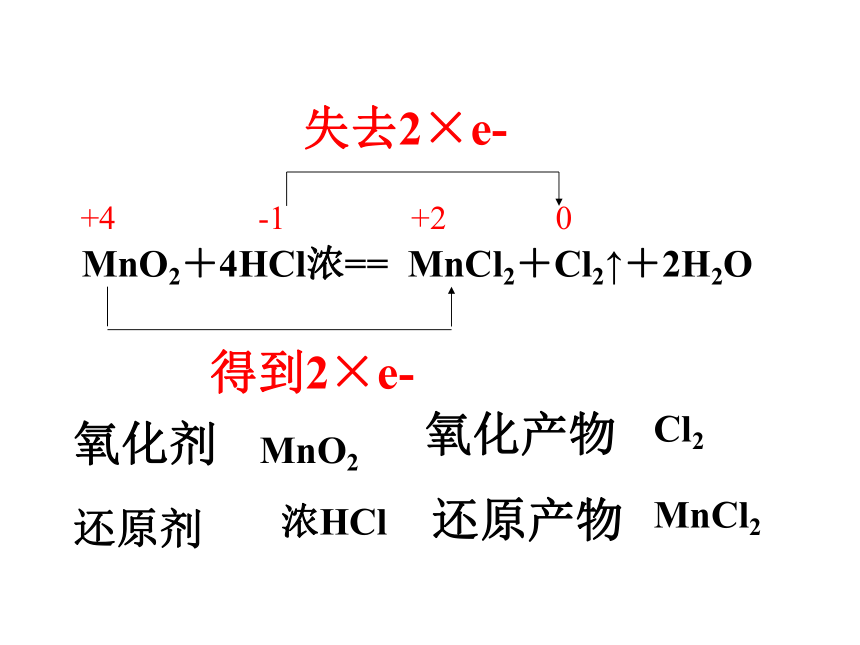
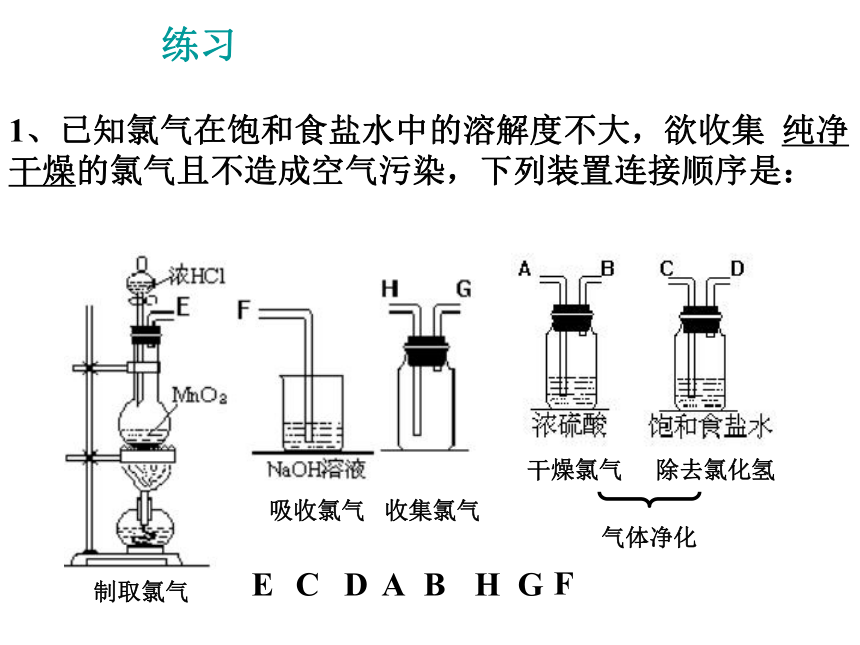
⑤尾气吸收:。MnO2+4HCl(浓) = MnCl2+Cl2↑+2H2O固液加热型向上排空气法湿润的淀粉-碘化钾试纸等NaOH溶液+4 -1 +2 0失去2×e-得到2×e-氧化剂还原剂MnO2浓HClMnO2+4HCl浓== MnCl2+Cl2↑+2H2O氧化产物还原产物Cl2MnCl21、已知氯气在饱和食盐水中的溶解度不大,欲收集 纯净干燥的氯气且不造成空气污染,下列装置连接顺序是:C D A H GFBE除去氯化氢干燥氯气收集氯气吸收氯气制取氯气气体净化练习讨论2、使用浓盐酸与足量的MnO2共热制Cl2,实际产生的Cl2总比理论值低,其主要原因是什么?稀盐酸与MnO2不反应,随着反应的进行,浓盐酸的物质的量浓度逐渐变小。(三)氯气的物理性质 通常情况下,氯气是 色气体,有 气味的气体,密度比空气 ,有 ,容易 ,能溶于水。黄绿刺激性毒大液化(四)氯气的化学性质 1、与金属反应(与变价金属反应,均使金属达到最高价态)2、与非金属反应3、与水反应Cl2 + H2O 〓 HCl + HClO注意:1、光照氯水,黄绿色逐渐退色,溶液的PH值逐渐减小;
2、保存氯水时,应避光照,实验室通常将氯水保存在棕色瓶中密封保存。 氯水是氯气的水溶液,通常情况下,1体积水能溶解约2体积氯气,形成淡黄绿色液体。溶解于水中的氯气部分(新制氯水中约39%氯分子反应)与水反应生成盐酸和次氯酸。
新制氯水成分: H2O、 Cl2、HClO、
H+、Cl-、ClO-、OH-
久置氯水成分:H2O、H+、Cl-、OH-、
氯水是混合物,液氯是纯净物。
氯水的成分新制氯水中的微粒与其性质的关系沉淀反应Cl-不稳定性
强氧化性HClO酸性H+举例性质微粒Na2CO3+2HCl=2NaCl+CO2↑+H2O遇蓝色石蕊试纸先变红后褪色,使有机色素褪色。有漂白杀菌作用使淀粉KI试纸变蓝。Cl2+2KI=I2+2KCl见光分解,氯水必须保存在棕色瓶中Cl - + Ag + = AgCl↓思考Cl2强氧化性2NaOH+ Cl2 ==NaCl+NaClO+H2O4、与碱反应实验室用氢氧化钠溶液吸收尾气2Ca(OH)2 + 2Cl2==CaCl2+Ca(ClO)2+2H2O
日常生活漂白原理工业漂白原理制漂白粉原理1.当不慎有大量Cl2逸到周围空气里时,可用浸有一定浓度的下列物质溶液的毛巾捂住鼻子,该物质是
A.NaOH B.NaCl C.H2O D.Na2CO3
2.下列说法不正确的是
A.H2在Cl2中燃烧会产生苍白色火焰
B.氯水用于漂白表现了HClO的强氧化性
C.漂白粉是混合物其有效成分是次氯酸钠
D.漂白粉放入稀酸中可以提高漂白速度DC练习五、溴、碘的制备与性质
2NaBr+Cl2=2Br2+2NaCl
2NaI+Cl2 == I2+2NaCl
2NaI+Br2 == I2+2NaBr(一)溴、碘的制备(二)溴、碘的性质和用途三、I2的检验:试剂:淀粉溶液
现象:溶液变蓝色
四、Cl-、Br- 、I- 的检验:
试剂:AgNO3溶液和稀硝酸
现象:产生白色沉淀(Cl-);浅黄色沉淀(含Br-);黄色沉淀(含I-)
例:NaCI + AgNO3 = AgCI↓+ NaNO3
NaBr + AgNO3 = AgBr↓ + NaNO3
NaI + AgNO3 = AgI↓+ NaNO3 1、下列反应能说明卤素非金属性活泼顺序是Cl>Br>I的是
①2HClO4+Br2(气) = 2HBrO4+Cl2?
②2NaBr+Cl2 = 2NaCl+Br2
③2KI+Cl2 = 2KCl+I2
④2KI+Br2 = 2KBr+I2
A.①②③ B.①②④
C.②③④ D.①②③④C练习2、溴化碘(IBr)的化学性质与卤素单质相似,能跟大多数金属反应生成金属卤化物,能跟水反应IBr+H2O==HBr+HIO.下列有关叙述中不正确的是 ( )
A.IBr是双原子分子
B.IBr与水反应时它既是氧化剂,又是还原剂
C.在很多化学反应中IBr作氧化剂
D.跟NaOH溶液反应可生成NaBr和NaIO
B
氯自1774年被舍勒发现,到1810年被戴维确认为一种元素,经历了36年。
实验室制备:
①原理:
②装置:
③收集:
④验满:
⑤尾气吸收:。MnO2+4HCl(浓) = MnCl2+Cl2↑+2H2O固液加热型向上排空气法湿润的淀粉-碘化钾试纸等NaOH溶液+4 -1 +2 0失去2×e-得到2×e-氧化剂还原剂MnO2浓HClMnO2+4HCl浓== MnCl2+Cl2↑+2H2O氧化产物还原产物Cl2MnCl21、已知氯气在饱和食盐水中的溶解度不大,欲收集 纯净干燥的氯气且不造成空气污染,下列装置连接顺序是:C D A H GFBE除去氯化氢干燥氯气收集氯气吸收氯气制取氯气气体净化练习讨论2、使用浓盐酸与足量的MnO2共热制Cl2,实际产生的Cl2总比理论值低,其主要原因是什么?稀盐酸与MnO2不反应,随着反应的进行,浓盐酸的物质的量浓度逐渐变小。(三)氯气的物理性质 通常情况下,氯气是 色气体,有 气味的气体,密度比空气 ,有 ,容易 ,能溶于水。黄绿刺激性毒大液化(四)氯气的化学性质 1、与金属反应(与变价金属反应,均使金属达到最高价态)2、与非金属反应3、与水反应Cl2 + H2O 〓 HCl + HClO注意:1、光照氯水,黄绿色逐渐退色,溶液的PH值逐渐减小;
2、保存氯水时,应避光照,实验室通常将氯水保存在棕色瓶中密封保存。 氯水是氯气的水溶液,通常情况下,1体积水能溶解约2体积氯气,形成淡黄绿色液体。溶解于水中的氯气部分(新制氯水中约39%氯分子反应)与水反应生成盐酸和次氯酸。
新制氯水成分: H2O、 Cl2、HClO、
H+、Cl-、ClO-、OH-
久置氯水成分:H2O、H+、Cl-、OH-、
氯水是混合物,液氯是纯净物。
氯水的成分新制氯水中的微粒与其性质的关系沉淀反应Cl-不稳定性
强氧化性HClO酸性H+举例性质微粒Na2CO3+2HCl=2NaCl+CO2↑+H2O遇蓝色石蕊试纸先变红后褪色,使有机色素褪色。有漂白杀菌作用使淀粉KI试纸变蓝。Cl2+2KI=I2+2KCl见光分解,氯水必须保存在棕色瓶中Cl - + Ag + = AgCl↓思考Cl2强氧化性2NaOH+ Cl2 ==NaCl+NaClO+H2O4、与碱反应实验室用氢氧化钠溶液吸收尾气2Ca(OH)2 + 2Cl2==CaCl2+Ca(ClO)2+2H2O
日常生活漂白原理工业漂白原理制漂白粉原理1.当不慎有大量Cl2逸到周围空气里时,可用浸有一定浓度的下列物质溶液的毛巾捂住鼻子,该物质是
A.NaOH B.NaCl C.H2O D.Na2CO3
2.下列说法不正确的是
A.H2在Cl2中燃烧会产生苍白色火焰
B.氯水用于漂白表现了HClO的强氧化性
C.漂白粉是混合物其有效成分是次氯酸钠
D.漂白粉放入稀酸中可以提高漂白速度DC练习五、溴、碘的制备与性质
2NaBr+Cl2=2Br2+2NaCl
2NaI+Cl2 == I2+2NaCl
2NaI+Br2 == I2+2NaBr(一)溴、碘的制备(二)溴、碘的性质和用途三、I2的检验:试剂:淀粉溶液
现象:溶液变蓝色
四、Cl-、Br- 、I- 的检验:
试剂:AgNO3溶液和稀硝酸
现象:产生白色沉淀(Cl-);浅黄色沉淀(含Br-);黄色沉淀(含I-)
例:NaCI + AgNO3 = AgCI↓+ NaNO3
NaBr + AgNO3 = AgBr↓ + NaNO3
NaI + AgNO3 = AgI↓+ NaNO3 1、下列反应能说明卤素非金属性活泼顺序是Cl>Br>I的是
①2HClO4+Br2(气) = 2HBrO4+Cl2?
②2NaBr+Cl2 = 2NaCl+Br2
③2KI+Cl2 = 2KCl+I2
④2KI+Br2 = 2KBr+I2
A.①②③ B.①②④
C.②③④ D.①②③④C练习2、溴化碘(IBr)的化学性质与卤素单质相似,能跟大多数金属反应生成金属卤化物,能跟水反应IBr+H2O==HBr+HIO.下列有关叙述中不正确的是 ( )
A.IBr是双原子分子
B.IBr与水反应时它既是氧化剂,又是还原剂
C.在很多化学反应中IBr作氧化剂
D.跟NaOH溶液反应可生成NaBr和NaIO
B
