原子的构成[上学期]
图片预览



文档简介
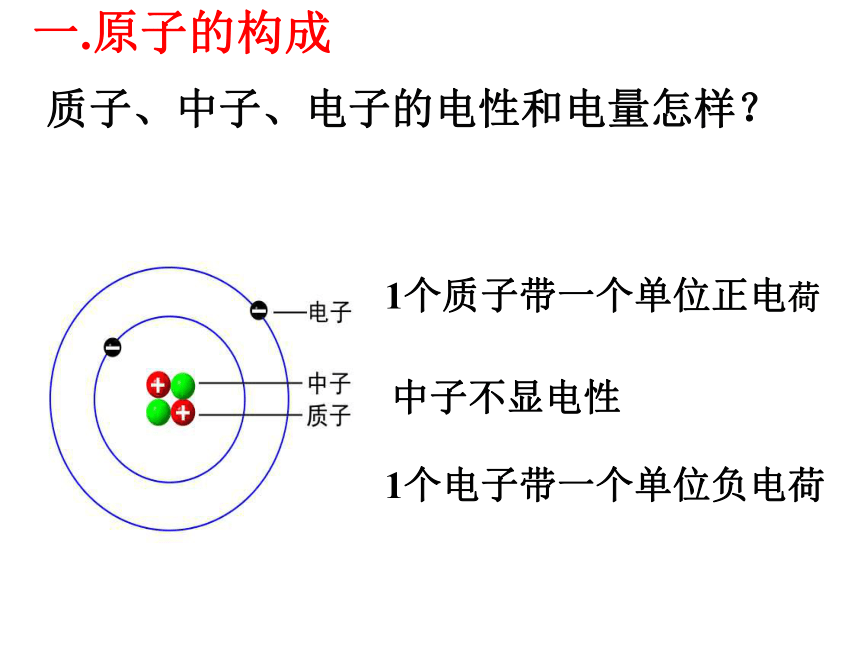
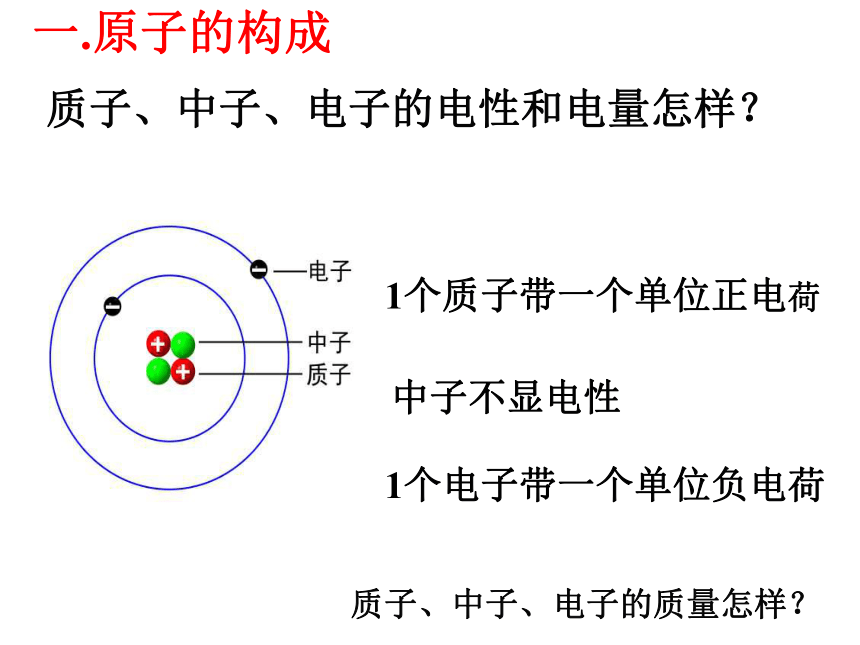
课件18张PPT。 原 子 的 构 成原 子 的 构 成 复习:1、核外电子的排布规律(以1~18号元素为例)②第二层最多可容纳8个电子③最外层不超过8个电子2.原子结构示意图的表示方法1个质子带一个单位正电荷1个电子带一个单位负电荷中子不显电性质子、中子、电子的电性和电量怎样?一.原子的构成1个质子带一个单位正电荷1个电子带一个单位负电荷中子不显电性质子、中子、电子的电性和电量怎样?一.原子的构成质子、中子、电子的质量怎样?P30表1-7
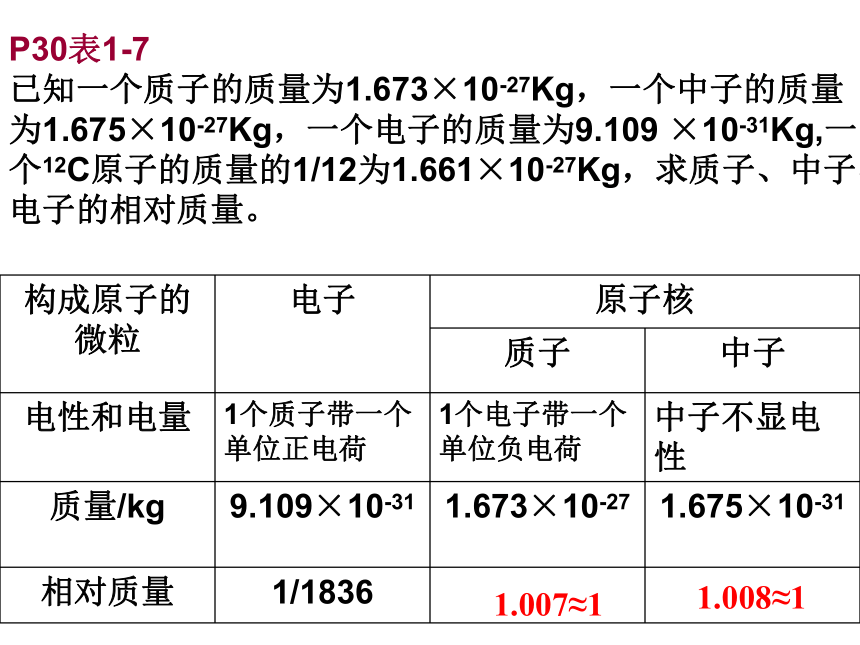
已知一个质子的质量为1.673×10-27Kg,一个中子的质量为1.675×10-27Kg,一个电子的质量为9.109 ×10-31Kg,一个12C原子的质量的1/12为1.661×10-27Kg,求质子、中子、电子的相对质量。
1.007≈1
1.008≈1
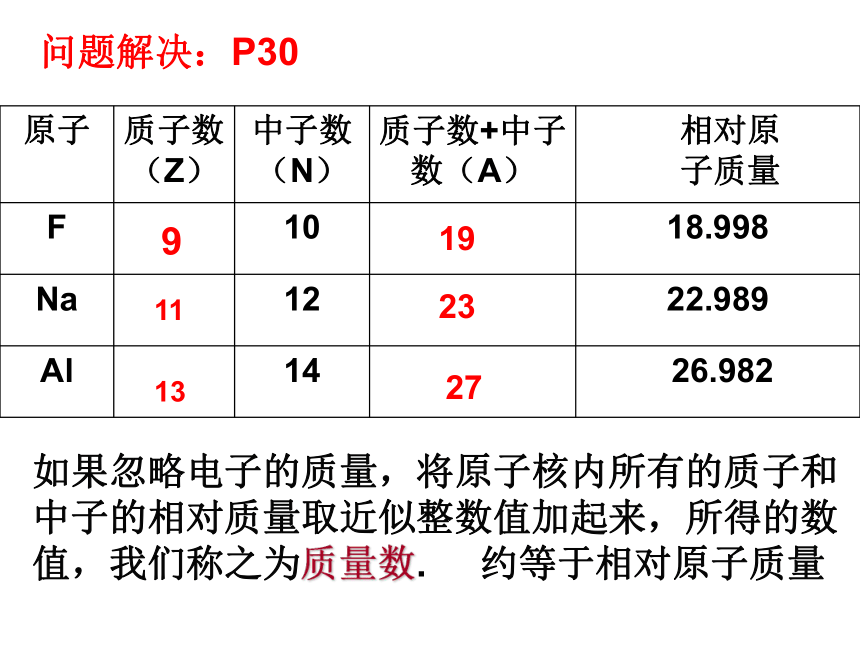
二、构成原子的微粒之间的数量关系问题解决:P3091119231327如果忽略电子的质量,将原子核内所有的质子和中子的相对质量取近似整数值加起来,所得的数值,我们称之为质量数. 约等于相对原子质量——元素符号质量数 —— 核电荷数 ——
(核内质子数)请指出Al、Al3+中所含的质子数和电子数。
原子:核电荷数(Z)=核内质子数=核外电子数
阳离子:核电荷数(Z)=核内质子数>核外电子数
核电荷数(Z)=核外电子数+电荷数
阴离子:核电荷数(Z)=核内质子数<核外电子数
核电荷数(Z)=核外电子数—电荷数
核电荷数(Z)=核外电子数+电荷数(带+-)二、构成原子的微粒之间的数量关系注意:关系式1:(质量关系)
质量数(A)=质子数(Z)+中子数(N)a、b、c、d、e各代表什么? a——代表质量数;
b——代表核电荷数(质子数)
c——代表离子所带的电荷数
d——代表化合价
e——代表原子个数元素:具有相同质子数的同一类原子的总称。同位素:质子数相同而中子数不同的核素互称为同位素。核素:具有一定质子数和一定中子数的一种原子。三、元素、核素、同位素同位素的特点:
①天然存在的元素,各同位素在自然界的含量占该元素总量的百分比(称为“丰度”,即原子百分比)基本上是固定的。
②同种元素,可以有若干种不同的核素。(元素:112种,同位素:1800种)
③同种元素是同一元素的不同核素之间的统称,不指具体的原子。
同一种元素的不同同位素原子其质量数不同,核外电子层结构相同,其原子、单质及其构成的化合物化学性质几乎相同,只是某些物理性质略有差异。同位素构成的化合物是不同的化合物,H2O、D2O、T2O的物理性质不同,化学性质几乎相同。1.据报道,上海某医院正在研究用放射性的一
种碘 治疗肿瘤。该碘原子的核内的中子数与核外电子数之差是A、72 B、19 C、53 D、125B2.某二价阴离子,核外有18个电子,质量数为32,则其中子数为:A、12 B、14 C、16 D、18C课堂练习:A、核外有13个电子
B、核内有6个质子,核外有7个电子
C、质量数为13,质子数为6,核外有7个电子
D、质量数为13,质子数为6,核内有7个中子
00全国高考题D3.4.和Na+具有相同质子数和电子数的微粒是:
A、NH4+ B、F - C、H2O D、NH3A、所含质子数=A-n
B、所含中子数=A-Z
C、所含电子数=Z+n
D、质量数=Z+AAB⒈原子的构成是本节重点,我们需要掌握的关系式:
小结:⑴AZX的含义:代表一个质量数为A、质子数为Z的原子。
AZXqp中各个字母的含义:⑵电性关系 ⑶质量关系:质量数(A)=质子数(Z)+中子数(N)⒉元素、核素、同位素原子:核电荷数(Z)=核内质子数=核外电子数
阳离子:核电荷数(Z)=核内质子数>核外电子数
核电荷数(Z)=核外电子数+电荷数
阴离子:核电荷数(Z)=核内质子数<核外电子数
核电荷数(Z)=核外电子数—电荷数
核电荷数(Z)=核外电子数+电荷数(带+-)
质子数决定元素的种类;中子数决定元素的同位素。作业:P33:2、3、4、5
已知一个质子的质量为1.673×10-27Kg,一个中子的质量为1.675×10-27Kg,一个电子的质量为9.109 ×10-31Kg,一个12C原子的质量的1/12为1.661×10-27Kg,求质子、中子、电子的相对质量。
1.007≈1
1.008≈1
二、构成原子的微粒之间的数量关系问题解决:P3091119231327如果忽略电子的质量,将原子核内所有的质子和中子的相对质量取近似整数值加起来,所得的数值,我们称之为质量数. 约等于相对原子质量——元素符号质量数 —— 核电荷数 ——
(核内质子数)请指出Al、Al3+中所含的质子数和电子数。
原子:核电荷数(Z)=核内质子数=核外电子数
阳离子:核电荷数(Z)=核内质子数>核外电子数
核电荷数(Z)=核外电子数+电荷数
阴离子:核电荷数(Z)=核内质子数<核外电子数
核电荷数(Z)=核外电子数—电荷数
核电荷数(Z)=核外电子数+电荷数(带+-)二、构成原子的微粒之间的数量关系注意:关系式1:(质量关系)
质量数(A)=质子数(Z)+中子数(N)a、b、c、d、e各代表什么? a——代表质量数;
b——代表核电荷数(质子数)
c——代表离子所带的电荷数
d——代表化合价
e——代表原子个数元素:具有相同质子数的同一类原子的总称。同位素:质子数相同而中子数不同的核素互称为同位素。核素:具有一定质子数和一定中子数的一种原子。三、元素、核素、同位素同位素的特点:
①天然存在的元素,各同位素在自然界的含量占该元素总量的百分比(称为“丰度”,即原子百分比)基本上是固定的。
②同种元素,可以有若干种不同的核素。(元素:112种,同位素:1800种)
③同种元素是同一元素的不同核素之间的统称,不指具体的原子。
同一种元素的不同同位素原子其质量数不同,核外电子层结构相同,其原子、单质及其构成的化合物化学性质几乎相同,只是某些物理性质略有差异。同位素构成的化合物是不同的化合物,H2O、D2O、T2O的物理性质不同,化学性质几乎相同。1.据报道,上海某医院正在研究用放射性的一
种碘 治疗肿瘤。该碘原子的核内的中子数与核外电子数之差是A、72 B、19 C、53 D、125B2.某二价阴离子,核外有18个电子,质量数为32,则其中子数为:A、12 B、14 C、16 D、18C课堂练习:A、核外有13个电子
B、核内有6个质子,核外有7个电子
C、质量数为13,质子数为6,核外有7个电子
D、质量数为13,质子数为6,核内有7个中子
00全国高考题D3.4.和Na+具有相同质子数和电子数的微粒是:
A、NH4+ B、F - C、H2O D、NH3A、所含质子数=A-n
B、所含中子数=A-Z
C、所含电子数=Z+n
D、质量数=Z+AAB⒈原子的构成是本节重点,我们需要掌握的关系式:
小结:⑴AZX的含义:代表一个质量数为A、质子数为Z的原子。
AZXqp中各个字母的含义:⑵电性关系 ⑶质量关系:质量数(A)=质子数(Z)+中子数(N)⒉元素、核素、同位素原子:核电荷数(Z)=核内质子数=核外电子数
阳离子:核电荷数(Z)=核内质子数>核外电子数
核电荷数(Z)=核外电子数+电荷数
阴离子:核电荷数(Z)=核内质子数<核外电子数
核电荷数(Z)=核外电子数—电荷数
核电荷数(Z)=核外电子数+电荷数(带+-)
质子数决定元素的种类;中子数决定元素的同位素。作业:P33:2、3、4、5
