溶液的配制及分析(第二课时)[上学期]
文档属性
| 名称 | 溶液的配制及分析(第二课时)[上学期] |  | |
| 格式 | rar | ||
| 文件大小 | 367.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-10-04 10:24:00 | ||
图片预览





文档简介
课件19张PPT。课前小测课程要求反馈练习误差分析仪器使用作业布置实验步骤溶液的配制及分析课前小测: 配制 100mL 0.1mol/L的Na2CO3溶液,需要Na2CO3多少克?实验目的:2、初步学会配制一定物质的量的
浓度溶液的方法。3、记住配制一定物质的量浓度溶液
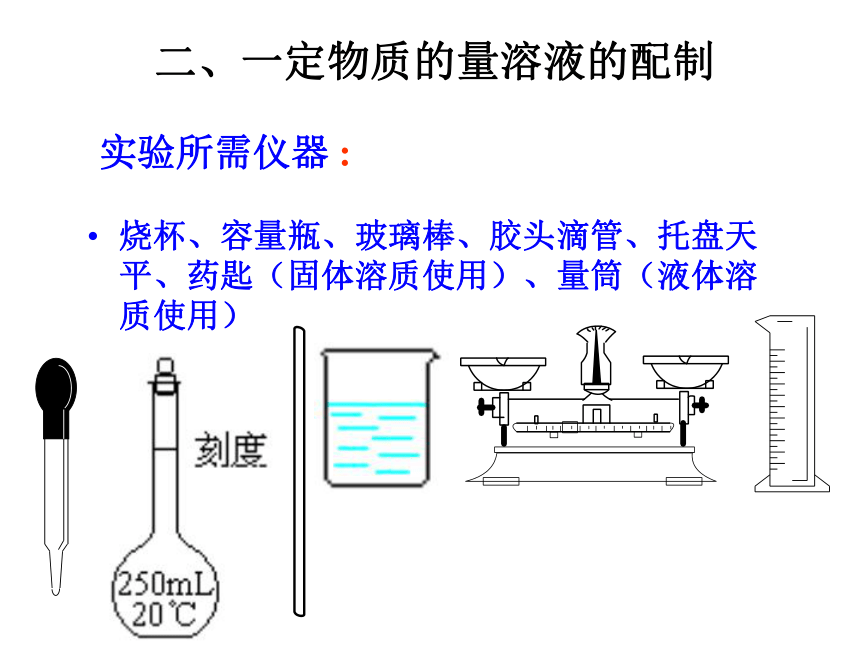
的操作步骤。1、学会容量瓶的使用。实验所需仪器 :烧杯、容量瓶、玻璃棒、胶头滴管、托盘天平、药匙(固体溶质使用)、量筒(液体溶质使用) 二、一定物质的量溶液的配制容量瓶简介:容量瓶2.使用之前要检查是否漏水.如何检漏? 加水倒立观察瓶塞旋转180o倒立观察3.只能用作配制的量具。不能在其中直接溶解或稀释固体或浓溶液,不能将热的溶液倒入,不能作为反应器,也不能不能长期存放溶液。4.定容时 ,应平视,使溶液的凹液面正好与刻度相切。形状:细颈,梨形,平底的玻璃瓶;构造:瓶上标有容积,温度,颈部标有刻度线;规格:100mL,250,500mL,1000mL;步骤 计算称量 :用天平准确称取碳酸钠固体溶解 :在烧杯中用20毫升蒸馏水使之完全溶解(注意:应冷却,不可在容量瓶中溶解)转移、洗涤:将溶液移入100mL容量瓶,洗涤烧杯和玻璃棒两到三次(用玻璃棒引流)定容:加水到接近刻度1~2厘米时,改用胶头滴管加水到刻度,
摇匀。
装入试剂瓶,
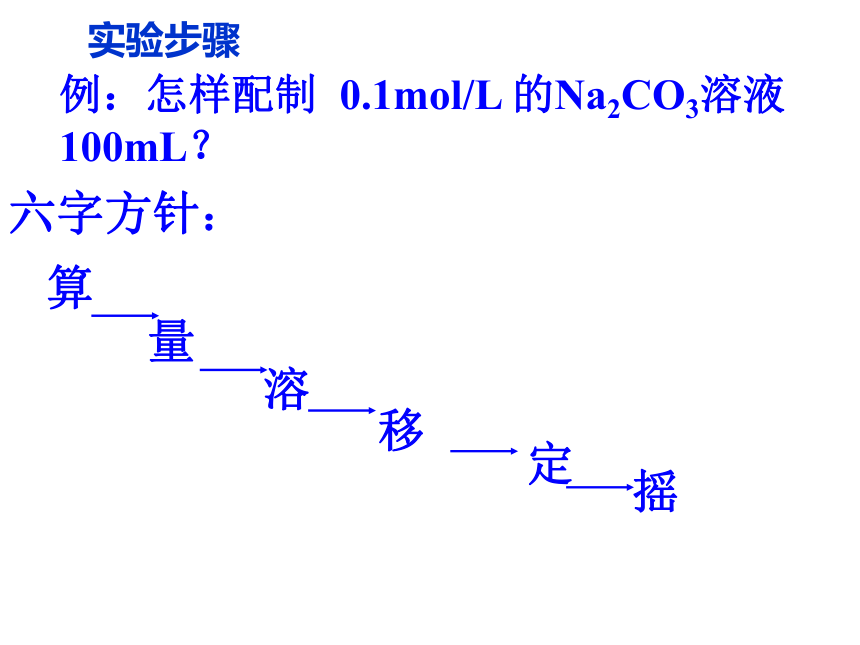
贴上标签。(量取)(稀释)六字方针:算量溶定移例:怎样配制 0.1mol/L 的Na2CO3溶液100mL?摇实验步骤1.1gNa2CO3讨论在配制溶液中哪些操作可能引起溶液浓度的误差? ?可能影响溶液浓度的操作1、固体药品的称量与液体药品的量取是否准确;
2、把溶液向容量瓶中转移,溶液洒了;
3、未洗涤烧杯和玻璃棒或洗涤了量筒;
4、定容时水加多了或加少了;
5、定容时未平视刻度线。 误差分析讨论定容时俯视或仰视刻度线,对溶液定容时俯视或仰视刻度线,对溶液的浓度有何影响??俯视仰视误差分析???? 根据 C = n / V 或(n = m / V)分析(以配制某浓度NaOH溶液为例,请同学们将C 的结果填入表中)减小 不变减小 减小 不变减小 减小 不变减小 不变减小 增大 减小 不变减小 不变增大减小不变减小 增大不变增大 减小 不变不变不变小结:配制溶液六忌 一忌用容量瓶进行溶解(体积不准确,也不受热)
二忌直接往容量瓶倒液(洒到外面)
三忌加水超过刻度线(浓度偏低)
四忌读数仰视或俯视(仰视浓度偏低, 俯视浓度偏高)
五忌不洗涤玻璃棒和烧杯(浓度偏低)
六忌标准液存放于容量瓶(容量瓶是量器,不是容器) 反馈练习:一、下列操作使所配溶液的物质的量浓度比理论值填空:A 偏高B 偏低C无影响1、容量瓶用蒸馏水洗净后,未干燥就用
来配液 。2、烧杯中溶液向容量瓶转移时,漏掉了
一些 。3、定容时,俯视液面 。CBA①用天平称取氢氧化钠固体 克
②将称好的氢氧化钠固体放入 中 加 蒸馏水将其溶解,待 后将溶液沿 移入 mL的容量瓶中。10烧杯少量冷却玻璃棒250二、欲配制1 mol/L的氢氧化钠溶液250mL,完成下列步骤:.0③用少量蒸馏水冲洗 次,将冲洗液移入 中,在操作过程中不能损失点滴液体,否则会使溶液的浓度偏 (高或低)。
④向容量瓶内加水至刻度线 时,改用 小心地加水至溶液凹液面与刻度线相切,若加水超过刻度线,会造成溶液浓度 应该 。
⑤最后盖好瓶盖, ,将配好的溶液移入 中并贴好标签。 2~3低1~2厘米胶头滴管偏低重新配制摇匀容量瓶试剂瓶作业布置:1、作业本对应习题2、书本P25 练习与实践4
浓度溶液的方法。3、记住配制一定物质的量浓度溶液
的操作步骤。1、学会容量瓶的使用。实验所需仪器 :烧杯、容量瓶、玻璃棒、胶头滴管、托盘天平、药匙(固体溶质使用)、量筒(液体溶质使用) 二、一定物质的量溶液的配制容量瓶简介:容量瓶2.使用之前要检查是否漏水.如何检漏? 加水倒立观察瓶塞旋转180o倒立观察3.只能用作配制的量具。不能在其中直接溶解或稀释固体或浓溶液,不能将热的溶液倒入,不能作为反应器,也不能不能长期存放溶液。4.定容时 ,应平视,使溶液的凹液面正好与刻度相切。形状:细颈,梨形,平底的玻璃瓶;构造:瓶上标有容积,温度,颈部标有刻度线;规格:100mL,250,500mL,1000mL;步骤 计算称量 :用天平准确称取碳酸钠固体溶解 :在烧杯中用20毫升蒸馏水使之完全溶解(注意:应冷却,不可在容量瓶中溶解)转移、洗涤:将溶液移入100mL容量瓶,洗涤烧杯和玻璃棒两到三次(用玻璃棒引流)定容:加水到接近刻度1~2厘米时,改用胶头滴管加水到刻度,
摇匀。
装入试剂瓶,
贴上标签。(量取)(稀释)六字方针:算量溶定移例:怎样配制 0.1mol/L 的Na2CO3溶液100mL?摇实验步骤1.1gNa2CO3讨论在配制溶液中哪些操作可能引起溶液浓度的误差? ?可能影响溶液浓度的操作1、固体药品的称量与液体药品的量取是否准确;
2、把溶液向容量瓶中转移,溶液洒了;
3、未洗涤烧杯和玻璃棒或洗涤了量筒;
4、定容时水加多了或加少了;
5、定容时未平视刻度线。 误差分析讨论定容时俯视或仰视刻度线,对溶液定容时俯视或仰视刻度线,对溶液的浓度有何影响??俯视仰视误差分析???? 根据 C = n / V 或(n = m / V)分析(以配制某浓度NaOH溶液为例,请同学们将C 的结果填入表中)减小 不变减小 减小 不变减小 减小 不变减小 不变减小 增大 减小 不变减小 不变增大减小不变减小 增大不变增大 减小 不变不变不变小结:配制溶液六忌 一忌用容量瓶进行溶解(体积不准确,也不受热)
二忌直接往容量瓶倒液(洒到外面)
三忌加水超过刻度线(浓度偏低)
四忌读数仰视或俯视(仰视浓度偏低, 俯视浓度偏高)
五忌不洗涤玻璃棒和烧杯(浓度偏低)
六忌标准液存放于容量瓶(容量瓶是量器,不是容器) 反馈练习:一、下列操作使所配溶液的物质的量浓度比理论值填空:A 偏高B 偏低C无影响1、容量瓶用蒸馏水洗净后,未干燥就用
来配液 。2、烧杯中溶液向容量瓶转移时,漏掉了
一些 。3、定容时,俯视液面 。CBA①用天平称取氢氧化钠固体 克
②将称好的氢氧化钠固体放入 中 加 蒸馏水将其溶解,待 后将溶液沿 移入 mL的容量瓶中。10烧杯少量冷却玻璃棒250二、欲配制1 mol/L的氢氧化钠溶液250mL,完成下列步骤:.0③用少量蒸馏水冲洗 次,将冲洗液移入 中,在操作过程中不能损失点滴液体,否则会使溶液的浓度偏 (高或低)。
④向容量瓶内加水至刻度线 时,改用 小心地加水至溶液凹液面与刻度线相切,若加水超过刻度线,会造成溶液浓度 应该 。
⑤最后盖好瓶盖, ,将配好的溶液移入 中并贴好标签。 2~3低1~2厘米胶头滴管偏低重新配制摇匀容量瓶试剂瓶作业布置:1、作业本对应习题2、书本P25 练习与实践4
