高中化学必修1教材分析及教学建议[上学期]
文档属性
| 名称 | 高中化学必修1教材分析及教学建议[上学期] |  | |
| 格式 | rar | ||
| 文件大小 | 189.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-08-19 11:01:00 | ||
图片预览






文档简介
课件47张PPT。高中化学必修1教材分析及教学建议(四)浙江省龙游中学 徐素芳 Email: lyxsf@qu-zhou.com1、高中化学必修课程内容标准:
(1)学习常见的化学物质,……了解它们在生产、生活和
化学研究中的应用。
(2)学习必要的化学实验技能,体验化学和了解化学科学
研究的一般过程和方法。
(3)正确认识科学和技术与社会的相互关系,能运用所学
知识解释生产、生活中的化学现象,解决与化学有关的一些
实际问题,树立社会可持续发展的思想。一、对新课程标准的理解主题3 常见无机物及其应用2、课程标准的内容特点:苏教版《化学1》
专题2、专题3:工业制法→物质性质→STS联系
专题4: 课程标准中对元素化合物的处理从生活走进化学,从化学走向社会 传统的物质中心模式:核心知识过程方法STS内容二、本专题教学目标要求1、课标要求知识主线学科方法策略主线STS主线三条基本内容线索专题4 硫、氮和可持续发展2、教材(苏教版)呈现形式:专题4 硫、氮和可持续发展 第一单元 含硫化合物的性质和应用
酸雨的形成与危害、二氧化硫性质
硫酸的制备和性质(浓硫酸的氧化性等)、常见的硫酸盐
硫元素不同价态之间的转化
第二单元 生产生活中的含氮化合物
氮氧化物的形成和性质
氮肥工业、氨的制取和性质、铵盐
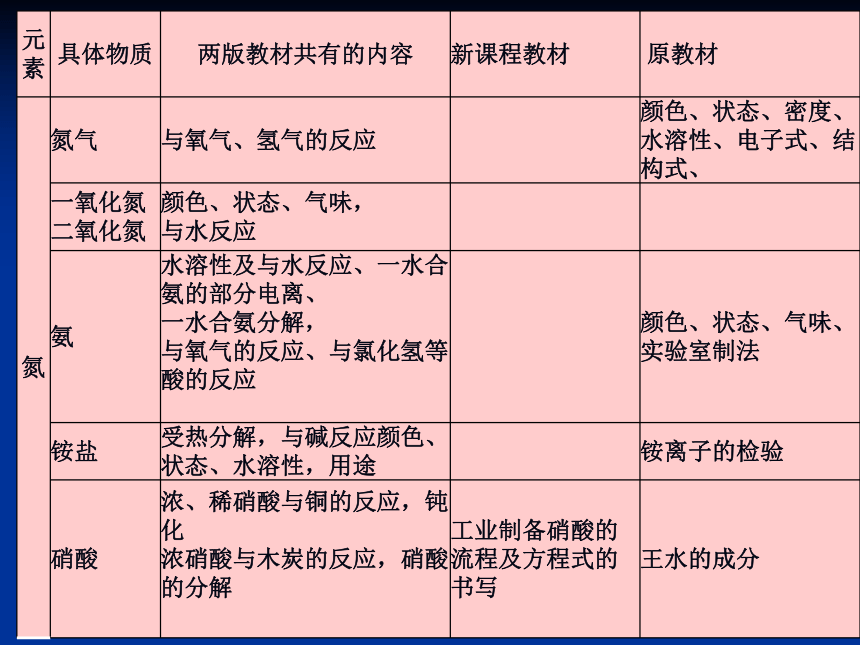
硝酸的性质、应用及制备3、教学目标(核心知识)三、教材知识比较及衔接分析1、新课程教材与原教材的比较 元素化合物知识在内容覆盖上差别不大,内容的组织
线索、具体化合物知识内容的选取、内容处理的深广度有
较大变化。● 不再分“律前元素”和“律后元素”;
● 不再“跑族”;
● 从“生活走进化学,从化学走向社会”;“从自然走进化学,从化学走向应用”;
● 从单一的物质中心模式到多样化地学习模式;
● 强调“元素观”、“分类观”、“转化观”显著的变化 硫和含硫化合物的相互转化在新课程教材中作为一个
专门的知识体系来学习。2、三套必修教材中关于硫、氮元素及化合物内容的处理3、知识的前后联系(1)与初中科学的联系● 说出空气的主要成分;
● 列举空气中污染物的主要来源、防治方法和空气质量指数的主要内容,学会调查当地酸雨情况以及对农作物和建筑物的影响;
● 接触过硫酸,知道硫酸具有酸的通性,并了解了一些浓硫酸的特性;
● 能举例说明酸和碱在日常生活中的用途和对人类的影响,会测定溶液的酸碱性,了解强酸的使用注意事项。 (2)与化学1及后续模块中的联系四、课时分配建议五、教学设计与实施应注意的几个问题:1、发挥教材各栏目功能,树立现代教学观2、准确把握知识的深广度,避免随意扩展内容第一单元:含硫化合物的性质和应用
基本要求:
(1)了解硫的主要性质,认识二氧化硫的主要性质。
(2)实验探究硫酸型酸雨的形成过程,了解二氧化硫对空气污染的污染,知道硫酸型酸雨的形成原因和防治办法,形成良好的环保意识。
(3)知道工业上生产硫酸的基本原理,认识浓硫酸的特性,了解硫酸的应用。
发展要求:形成硫及其化合物相互转化的知识网络。说明: (1)硫单质的性质
硫元素在自然界中的存在形态,单质硫的颜色状态、硫与金属(主要是汞)和非金属(主要是氧气)反应属于基本要求。
硫与其他金属(如Na、Fe、Cu)的反应,硫与其他非金属(如H2)反应属于发展要求。
硫与碱溶液反应不作要求。(2)二氧化硫性质与作用●酸性氧化物的通性:从物质分类的角度认识二氧化硫的化学性质,知道二氧化硫与水、碱性氧化物(如CaO)和碱[如Ca(OH)2]等反应。●还原性和氧化性:从硫元素化合价认识二氧化硫的氧化性和还原性,其中还原性仅限于SO2(或H2SO3)与过氧化氢、氯水、溴水或碘水的反应;与酸性高锰酸钾溶液的反应不属基本要求。氧化性只要求学生知道这是中间价态的特点,不要例举某些反应(如与硫化氢的反应)。
● “资料卡” 栏目中“燃煤烟气脱硫”,为酸雨的防治提供信息资料属基本要求。
“调查研究”栏目中内容可以作为研究性学习的课题。(3)硫酸的制备和性质●硫酸的制备重点是让学生形成不同价态的硫元素的转化。
●硫酸制备的流程图可以看成是一个背景材料,目的是:
①不同价态硫元素的转化S(FeS2)→SO2→SO3→H2SO4;
②理论上的化学反应与实际工业生产不同这样的事实。
●基本要求是三个主要设备中所对应的三个反应原理。
发展要求还可以讨论流程中的“净化”、“热交换器”、“储酸槽”等问题。《化学与技术》模块中详细学习。
●硫铁矿在沸腾炉中燃烧生成二氧化硫的反应方程式不要求学生掌握配平方法,但要求知道铁、硫元素的价态,以及被氧化的事实。(4)硫酸盐●知道几种重要的硫酸盐 (5)硫和含硫化合物的相互转化 ●二氧化硫、硫化氢的实验室制备只要求知道反应原理、会书写化学反应方程式,实验室制备装置不作要求。
● H2S → S的转化,只要求硫化氢溶液与氯水反应的转化关系,不宜拓展硫化氢在氧气不足和足量条件下的燃烧反应及计算。
第二单元:生产生活中的含氮化合物基本要求:
(1)认识氮氧化物的性质,了解氨和铵盐、硝酸的性质和用途,知道含氮化合物的应用对社会生产的作用和对自然环境的影响。
(2)通过对含氮化合物性质实验的探究,让学生体验实验探究的过程与乐趣。
(3)了解氨的合成对氮肥生产的促进作用,知道氮肥的性质,认识到科学使用氮肥的意义。
发展要求:
(1)形成氮及其化合物相互转化的知识网络。
(2)全面系统地了解元素化合物知识,形成元素化合物知识网络。
说明:(1)氮氧化物的产生与转化(教学关键)●教材中没有专门设置“氮气”一节内容,但“有关氮气的性质和应用”作了分散学习。
●教材中图4-12 氮气与氧气放电实验,实验时间较长(需10多分钟),实验效果不理想。有条件的学校尽可能作演示实验,没有条件的学校可以播放录像。氮气和氧气反应.MPEG
● 不宜拓展NO2和N2O4的相互转化。
● NOx、O2溶于水的计算只要求简单计算,涉及范围、函数的计算不作要求。(2)氮肥的生产和使用●N2和O2的反应需“放电”的条件,N2和H2的反应需要“高温、高压、催化剂”的条件,说明氮气的稳定的事实,不需用氮气分子结构来解释。
●氨气的实验室制法需掌握反应原理。
在做《实验2》的同时简要介绍实验室制取氨气的发生装置、收集方法、验满等(发展要求)。(3)硝酸的性质●硝酸氧化性的重点:浓、稀硝酸与铜的反应,以及浓硝酸与炭的反应,不宜拓展硝酸与活泼金属反应的还原规律。
●不易过多拓展铜与浓、稀硝酸反应的有关较复杂的定量计算。
●硝酸工业制法的教学要求与硫酸工业制法的要求相同。3、结合其他相关知识,形成无机化合物知识体系
(强化氧化还原的相关知识)4、重新看待实验室制法,避免运用老教材的教学惯性 苏教版《化学1》p.94
写出下列含硫物质转化的化学方程式
◆工业上或实验室用亚硫酸钠与浓硫酸反应制备二氧化硫。
◆实验室用稀硫酸和硫化亚铁反应,制备少量的硫化氢(H2S)气体。
◆【实验2】p.99将少量氯化铵晶体与少量氢氧化钙混合后放入试管中,在酒精灯火焰上微热,用湿润的红色石蕊试纸检验反应产生的气体。不同版本教材对实验室制法的处理苏教版《化学1》(p.40)用浓盐酸与二氧化锰反应制备氯气的实验室装置需掌握。但对反应原理及方程式要求都淡化处理,将此放入“化学史话”中。
新课程人教版《化学1》实验室制氨气有具体的实验要求,氯气的实验室制法却没有要求。
新课程鲁科版《化学1》在实验室常用氯化铵和氢氧化钙反应制少量氨气,用向下排空气法收集并用湿润的红色石蕊试纸检验氨气是否收集满。但没有具体实验要求。
原初中《自然》中实验室用KClO3和MnO2混合加热制氧气
现初中《科学》中在MnO2中滴加双氧水制氧气。氢气、二氧化碳的实验室制法只要求反应原理,没有具体的实验装置和实验要求。5、对教材中几个实验的考虑:(1)P88 SO2化学性质的探究【实验2 】 SO2与品红(浓度宜低些)的反应:(2)利用生活中的火柴头燃烧产生SO2演示SO2的性质:SO2与碘水的反应:
取一只小锥形瓶,注入5-10毫升水和两滴碘酒,得到茶色的碘溶液。加入一滴淀粉试液后变蓝。
取2-3根火柴,划燃后迅速插入锥形瓶,等火药燃尽后取出火柴,塞上瓶塞,振荡,锥形瓶内溶液即变为无色。
(与紫色石蕊试液、澄清石灰水、酸性高锰酸钾(稀)方法类似。)(3)浓硫酸的脱水性实验 教材P91 【实验2】
①在研细的蔗糖(约2克)中先加入少量水(可加速浓硫酸
的脱水作用),用玻璃棒调成糊状,再加入4ml左右的98℅
的浓硫酸,迅速搅拌;
②快速塞上带玻璃导管的橡皮塞,将导管另一端插入盛有
品红的试管中。
(4)浓硫酸与铜的反应实验 教材P92 【实验3】可将铜片改为底端螺旋状的粗铜丝,
铜丝上端通过橡皮塞,可自由升降,便于控制反应。
该反应现象较为复杂,不宜对学生作过多解释。(5)氨气的制备和性质 ①在注射器中加少量铜片(注意尽量除尽空气),然后吸入1ml稀硝酸,用橡胶封住。(可观察铜与稀硝酸的反应,产生无色气泡,溶液由无色变蓝色)
②压出溶液,吸入少量空气。(可观察到无色气体变成红棕色(NO被氧化为NO2))
③再吸入少量水。(红棕色气体又消失了(NO2溶于水);
④最后,吸取足量的空气,将液体和气体全部注入到NaOH溶液中(氮氧化物被NaOH溶液充分吸收)。(6)铜片稀硝酸的反应 (1)在烟道气脱硫制石膏的过程中,中间产物是亚硫酸氢钠。调节烟道气排放的流量,以取得二氧化硫与氢氧化钠间物质的量的最佳比值,从而提高亚硫酸氢钠的产量。现设n(SO2)、n(NaOH)、n(NaHSO3)分别表示二氧化硫、氢氧化钠、亚硫酸氢钠的物质的量,且n(SO2)/n(NaOH) = x,试写出x在不同取值范围时,n(NaHSO4)的值或n(NaHSO3)与n(SO2)、n(NaOH)间的关系。6、加强对习题的研究,摆脱教辅资料的牵制 教辅资料上常见这样的习题,这种习题难度过大,且主要
难在数学处理上,不作要求。(2)同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是①NO和NO2,②NO2和O2,③NH3和N2。现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体的体积分别为V1、V2、V3,则下列关系正确的是( )
A. V1>V2>V3 B. V1>V3>V2
C. V2>V3>V1 D. V3>V1>V2
14g铜、银合金与一定量某浓度的硝酸溶液完全反应,将放出的气体与1.12L(标准状况下)氧气混合通入水中,恰好全部被水吸收,求合金中铜的质量分数?
难度过大,少做或暂时不作这样的题目,或者到高三复习期间做
将VmL NO和NO2的混合气体通过水吸收后,得到a mL无色气体A,将此无色气体A与等体积O2混合,再通过水充分吸收后,收集到5mL无色气体B。试回答:
①A气体是_____、B气体是____。 ②A气体的体积是____mL。
③V值的取值范围为_________。
不做这样的题目由于数学处理量较大,不宜让学生做六、案例:酸雨与二氧化硫1、核心问题:
(1)硫酸型酸雨的形成原因是什么?
(2)二氧化硫有哪些主要性质?
(3)如何恰如其分地评价SO2对人类的影响?3、教学思路
A : 以“酸雨”为背景,“探究硫酸型酸雨形成的原因”为主线,涉及系列探究活动,激发学生探究热情,拓展学生的视野,让学生在“发现问题——提出问题——解决问题——归纳知识、提炼方法——再解决问题”的过程中体会科学探究的一般方法。测定于雨水的pH设想形成酸雨的可能因素实验探究硫酸型酸雨的形成过程归纳总结酸雨的形成讨论防止硫酸型酸雨对环境产生的危害讨论、归纳SO2的化学性质情景1 常见酸雨的成分情景2 硫酸型酸雨的形成情景3 SO2的化学性质(1)情景4 SO2的化学性质(2)情景5 脱硫技术对环境保护的展望化学,与变化着的世界相联系……
请大家批评指正,谢谢! 《二氧化硫》教学设计教学目标:
1、根据课程标准“关注人类面临的与化学相关的社会问题,培养学生的社会责任感、参与意识和决策能力”的要求,加强环境教育帮助学生了解二氧化硫污染环境的原因,正确认识环境和环境问题形成参与解决环境问题的意识。
2、认识二氧化硫的主要性质和应用。核心知识:二氧化硫与水、氧气的反应、酸雨对环境的污染。教学思路:教学过程:一、初识SO2引入:你对SO2知多少?学生活动:(课前收集资料)开课时进行3分钟演讲,总结:
危害人体健康;
对大气造成污染(空气质量指标);
酸雨;
漂白性被不法商人利用。二、研究SO21、怎样得到SO2?设计意图:通过了解SO2对环境和人体的危害,引起学生的忧患意识和求知欲望。设计意图:学会应用氧化还原原理,
学会类比推理。学生大胆猜想,师生共同作出分析、评价2、 SO2有哪些性质?
研究方法(核心部分)(1)作为酸性氧化物(与CO2对比分析)
从物质分类角度认识
(2)作为S的中间价态的物质 从氧化还原的角度认识
(3)漂白性(与氯水的漂白性作比较)
从特性的角度认识 设计意图:学会研究物质的基本方法,学会应用
氧化还原的知识解决未知问题,学会从实验现象分析
问题本质,学会将化学与生活联系。三、讨论 :二氧化硫如何形成酸雨?酸雨有何危害? 已知二氧化硫在氧气和水作用下形成酸雨,使雨水
PH值<5.6。
引导学生从两种途径分析:
①SO2 + H2O H2SO3 2H2SO3 + O2 = 2H2SO4
②2 SO2 + O2 2SO3 SO3 + H2O = H2SO4
设计意图:巩固本节知识要点——二氧化硫与水、氧气
反应,知道二氧化硫如何形成酸雨造成危害,并将危害
与身边的环境联系起来。实验:模拟“花儿遭遇酸雨”
将黄菊花、红玫瑰、绿叶分别浸入亚硫酸溶液中。四、同一首歌:保护地球,保护我们生存的环境 设计意图:做到学以致用。增强参与环保的意识和
决策能力,充分认识到保护环境是全民的共同目标。学生活动:分角色扮演活动
(1)假如你是一位农场主,如何面对酸雨的侵蚀?
(2)假如你是一位硫酸厂的工程师?
(3)假如你是一位环保局长?… …五、学生课外开展研究性学习:
硫酸厂附近SO2的污染状况及防治措施。
(1)学习常见的化学物质,……了解它们在生产、生活和
化学研究中的应用。
(2)学习必要的化学实验技能,体验化学和了解化学科学
研究的一般过程和方法。
(3)正确认识科学和技术与社会的相互关系,能运用所学
知识解释生产、生活中的化学现象,解决与化学有关的一些
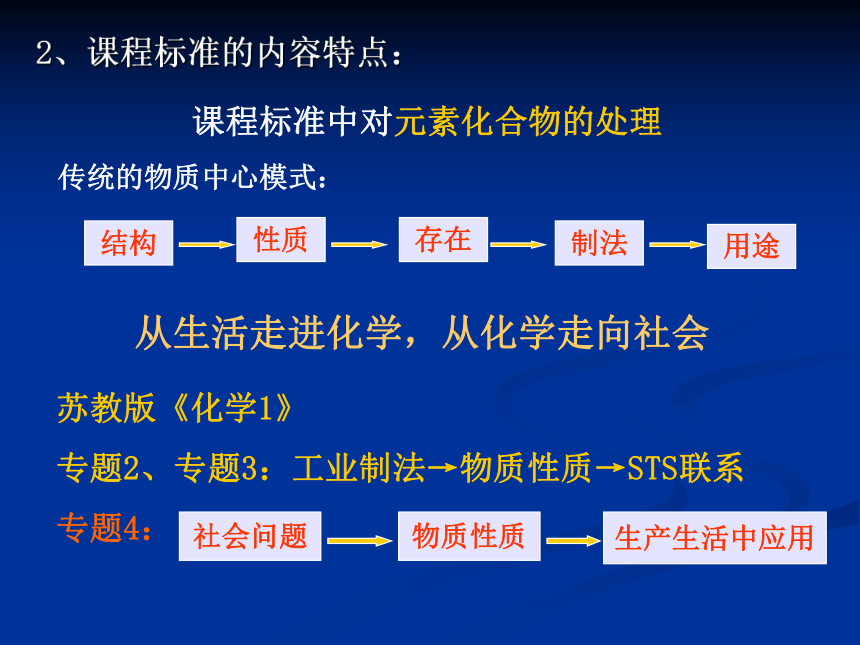
实际问题,树立社会可持续发展的思想。一、对新课程标准的理解主题3 常见无机物及其应用2、课程标准的内容特点:苏教版《化学1》
专题2、专题3:工业制法→物质性质→STS联系
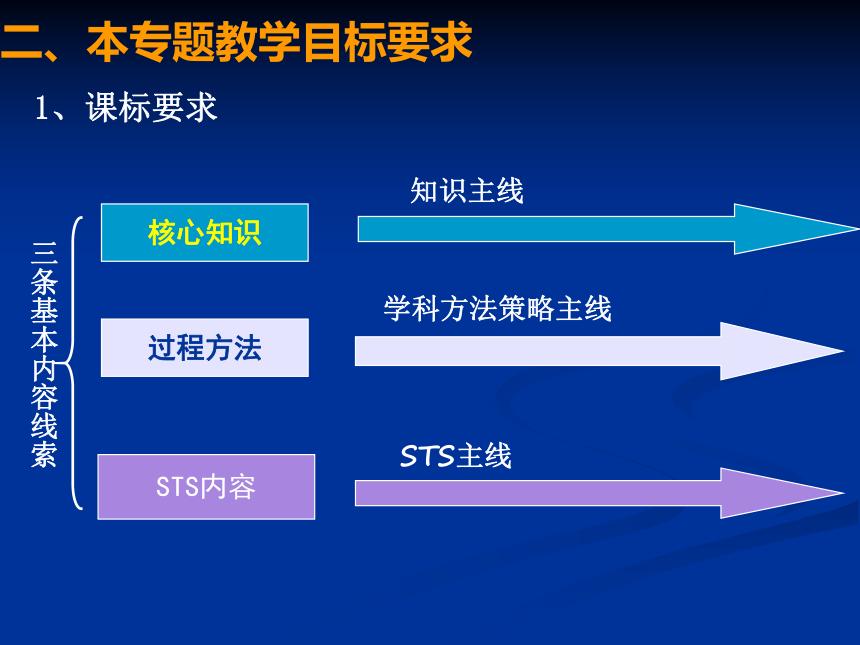
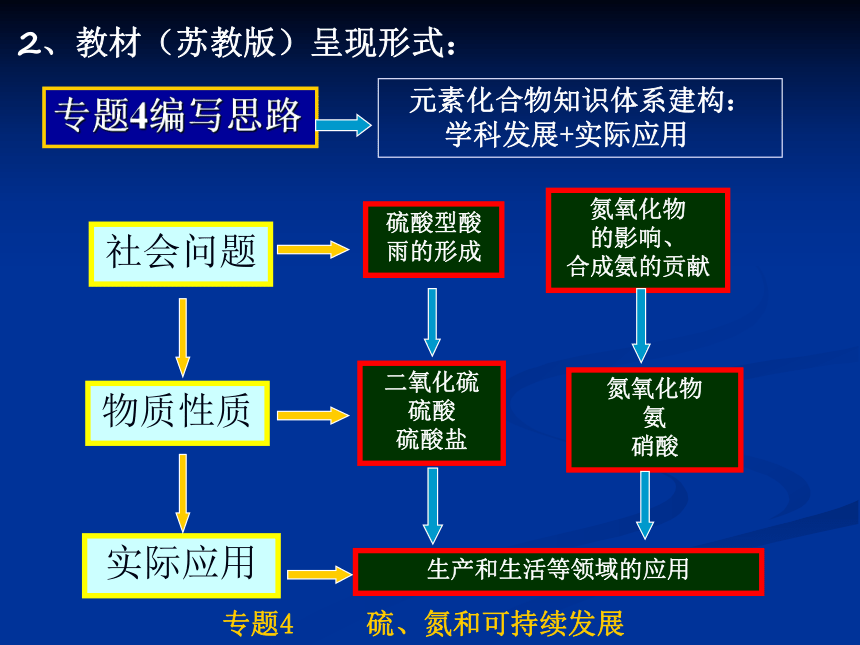
专题4: 课程标准中对元素化合物的处理从生活走进化学,从化学走向社会 传统的物质中心模式:核心知识过程方法STS内容二、本专题教学目标要求1、课标要求知识主线学科方法策略主线STS主线三条基本内容线索专题4 硫、氮和可持续发展2、教材(苏教版)呈现形式:专题4 硫、氮和可持续发展 第一单元 含硫化合物的性质和应用
酸雨的形成与危害、二氧化硫性质
硫酸的制备和性质(浓硫酸的氧化性等)、常见的硫酸盐
硫元素不同价态之间的转化
第二单元 生产生活中的含氮化合物
氮氧化物的形成和性质
氮肥工业、氨的制取和性质、铵盐
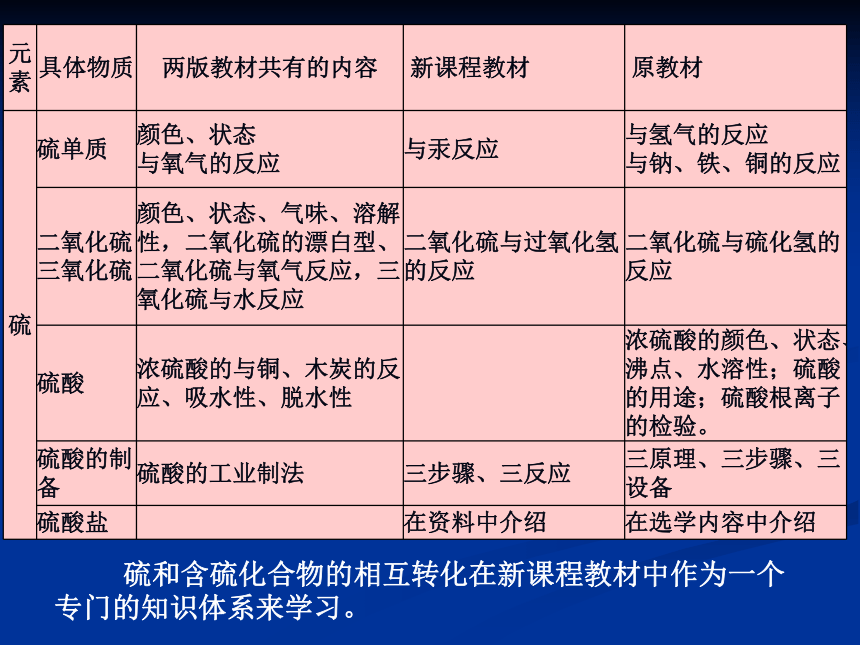
硝酸的性质、应用及制备3、教学目标(核心知识)三、教材知识比较及衔接分析1、新课程教材与原教材的比较 元素化合物知识在内容覆盖上差别不大,内容的组织
线索、具体化合物知识内容的选取、内容处理的深广度有
较大变化。● 不再分“律前元素”和“律后元素”;
● 不再“跑族”;
● 从“生活走进化学,从化学走向社会”;“从自然走进化学,从化学走向应用”;
● 从单一的物质中心模式到多样化地学习模式;
● 强调“元素观”、“分类观”、“转化观”显著的变化 硫和含硫化合物的相互转化在新课程教材中作为一个
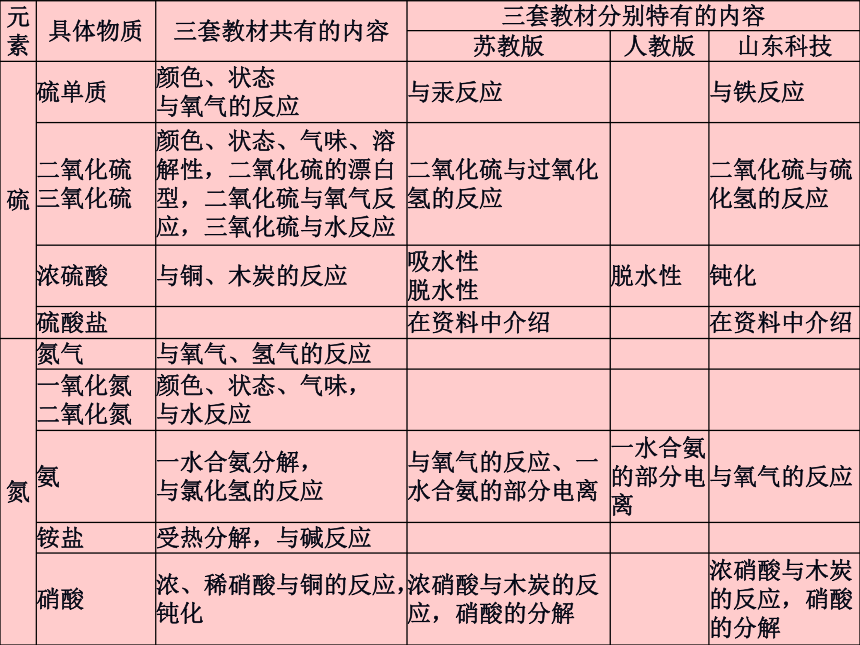
专门的知识体系来学习。2、三套必修教材中关于硫、氮元素及化合物内容的处理3、知识的前后联系(1)与初中科学的联系● 说出空气的主要成分;
● 列举空气中污染物的主要来源、防治方法和空气质量指数的主要内容,学会调查当地酸雨情况以及对农作物和建筑物的影响;
● 接触过硫酸,知道硫酸具有酸的通性,并了解了一些浓硫酸的特性;
● 能举例说明酸和碱在日常生活中的用途和对人类的影响,会测定溶液的酸碱性,了解强酸的使用注意事项。 (2)与化学1及后续模块中的联系四、课时分配建议五、教学设计与实施应注意的几个问题:1、发挥教材各栏目功能,树立现代教学观2、准确把握知识的深广度,避免随意扩展内容第一单元:含硫化合物的性质和应用
基本要求:
(1)了解硫的主要性质,认识二氧化硫的主要性质。
(2)实验探究硫酸型酸雨的形成过程,了解二氧化硫对空气污染的污染,知道硫酸型酸雨的形成原因和防治办法,形成良好的环保意识。
(3)知道工业上生产硫酸的基本原理,认识浓硫酸的特性,了解硫酸的应用。
发展要求:形成硫及其化合物相互转化的知识网络。说明: (1)硫单质的性质
硫元素在自然界中的存在形态,单质硫的颜色状态、硫与金属(主要是汞)和非金属(主要是氧气)反应属于基本要求。
硫与其他金属(如Na、Fe、Cu)的反应,硫与其他非金属(如H2)反应属于发展要求。
硫与碱溶液反应不作要求。(2)二氧化硫性质与作用●酸性氧化物的通性:从物质分类的角度认识二氧化硫的化学性质,知道二氧化硫与水、碱性氧化物(如CaO)和碱[如Ca(OH)2]等反应。●还原性和氧化性:从硫元素化合价认识二氧化硫的氧化性和还原性,其中还原性仅限于SO2(或H2SO3)与过氧化氢、氯水、溴水或碘水的反应;与酸性高锰酸钾溶液的反应不属基本要求。氧化性只要求学生知道这是中间价态的特点,不要例举某些反应(如与硫化氢的反应)。
● “资料卡” 栏目中“燃煤烟气脱硫”,为酸雨的防治提供信息资料属基本要求。
“调查研究”栏目中内容可以作为研究性学习的课题。(3)硫酸的制备和性质●硫酸的制备重点是让学生形成不同价态的硫元素的转化。
●硫酸制备的流程图可以看成是一个背景材料,目的是:
①不同价态硫元素的转化S(FeS2)→SO2→SO3→H2SO4;
②理论上的化学反应与实际工业生产不同这样的事实。
●基本要求是三个主要设备中所对应的三个反应原理。
发展要求还可以讨论流程中的“净化”、“热交换器”、“储酸槽”等问题。《化学与技术》模块中详细学习。
●硫铁矿在沸腾炉中燃烧生成二氧化硫的反应方程式不要求学生掌握配平方法,但要求知道铁、硫元素的价态,以及被氧化的事实。(4)硫酸盐●知道几种重要的硫酸盐 (5)硫和含硫化合物的相互转化 ●二氧化硫、硫化氢的实验室制备只要求知道反应原理、会书写化学反应方程式,实验室制备装置不作要求。
● H2S → S的转化,只要求硫化氢溶液与氯水反应的转化关系,不宜拓展硫化氢在氧气不足和足量条件下的燃烧反应及计算。
第二单元:生产生活中的含氮化合物基本要求:
(1)认识氮氧化物的性质,了解氨和铵盐、硝酸的性质和用途,知道含氮化合物的应用对社会生产的作用和对自然环境的影响。
(2)通过对含氮化合物性质实验的探究,让学生体验实验探究的过程与乐趣。
(3)了解氨的合成对氮肥生产的促进作用,知道氮肥的性质,认识到科学使用氮肥的意义。
发展要求:
(1)形成氮及其化合物相互转化的知识网络。
(2)全面系统地了解元素化合物知识,形成元素化合物知识网络。
说明:(1)氮氧化物的产生与转化(教学关键)●教材中没有专门设置“氮气”一节内容,但“有关氮气的性质和应用”作了分散学习。
●教材中图4-12 氮气与氧气放电实验,实验时间较长(需10多分钟),实验效果不理想。有条件的学校尽可能作演示实验,没有条件的学校可以播放录像。氮气和氧气反应.MPEG
● 不宜拓展NO2和N2O4的相互转化。
● NOx、O2溶于水的计算只要求简单计算,涉及范围、函数的计算不作要求。(2)氮肥的生产和使用●N2和O2的反应需“放电”的条件,N2和H2的反应需要“高温、高压、催化剂”的条件,说明氮气的稳定的事实,不需用氮气分子结构来解释。
●氨气的实验室制法需掌握反应原理。
在做《实验2》的同时简要介绍实验室制取氨气的发生装置、收集方法、验满等(发展要求)。(3)硝酸的性质●硝酸氧化性的重点:浓、稀硝酸与铜的反应,以及浓硝酸与炭的反应,不宜拓展硝酸与活泼金属反应的还原规律。
●不易过多拓展铜与浓、稀硝酸反应的有关较复杂的定量计算。
●硝酸工业制法的教学要求与硫酸工业制法的要求相同。3、结合其他相关知识,形成无机化合物知识体系
(强化氧化还原的相关知识)4、重新看待实验室制法,避免运用老教材的教学惯性 苏教版《化学1》p.94
写出下列含硫物质转化的化学方程式
◆工业上或实验室用亚硫酸钠与浓硫酸反应制备二氧化硫。
◆实验室用稀硫酸和硫化亚铁反应,制备少量的硫化氢(H2S)气体。
◆【实验2】p.99将少量氯化铵晶体与少量氢氧化钙混合后放入试管中,在酒精灯火焰上微热,用湿润的红色石蕊试纸检验反应产生的气体。不同版本教材对实验室制法的处理苏教版《化学1》(p.40)用浓盐酸与二氧化锰反应制备氯气的实验室装置需掌握。但对反应原理及方程式要求都淡化处理,将此放入“化学史话”中。
新课程人教版《化学1》实验室制氨气有具体的实验要求,氯气的实验室制法却没有要求。
新课程鲁科版《化学1》在实验室常用氯化铵和氢氧化钙反应制少量氨气,用向下排空气法收集并用湿润的红色石蕊试纸检验氨气是否收集满。但没有具体实验要求。
原初中《自然》中实验室用KClO3和MnO2混合加热制氧气
现初中《科学》中在MnO2中滴加双氧水制氧气。氢气、二氧化碳的实验室制法只要求反应原理,没有具体的实验装置和实验要求。5、对教材中几个实验的考虑:(1)P88 SO2化学性质的探究【实验2 】 SO2与品红(浓度宜低些)的反应:(2)利用生活中的火柴头燃烧产生SO2演示SO2的性质:SO2与碘水的反应:
取一只小锥形瓶,注入5-10毫升水和两滴碘酒,得到茶色的碘溶液。加入一滴淀粉试液后变蓝。
取2-3根火柴,划燃后迅速插入锥形瓶,等火药燃尽后取出火柴,塞上瓶塞,振荡,锥形瓶内溶液即变为无色。
(与紫色石蕊试液、澄清石灰水、酸性高锰酸钾(稀)方法类似。)(3)浓硫酸的脱水性实验 教材P91 【实验2】
①在研细的蔗糖(约2克)中先加入少量水(可加速浓硫酸
的脱水作用),用玻璃棒调成糊状,再加入4ml左右的98℅
的浓硫酸,迅速搅拌;
②快速塞上带玻璃导管的橡皮塞,将导管另一端插入盛有
品红的试管中。
(4)浓硫酸与铜的反应实验 教材P92 【实验3】可将铜片改为底端螺旋状的粗铜丝,
铜丝上端通过橡皮塞,可自由升降,便于控制反应。
该反应现象较为复杂,不宜对学生作过多解释。(5)氨气的制备和性质 ①在注射器中加少量铜片(注意尽量除尽空气),然后吸入1ml稀硝酸,用橡胶封住。(可观察铜与稀硝酸的反应,产生无色气泡,溶液由无色变蓝色)
②压出溶液,吸入少量空气。(可观察到无色气体变成红棕色(NO被氧化为NO2))
③再吸入少量水。(红棕色气体又消失了(NO2溶于水);
④最后,吸取足量的空气,将液体和气体全部注入到NaOH溶液中(氮氧化物被NaOH溶液充分吸收)。(6)铜片稀硝酸的反应 (1)在烟道气脱硫制石膏的过程中,中间产物是亚硫酸氢钠。调节烟道气排放的流量,以取得二氧化硫与氢氧化钠间物质的量的最佳比值,从而提高亚硫酸氢钠的产量。现设n(SO2)、n(NaOH)、n(NaHSO3)分别表示二氧化硫、氢氧化钠、亚硫酸氢钠的物质的量,且n(SO2)/n(NaOH) = x,试写出x在不同取值范围时,n(NaHSO4)的值或n(NaHSO3)与n(SO2)、n(NaOH)间的关系。6、加强对习题的研究,摆脱教辅资料的牵制 教辅资料上常见这样的习题,这种习题难度过大,且主要
难在数学处理上,不作要求。(2)同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是①NO和NO2,②NO2和O2,③NH3和N2。现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体的体积分别为V1、V2、V3,则下列关系正确的是( )
A. V1>V2>V3 B. V1>V3>V2
C. V2>V3>V1 D. V3>V1>V2
14g铜、银合金与一定量某浓度的硝酸溶液完全反应,将放出的气体与1.12L(标准状况下)氧气混合通入水中,恰好全部被水吸收,求合金中铜的质量分数?
难度过大,少做或暂时不作这样的题目,或者到高三复习期间做
将VmL NO和NO2的混合气体通过水吸收后,得到a mL无色气体A,将此无色气体A与等体积O2混合,再通过水充分吸收后,收集到5mL无色气体B。试回答:
①A气体是_____、B气体是____。 ②A气体的体积是____mL。
③V值的取值范围为_________。
不做这样的题目由于数学处理量较大,不宜让学生做六、案例:酸雨与二氧化硫1、核心问题:
(1)硫酸型酸雨的形成原因是什么?
(2)二氧化硫有哪些主要性质?
(3)如何恰如其分地评价SO2对人类的影响?3、教学思路
A : 以“酸雨”为背景,“探究硫酸型酸雨形成的原因”为主线,涉及系列探究活动,激发学生探究热情,拓展学生的视野,让学生在“发现问题——提出问题——解决问题——归纳知识、提炼方法——再解决问题”的过程中体会科学探究的一般方法。测定于雨水的pH设想形成酸雨的可能因素实验探究硫酸型酸雨的形成过程归纳总结酸雨的形成讨论防止硫酸型酸雨对环境产生的危害讨论、归纳SO2的化学性质情景1 常见酸雨的成分情景2 硫酸型酸雨的形成情景3 SO2的化学性质(1)情景4 SO2的化学性质(2)情景5 脱硫技术对环境保护的展望化学,与变化着的世界相联系……
请大家批评指正,谢谢! 《二氧化硫》教学设计教学目标:
1、根据课程标准“关注人类面临的与化学相关的社会问题,培养学生的社会责任感、参与意识和决策能力”的要求,加强环境教育帮助学生了解二氧化硫污染环境的原因,正确认识环境和环境问题形成参与解决环境问题的意识。
2、认识二氧化硫的主要性质和应用。核心知识:二氧化硫与水、氧气的反应、酸雨对环境的污染。教学思路:教学过程:一、初识SO2引入:你对SO2知多少?学生活动:(课前收集资料)开课时进行3分钟演讲,总结:
危害人体健康;
对大气造成污染(空气质量指标);
酸雨;
漂白性被不法商人利用。二、研究SO21、怎样得到SO2?设计意图:通过了解SO2对环境和人体的危害,引起学生的忧患意识和求知欲望。设计意图:学会应用氧化还原原理,
学会类比推理。学生大胆猜想,师生共同作出分析、评价2、 SO2有哪些性质?
研究方法(核心部分)(1)作为酸性氧化物(与CO2对比分析)
从物质分类角度认识
(2)作为S的中间价态的物质 从氧化还原的角度认识
(3)漂白性(与氯水的漂白性作比较)
从特性的角度认识 设计意图:学会研究物质的基本方法,学会应用
氧化还原的知识解决未知问题,学会从实验现象分析
问题本质,学会将化学与生活联系。三、讨论 :二氧化硫如何形成酸雨?酸雨有何危害? 已知二氧化硫在氧气和水作用下形成酸雨,使雨水
PH值<5.6。
引导学生从两种途径分析:
①SO2 + H2O H2SO3 2H2SO3 + O2 = 2H2SO4
②2 SO2 + O2 2SO3 SO3 + H2O = H2SO4
设计意图:巩固本节知识要点——二氧化硫与水、氧气
反应,知道二氧化硫如何形成酸雨造成危害,并将危害
与身边的环境联系起来。实验:模拟“花儿遭遇酸雨”
将黄菊花、红玫瑰、绿叶分别浸入亚硫酸溶液中。四、同一首歌:保护地球,保护我们生存的环境 设计意图:做到学以致用。增强参与环保的意识和
决策能力,充分认识到保护环境是全民的共同目标。学生活动:分角色扮演活动
(1)假如你是一位农场主,如何面对酸雨的侵蚀?
(2)假如你是一位硫酸厂的工程师?
(3)假如你是一位环保局长?… …五、学生课外开展研究性学习:
硫酸厂附近SO2的污染状况及防治措施。
