物质的量[上学期]
图片预览






文档简介
(共17张PPT)
反应中能否取2个H2和1个O2反应?在实际操作中是如何取用的?
宏观物质的量与微观粒子的量存在着联系:
请写出H2在氧气中点燃的化学方程式
从微观角度分析,该反应式表达了分子间怎样的数量关系?
宏观物质是由许多微观粒子形成的一个集体
1滴水大约有6 1020个水
分子,若取1mL,1L……数值
更大
能否在宏观(可测)量与微观量之间建立一个物理量和单位,用合适的数值表示很大数目的微观粒子
联系生活,类比借鉴
日常生活中,当某物质的质量很大时,一般不会用两或克表示,而用吨等更大的计量单位表示,如一辆汽车的质量为3吨,不会说是 3×106克。再如做某事化去10分钟时间,我们不会说成是用了1.9 ×10-5年。人们喜欢选用一个合适的计量单位,把很大或很小的数值变为适中,利于计算、使用
提出创新性设想
问题的产生
宏观的量用微观表示非常的巨大,使用不方便
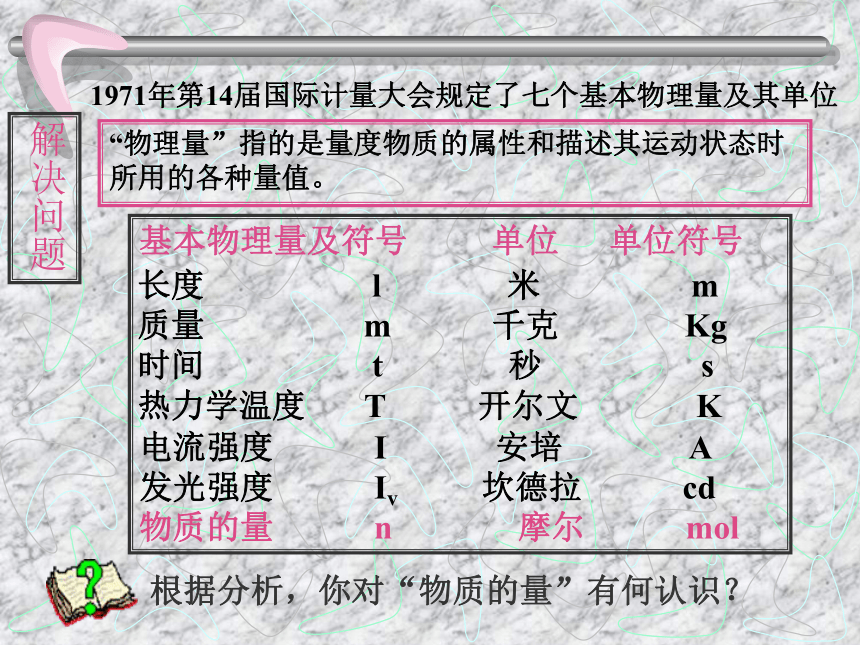
1971年第14届国际计量大会规定了七个基本物理量及其单位
“物理量”指的是量度物质的属性和描述其运动状态时所用的各种量值。
基本物理量及符号 单位 单位符号
电流强度 I 安培 A
发光强度 Iv 坎德拉 cd
长度 l 米 m
质量 m 千克 Kg
时间 t 秒 s
热力学温度 T 开尔文 K
物质的量 n 摩尔 mol
根据分析,你对“物质的量”有何认识?
解决问题
对“物质的量”理解
能否把“物质的量”说成是物质的质量或物质的数量?
“物质的量”是专有名词,不能随意拆开
物质的量所表示的对象是什么?
“粒子”指具体的微观粒子(分子、原子、离子、质子、中子、电子以及它们的特定组合比如:NaCl)
一定数目的“集体”可以是5个、10个微粒组成吗?
“集体”是由许多固定数目的微粒组成
讨论:
对“摩尔”的理解
物质的量与摩尔是什么关系?
摩尔是物质的量的单位
比较其它的基本计量单位,它是否有其倍数单位?
摩尔存在它的倍数单位
1 Mmol=103 kmol=106mol
1 kmol=103 mol
1 mol=103 mmol
摩尔量度的对象是什么?
为微观六子及其特定组合,不能是宏观物质
使用时最好用化学式指明具体粒子的种类以防歧异
米:光在真空中 s的时间间隔内所进行的路程的长度为1 m。
千克:国际千克原器是1889年第一届国际权度大会批准制造的。它是一个高度和直径均为39mm的,用铂铱合金制成的圆柱体。原型保存在巴黎国际计量局。
………………
摩尔:0.012kg 12C的原子数目为1摩尔。—— 如果在一定量的粒子集体中所含粒子与0.012kg 12C的原子数目相同即为1摩尔。
基本物理量的单位需要统一的度量衡
讨论:
摩尔的基准物为什么选12C?
这是一种人为的巧合,这种统一的美给以后的计算带来极大的方便
为什么用12g12C的原子数目作基准,而不用1g 12C?
相对原子质量的标准物质与摩尔的基准物质都选用12C。
12C的相对原子质量为12,因此定义1mol选用12g12C所含原子数
对摩尔基准物的选取
对“阿伏加德罗常数(NA)”的理解
计算:已知 一个12C质量为1.993 10-23g ,求
12克12C含多少个原子
12g
6.02 1023
==
1.993 10-23g
数值巨大
6.02 1023mol-1就是阿伏加德罗常数吗?
NA的基准值为:12克12C所含的原子数目(定义时用)
近似值为:6.02 1023mol-1(计算时用)
讨论:NA与12克12C中所含碳原子数 的关系
12克12C中所含碳原子数= NA =1mol任何粒子的粒子数
物质的量(n) 微粒的数量(N)
NA
思考:
1、1mol碳原子含_____________个碳原子
2 、1mol氢分子含有____________个氢分子
3、1mol液态水中含有______________个水分子
6.02 1023
6.02 1023
6.02 1023
讨论:
物质的量与微粒数之间如何换算?
物质所含的微粒数与其状态有无关系?与什么有关?
4、0.5 molCO2_____________个CO2
5、1. 204 1023 个HCl分子物质的量为____mol
3.01 1023
0.2
两种物质的微粒数之比 == 物质的量之比
(与物质的状态无关)
物质的量(摩) ==
微粒数(个)
阿伏加德罗常数(个/摩)
物质的量与粒子数之间换算
微粒的数量 物质的量
NA
NA
1、1mol H2O含有_______个分子,有________个氢原子, 有________个O,含有________质子,_______个电子
3、下列物质中含分子数目由大到小顺序为__________
A.0.5molO2 B. 6.02 1023个N2
C.6.02 1024个HCl
D.与0.12kg12C含相同原子数目的Cl2
4、0.1molH2O中与_____molCO2所含的氧原子数目相同,与__________个CH4分子中所含的氢原子数相同
深化应用:
6.02 1023
1.204 1024
6.02 1023
6.02 1024
6.02 1024
6.02 1022
6.02 1022
D>C>B>A
0.05
3.01 1022
2、0.1molNaOH能电离出______个Na+,______个OH-
物质的量
知识小结:
基准:NA
1、衡量物质所含微粒数多少
2、专有名词,不能随意拆开
3、对象为微观粒子及其特定组合
单位:摩尔
1、是基本物理量的单位
2、量度对象具体微观粒子及其特定组合
3、使用时用化学式指明粒子的种类
1、准确值:12g12C所含原子数
近似值: 6.02 1023
n=
NA
N
2、
=
N2
N1
n2
n1
基本物理量
判断下列说法是否正确,并加以说明理由
1、1mol苹果
不对,指代不明,可指氧原子也可指氧分子
对,特定组合
对,指氧原子
对
不对,不能指宏观物质
不对,元素是宏观概念,只能说种类
2、1molO
3、1mol氧
4、1molH2O
8、1mol钠元素
9、1molNaCl
5、1mole-
6、1mol质子
7、1molOH-
对
对
对
NA----一个惊人的数字
1 、将6.02 1023个一毛硬币排起来,可来
回地球和太阳间400亿次之多
2、如果1千克谷子有4万粒, 6.02 1023粒谷子有
1.505 1019千克,若按地球上有60亿人,人均
每年消耗500千克,可供全世界人用500万年。
1mol铁
6.02×
个原子
55.8克
7.1cm
3
1mol水
6.02×
个原子
18.0cm
3
1mol硫酸
54.1cm
3
6.02×
个原子
1mol的下列物质
反应中能否取2个H2和1个O2反应?在实际操作中是如何取用的?
宏观物质的量与微观粒子的量存在着联系:
请写出H2在氧气中点燃的化学方程式
从微观角度分析,该反应式表达了分子间怎样的数量关系?
宏观物质是由许多微观粒子形成的一个集体
1滴水大约有6 1020个水
分子,若取1mL,1L……数值
更大
能否在宏观(可测)量与微观量之间建立一个物理量和单位,用合适的数值表示很大数目的微观粒子
联系生活,类比借鉴
日常生活中,当某物质的质量很大时,一般不会用两或克表示,而用吨等更大的计量单位表示,如一辆汽车的质量为3吨,不会说是 3×106克。再如做某事化去10分钟时间,我们不会说成是用了1.9 ×10-5年。人们喜欢选用一个合适的计量单位,把很大或很小的数值变为适中,利于计算、使用
提出创新性设想
问题的产生
宏观的量用微观表示非常的巨大,使用不方便
1971年第14届国际计量大会规定了七个基本物理量及其单位
“物理量”指的是量度物质的属性和描述其运动状态时所用的各种量值。
基本物理量及符号 单位 单位符号
电流强度 I 安培 A
发光强度 Iv 坎德拉 cd
长度 l 米 m
质量 m 千克 Kg
时间 t 秒 s
热力学温度 T 开尔文 K
物质的量 n 摩尔 mol
根据分析,你对“物质的量”有何认识?
解决问题
对“物质的量”理解
能否把“物质的量”说成是物质的质量或物质的数量?
“物质的量”是专有名词,不能随意拆开
物质的量所表示的对象是什么?
“粒子”指具体的微观粒子(分子、原子、离子、质子、中子、电子以及它们的特定组合比如:NaCl)
一定数目的“集体”可以是5个、10个微粒组成吗?
“集体”是由许多固定数目的微粒组成
讨论:
对“摩尔”的理解
物质的量与摩尔是什么关系?
摩尔是物质的量的单位
比较其它的基本计量单位,它是否有其倍数单位?
摩尔存在它的倍数单位
1 Mmol=103 kmol=106mol
1 kmol=103 mol
1 mol=103 mmol
摩尔量度的对象是什么?
为微观六子及其特定组合,不能是宏观物质
使用时最好用化学式指明具体粒子的种类以防歧异
米:光在真空中 s的时间间隔内所进行的路程的长度为1 m。
千克:国际千克原器是1889年第一届国际权度大会批准制造的。它是一个高度和直径均为39mm的,用铂铱合金制成的圆柱体。原型保存在巴黎国际计量局。
………………
摩尔:0.012kg 12C的原子数目为1摩尔。—— 如果在一定量的粒子集体中所含粒子与0.012kg 12C的原子数目相同即为1摩尔。
基本物理量的单位需要统一的度量衡
讨论:
摩尔的基准物为什么选12C?
这是一种人为的巧合,这种统一的美给以后的计算带来极大的方便
为什么用12g12C的原子数目作基准,而不用1g 12C?
相对原子质量的标准物质与摩尔的基准物质都选用12C。
12C的相对原子质量为12,因此定义1mol选用12g12C所含原子数
对摩尔基准物的选取
对“阿伏加德罗常数(NA)”的理解
计算:已知 一个12C质量为1.993 10-23g ,求
12克12C含多少个原子
12g
6.02 1023
==
1.993 10-23g
数值巨大
6.02 1023mol-1就是阿伏加德罗常数吗?
NA的基准值为:12克12C所含的原子数目(定义时用)
近似值为:6.02 1023mol-1(计算时用)
讨论:NA与12克12C中所含碳原子数 的关系
12克12C中所含碳原子数= NA =1mol任何粒子的粒子数
物质的量(n) 微粒的数量(N)
NA
思考:
1、1mol碳原子含_____________个碳原子
2 、1mol氢分子含有____________个氢分子
3、1mol液态水中含有______________个水分子
6.02 1023
6.02 1023
6.02 1023
讨论:
物质的量与微粒数之间如何换算?
物质所含的微粒数与其状态有无关系?与什么有关?
4、0.5 molCO2_____________个CO2
5、1. 204 1023 个HCl分子物质的量为____mol
3.01 1023
0.2
两种物质的微粒数之比 == 物质的量之比
(与物质的状态无关)
物质的量(摩) ==
微粒数(个)
阿伏加德罗常数(个/摩)
物质的量与粒子数之间换算
微粒的数量 物质的量
NA
NA
1、1mol H2O含有_______个分子,有________个氢原子, 有________个O,含有________质子,_______个电子
3、下列物质中含分子数目由大到小顺序为__________
A.0.5molO2 B. 6.02 1023个N2
C.6.02 1024个HCl
D.与0.12kg12C含相同原子数目的Cl2
4、0.1molH2O中与_____molCO2所含的氧原子数目相同,与__________个CH4分子中所含的氢原子数相同
深化应用:
6.02 1023
1.204 1024
6.02 1023
6.02 1024
6.02 1024
6.02 1022
6.02 1022
D>C>B>A
0.05
3.01 1022
2、0.1molNaOH能电离出______个Na+,______个OH-
物质的量
知识小结:
基准:NA
1、衡量物质所含微粒数多少
2、专有名词,不能随意拆开
3、对象为微观粒子及其特定组合
单位:摩尔
1、是基本物理量的单位
2、量度对象具体微观粒子及其特定组合
3、使用时用化学式指明粒子的种类
1、准确值:12g12C所含原子数
近似值: 6.02 1023
n=
NA
N
2、
=
N2
N1
n2
n1
基本物理量
判断下列说法是否正确,并加以说明理由
1、1mol苹果
不对,指代不明,可指氧原子也可指氧分子
对,特定组合
对,指氧原子
对
不对,不能指宏观物质
不对,元素是宏观概念,只能说种类
2、1molO
3、1mol氧
4、1molH2O
8、1mol钠元素
9、1molNaCl
5、1mole-
6、1mol质子
7、1molOH-
对
对
对
NA----一个惊人的数字
1 、将6.02 1023个一毛硬币排起来,可来
回地球和太阳间400亿次之多
2、如果1千克谷子有4万粒, 6.02 1023粒谷子有
1.505 1019千克,若按地球上有60亿人,人均
每年消耗500千克,可供全世界人用500万年。
1mol铁
6.02×
个原子
55.8克
7.1cm
3
1mol水
6.02×
个原子
18.0cm
3
1mol硫酸
54.1cm
3
6.02×
个原子
1mol的下列物质
