乙醇[下学期]
图片预览



文档简介
(共18张PPT)
清明时节雨纷纷
路上行人欲断魂
借问酒家何处有
牧童遥指杏花村
清 明
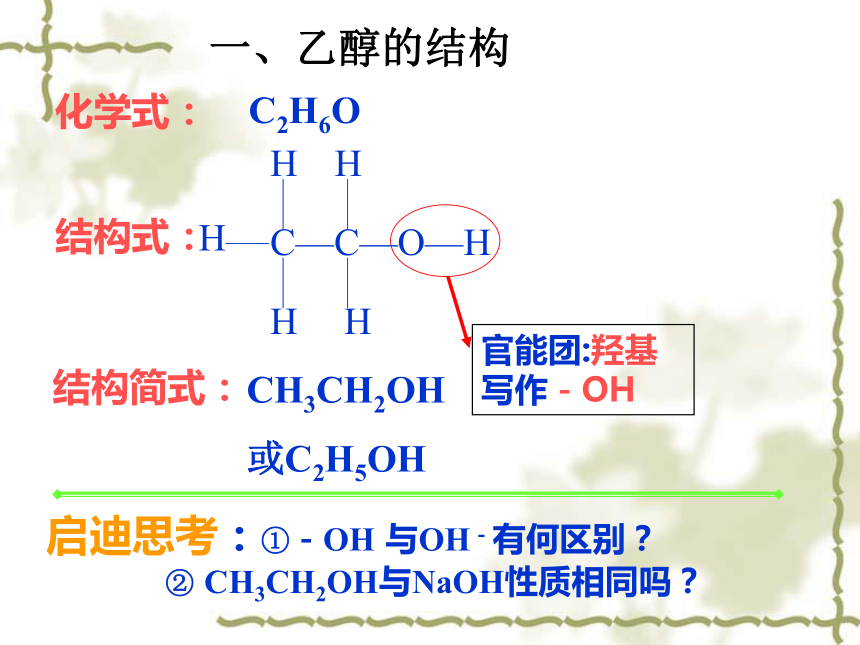
C—C—O—H
H
H
H
H
H
结构式:
CH3CH2OH
或C2H5OH
官能团:羟基
写作-OH
化学式:
C2H6O
结构简式:
启迪思考:①-OH 与OH-有何区别?
② CH3CH2OH与NaOH性质相同吗?
一、乙醇的结构
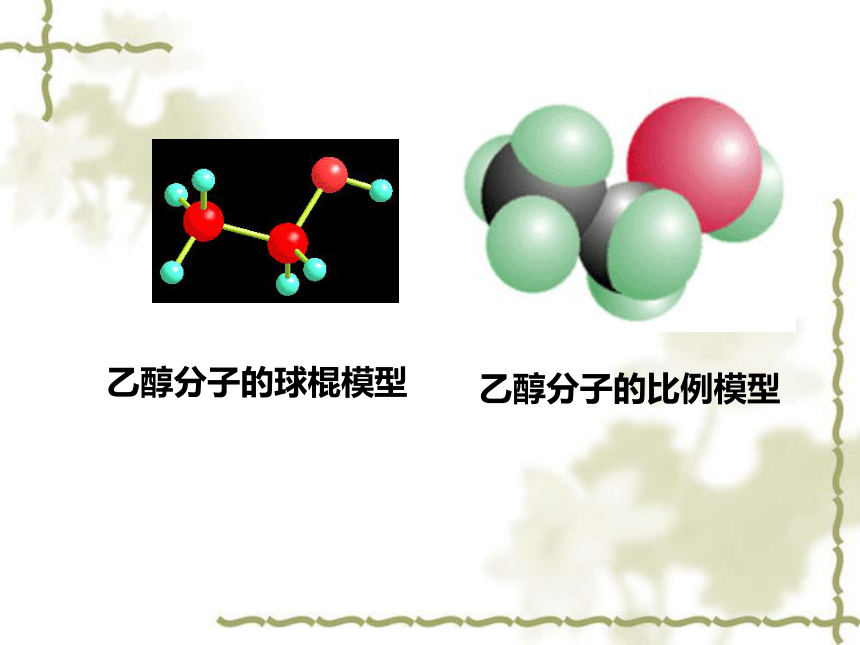
乙醇分子的比例模型
乙醇分子的球棍模型
颜 色:
气 味 :
状 态:
密 度 :
溶解性:
挥发性:
无色透明
特殊香味
液体
比水小,200C时的密度是0.7893g/cm3
跟水以任意比互溶,能够溶解多种
无机物和有机物。
易挥发,沸点:78.50C
启迪思考:①如何分离水和酒精?
②工业上如何制取无水乙醇?
③如何检验无水乙醇中是否含有水?
二、乙醇的物理性质
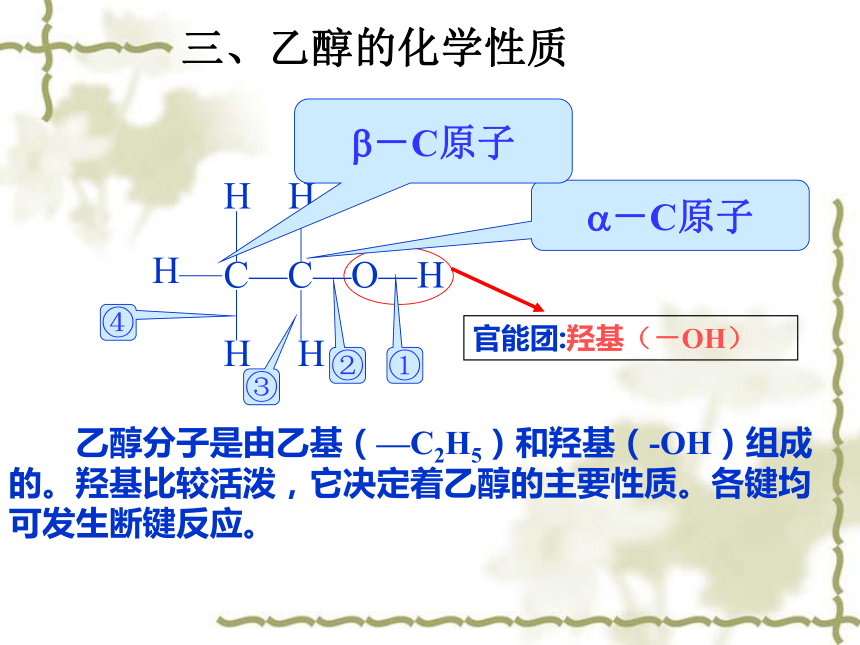
C—C—O—H
H
H
H
H
H
官能团:羟基(-OH)
-C原子
-C原子
乙醇分子是由乙基(—C2H5)和羟基(-OH)组成的。羟基比较活泼,它决定着乙醇的主要性质。各键均可发生断键反应。
①
②
④
③
三、乙醇的化学性质
2C2H5OH+2Na 2C2H5ONa+H2
1.与金属反应
分析: 与水跟金属钠的反应相比,乙醇跟钠的反应要缓和得多。 其它活泼金属如钾、镁、铝等也能够把乙醇的羟基里的氢取代出来。
启迪思考:①试比较乙醇和水的酸性强弱 ?
②由生成的 H2 量可否推测—OH 的数目?能否通过此反应测定醇中羟基的数目?
2.氧化反应
乙醇在空气里能够燃烧,发出淡蓝色的火焰,同时放出大量的热。
因此:乙醇可用作内燃机的燃料,实验
室里也常用它作为燃料。
2CO2 +3H2O
C2H5OH + 3 O2
点燃
(1)燃烧
新知识点:在有机化学中通常用反应物的得氧或得氢来判断氧化还原反应。得氧或失氢叫做氧化反应;得氢或失氧叫做还原反应.
分析: 乙醇在加热和有催化剂(Cu或Ag)存在的条件下,能够被氧气氧化,生成乙醛。工业上根据这个原理,可以由乙醇制造乙醛。
(2)催化氧化
演示实验:将热铜丝插入乙醇中,反复多次,闻液体气味变化 。 现象:
刺激性气味。
2CH3CH2OH + O2 2CH3CHO + 2H2O
催化剂
C—C—H
H
H
H
H
O—H
--C被氧化
两个H脱去与O结合成水
与-OH相连的碳原子必须有H才能被氧化。
即必须要有 --H。
什么样的醇才能发生去氢氧化?
C—C—H
H
H
H
H
O—H
--C被氧化
两个H脱去与O结合成水
①在 --C上有2个H时:
②在 --C上只有1个H时:
启迪思考:
RCH O RCH=O
H
H
Cu
3000C
生成醛
C O C=O
R
R
R
R
H
H
Cu
3000C
生成酮
判断下列各醇是否能氧化成醛?写出氧化产物的结构简式。
OH
A、CH3—CH2—CH2OH B、CH3—CH—CH3
CH3
C、CH3—C—OH D、CH3OH
CH3
分子内脱水
乙醇和浓硫酸加热到170℃,每一个乙醇分子脱去一个水分子而生成乙烯。实验室里可以用这个方法制取乙烯。
浓H2SO4
1700C
H C C H CH2=CH2 +H2O
H
H
H
OH
实验:如图(乙醇与浓硫酸混合共热)
羟基和氢脱去结合成水
3.消去反应
启迪思考:能发生消去反应的醇的分子结构特点是什么
乙醇和浓硫酸共热到140℃左右,每两个乙醇分子间会脱去一个水分子而生成乙醚。
(1)分子间脱水
2CH3CH2OH CH3CH2OCH2CH3 + H2O
浓H2SO4
1400C
CH3CH2—OH H—OCH2CH3
脱水
4.取代反应
提醒:乙醇能脱水主要是由于乙醇分子里含有羟基。反应条件(例如温度)不同,乙醇脱水的方式也不同,生成物也不同。
所以,我们可以根据物质的化学性质,按照实际需要,控制反应条件,使化学反应朝着我们所需要的方向进行。
学以致用
(2) 跟氢卤酸反应
CH3CH2—OH +H—Br CH3CH2Br+H2O
应用:一般情况下,醇比较容易获得,所以卤代烷烃常用醇与氢卤酸反应制得。
启迪思考:氢溴酸可以用溴化钠和硫酸的混合物代替。
①写出该反应的化学方程式
②通常采用1:1的硫酸,而不用很浓的硫酸。思考为什么?
四、乙醇的制法
清明时节雨纷纷
路上行人欲断魂
借问酒家何处有
牧童遥指杏花村
清 明
C—C—O—H
H
H
H
H
H
结构式:
CH3CH2OH
或C2H5OH
官能团:羟基
写作-OH
化学式:
C2H6O
结构简式:
启迪思考:①-OH 与OH-有何区别?
② CH3CH2OH与NaOH性质相同吗?
一、乙醇的结构
乙醇分子的比例模型
乙醇分子的球棍模型
颜 色:
气 味 :
状 态:
密 度 :
溶解性:
挥发性:
无色透明
特殊香味
液体
比水小,200C时的密度是0.7893g/cm3
跟水以任意比互溶,能够溶解多种
无机物和有机物。
易挥发,沸点:78.50C
启迪思考:①如何分离水和酒精?
②工业上如何制取无水乙醇?
③如何检验无水乙醇中是否含有水?
二、乙醇的物理性质
C—C—O—H
H
H
H
H
H
官能团:羟基(-OH)
-C原子
-C原子
乙醇分子是由乙基(—C2H5)和羟基(-OH)组成的。羟基比较活泼,它决定着乙醇的主要性质。各键均可发生断键反应。
①
②
④
③
三、乙醇的化学性质
2C2H5OH+2Na 2C2H5ONa+H2
1.与金属反应
分析: 与水跟金属钠的反应相比,乙醇跟钠的反应要缓和得多。 其它活泼金属如钾、镁、铝等也能够把乙醇的羟基里的氢取代出来。
启迪思考:①试比较乙醇和水的酸性强弱 ?
②由生成的 H2 量可否推测—OH 的数目?能否通过此反应测定醇中羟基的数目?
2.氧化反应
乙醇在空气里能够燃烧,发出淡蓝色的火焰,同时放出大量的热。
因此:乙醇可用作内燃机的燃料,实验
室里也常用它作为燃料。
2CO2 +3H2O
C2H5OH + 3 O2
点燃
(1)燃烧
新知识点:在有机化学中通常用反应物的得氧或得氢来判断氧化还原反应。得氧或失氢叫做氧化反应;得氢或失氧叫做还原反应.
分析: 乙醇在加热和有催化剂(Cu或Ag)存在的条件下,能够被氧气氧化,生成乙醛。工业上根据这个原理,可以由乙醇制造乙醛。
(2)催化氧化
演示实验:将热铜丝插入乙醇中,反复多次,闻液体气味变化 。 现象:
刺激性气味。
2CH3CH2OH + O2 2CH3CHO + 2H2O
催化剂
C—C—H
H
H
H
H
O—H
--C被氧化
两个H脱去与O结合成水
与-OH相连的碳原子必须有H才能被氧化。
即必须要有 --H。
什么样的醇才能发生去氢氧化?
C—C—H
H
H
H
H
O—H
--C被氧化
两个H脱去与O结合成水
①在 --C上有2个H时:
②在 --C上只有1个H时:
启迪思考:
RCH O RCH=O
H
H
Cu
3000C
生成醛
C O C=O
R
R
R
R
H
H
Cu
3000C
生成酮
判断下列各醇是否能氧化成醛?写出氧化产物的结构简式。
OH
A、CH3—CH2—CH2OH B、CH3—CH—CH3
CH3
C、CH3—C—OH D、CH3OH
CH3
分子内脱水
乙醇和浓硫酸加热到170℃,每一个乙醇分子脱去一个水分子而生成乙烯。实验室里可以用这个方法制取乙烯。
浓H2SO4
1700C
H C C H CH2=CH2 +H2O
H
H
H
OH
实验:如图(乙醇与浓硫酸混合共热)
羟基和氢脱去结合成水
3.消去反应
启迪思考:能发生消去反应的醇的分子结构特点是什么
乙醇和浓硫酸共热到140℃左右,每两个乙醇分子间会脱去一个水分子而生成乙醚。
(1)分子间脱水
2CH3CH2OH CH3CH2OCH2CH3 + H2O
浓H2SO4
1400C
CH3CH2—OH H—OCH2CH3
脱水
4.取代反应
提醒:乙醇能脱水主要是由于乙醇分子里含有羟基。反应条件(例如温度)不同,乙醇脱水的方式也不同,生成物也不同。
所以,我们可以根据物质的化学性质,按照实际需要,控制反应条件,使化学反应朝着我们所需要的方向进行。
学以致用
(2) 跟氢卤酸反应
CH3CH2—OH +H—Br CH3CH2Br+H2O
应用:一般情况下,醇比较容易获得,所以卤代烷烃常用醇与氢卤酸反应制得。
启迪思考:氢溴酸可以用溴化钠和硫酸的混合物代替。
①写出该反应的化学方程式
②通常采用1:1的硫酸,而不用很浓的硫酸。思考为什么?
四、乙醇的制法
