电能转变为化学能[下学期]
图片预览





文档简介
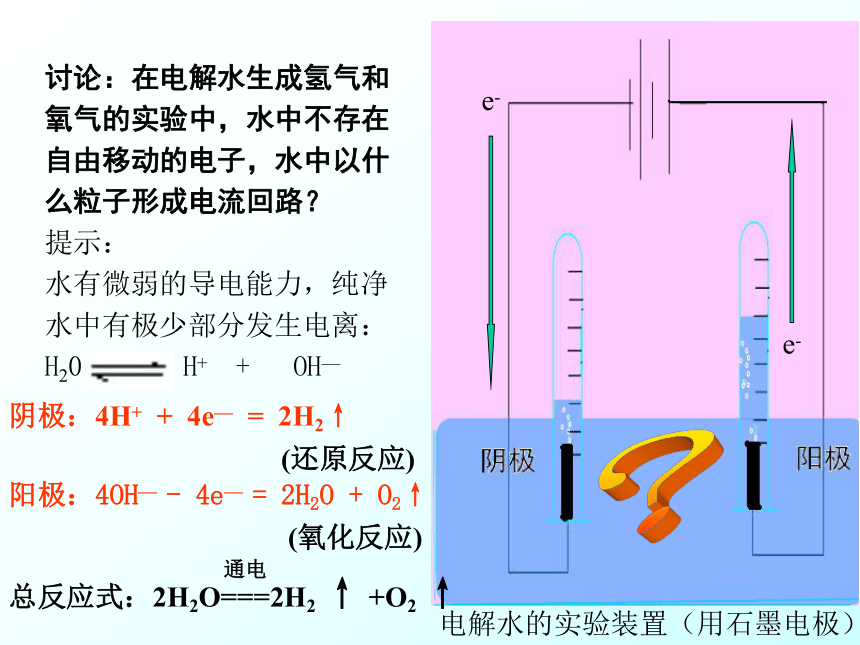
课件19张PPT。化学能与电能的转化(2)讨论:在电解水生成氢气和氧气的实验中,水中不存在自由移动的电子,水中以什么粒子形成电流回路?
提示:
水有微弱的导电能力,纯净水中有极少部分发生电离:
H20 H+ + OH—
e-e-?阴极:4H+ + 4e— = 2H2↑阳极:4OH— - 4e— = 2H2O + O2↑(还原反应)(氧化反应)电解水的实验装置(用石墨电极) 1884年瑞典25岁的大学生阿伦尼乌斯(1859-1927)提出理论,当时他并不清楚复杂的电离过程,也不甚了解水溶液中存在自由移动的离子。他提出用带电的原子(即离子)在电流作用下,带正电的向一个方向游动,而带负电的向相反的方向游动,来解释某些溶液能传导电流的性质。他的哲学博士论文观点很有开创性,但在当时认为原子不可分的时代,提出带电的原子是很荒唐的,但主考人又觉得有点道理,可以说明溶液导电的性质,就勉强让他及格。到1897年汤姆生发现电子后,阿氏理论才显示出惊人的意义,直到1903年,他因19年前的论文而获得诺贝尔化学奖。
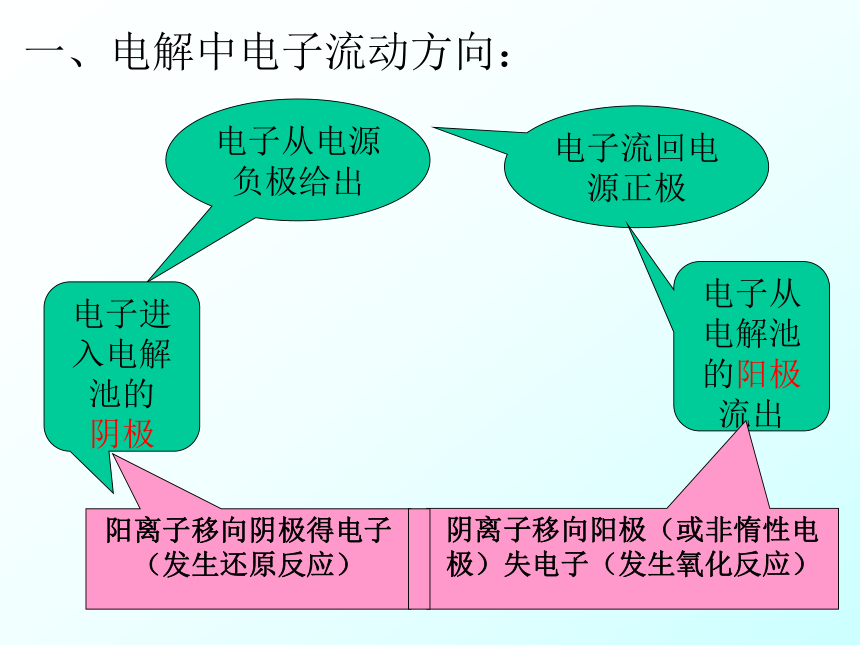
一、电解中电子流动方向:电子从电源负极给出电子进入电解池的
阴极电子流回电源正极电子从电解池的阳极流出事实上所有电解水的实验中都加入了其它的一些物质,如NaOH、稀硫酸等,以增加导电能力,而电解所得到的产物却没有变化,请你分析这两种溶液中的微粒、通电后离子的运动方向、在阴阳两个电极的反应情况。NaOH = Na+ + OH—
H2O H+ + OH—通电后离子定向运动: OH— → 阳极 Na+、H+ → 阴极阳极:4OH— - 4e— = 2H2O + O2↑阴极:H+先得到电子:阳离子的放电顺序 H+>Na+
4H+ + 4e— = 2H2↑离子的放电(得失电子能力)顺序:阴极:氧化性强的离子先得电子金属越不活泼的对应阳离子越容易得电子;H+(水) 金属原子(除Pt、Au外)>S2->X - (I->Br->Cl-)> OH-(水) >含氧酸根>F- 阳极:还原性强的金属原子或离子先失电子阴极:Ag+>Cu2+>H+(水)>Pb2+>……>Na+惰性电极包括:石墨、金、铂等,电极材料不参与得失电子;
若电极为铜或铁等较活泼的金属作阳极,则阳极材料先放电,失去电子后形成离子进入溶液。二、电解: 使直流电通过电解质溶液而在阴、阳两极引起氧化还原反应的过程,叫做电解。构成电解池的条件:是电能转变为化学能的装置!①直流电源;与电源负极相连的电极为阴极与电源正极相连的电极为阳极②阴、阳电极③电解质溶液或熔融电解质;注意:
1。电解质溶液或熔融电解质是导电的前提,有自由移动的离子。2。电解质导电的实质是阳离子在阴极得电子、阴离子在阳极(或较活泼的金属阳极) 失电子的过程,是化学变化过程,也是能量贮存过程。而金属导电只是物理变化。3。电解一般发生非自发进行的氧化还原反应。4。考虑电解产物的三个思考程序:一是存在什么离子、二是离子在通直流电后如何移动、三是到达电极后哪种离子先得或失电子。(2)电解原理:①通电前:CuCl2 = Cu2+ + 2Cl—
H2O H + + OH —
Cu2+ 、H +、Cl—、OH—为自由移动的离子;③通电后:Cu2+移向阴极得到电子
Cl—移向阳极失去电子;电极反应:阳极:2Cl— - 2e— = Cl2↑(氧化反应)阴极:Cu2+ + 2e— = Cu(还原反应)②通电时:Cu2+ 、H + →阴极Cl—、OH— →阳极电解熔融食盐通电前: NaCl = Na+ + Cl—通电时: Na+ → 阴极 Cl— → 阳极电极反应式:阴极:2Na+ + 2e— = 2Na
阳极:2Cl— — 2e— = Cl2↑ 电解饱和食盐水通电时: H + 、Na+ → 阴极 OH — 、Cl— → 阳极电极反应式:阴极:2H+ + 2e— = H2↑
阳极:2Cl— — 2e— = Cl2↑ 通电前: NaCl = Na+ + Cl—
H2O H + + OH —Cl2Cl2Cl—H2H+OH—低浓度盐水NaOH溶液精制饱和NaCl溶液H2O(含少量NaOH)阳离子交换膜
将电解槽隔成阴极室和阳极室,它只允许阳离子(Na+)通过,而阻止阴离子(Cl-、OH-)和气体通过。
可防止H2、Cl2混合爆炸,也可防止Cl2与NaOH反应。由于H+放电,使OH—增加只是Cl — 放电,
始终显中性例:写出用石墨做电极电解CuSO4溶液的电极反应式及总的电解方程式, 阴极:阳极:③、最后使得失数相等,两极半反应相加得电解化学方程式;>阴极:阳极:4OH- -4e - =2H2O+O2↑2 Cu2++4e - =2CuOH- SO4 2-H+ Cu2+H2O H+ + OH- CuSO4 = Cu2+ + SO4 2-①、首先分析、比较出阴阳极的放电离子:②、然后写电极反应式 :2H2SO4+2Cu+O2↑2CuSO4+2H2O<1.(2003上海)电解CuC12溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是( )
A.a为负极、b为正极
B. a为阳极、b为阴极
C.电解过程中,d电极质量增加
D.电解过程中,氯离子浓度不变
C2. (2000广东)用铂电极(惰性)电解下列溶液时,阴、阳极上的主要产物分别是H2和02的是( )
A.稀NaOH溶液 B.HCl溶液
C.酸性MgS04溶液 D.酸性AgN03溶液 AC粗铜纯铜二、铜的电解精炼:1、电解精炼铜的装置: e-? 纯铜作阴极,粗铜作阳极; e- e-单击电子流动2、电解精炼铜原理:①粗铜的溶解与纯铜的生成:阳极(粗铜):Cu -2e- = Cu2+
阴极(纯铜): Cu2+ + 2e- = Cu②比铜活泼的金属:Zn.Fe.Ni只溶解,不析出;③比铜不活泼的金属:Au.Pt.不溶解,而以单质沉积
形成阳极泥;④电解质溶液中CuSO4的浓度基本不变;铝电解槽烟罩银的精制(1)粗银做阳极
精银做阴极
(2)阳极:比银(包括银)活泼的金属失e,如:Ag-e= Ag+ Zn-2e=Zn2+
阴极:比银(包括银)不活泼的金属得e
Ag++e=Ag
(3)阳极上比银(包括银)不活泼的金属成为杂质,沉淀于阳极底部,成为阳极泥,电解质溶液中的AgNO3浓度降低。金属的防护金属腐蚀的快慢程度:
电解池的阳极>原电池的负极>化学腐蚀>原电池的正极>电解池的阳极
提示:
水有微弱的导电能力,纯净水中有极少部分发生电离:
H20 H+ + OH—
e-e-?阴极:4H+ + 4e— = 2H2↑阳极:4OH— - 4e— = 2H2O + O2↑(还原反应)(氧化反应)电解水的实验装置(用石墨电极) 1884年瑞典25岁的大学生阿伦尼乌斯(1859-1927)提出理论,当时他并不清楚复杂的电离过程,也不甚了解水溶液中存在自由移动的离子。他提出用带电的原子(即离子)在电流作用下,带正电的向一个方向游动,而带负电的向相反的方向游动,来解释某些溶液能传导电流的性质。他的哲学博士论文观点很有开创性,但在当时认为原子不可分的时代,提出带电的原子是很荒唐的,但主考人又觉得有点道理,可以说明溶液导电的性质,就勉强让他及格。到1897年汤姆生发现电子后,阿氏理论才显示出惊人的意义,直到1903年,他因19年前的论文而获得诺贝尔化学奖。
一、电解中电子流动方向:电子从电源负极给出电子进入电解池的
阴极电子流回电源正极电子从电解池的阳极流出事实上所有电解水的实验中都加入了其它的一些物质,如NaOH、稀硫酸等,以增加导电能力,而电解所得到的产物却没有变化,请你分析这两种溶液中的微粒、通电后离子的运动方向、在阴阳两个电极的反应情况。NaOH = Na+ + OH—
H2O H+ + OH—通电后离子定向运动: OH— → 阳极 Na+、H+ → 阴极阳极:4OH— - 4e— = 2H2O + O2↑阴极:H+先得到电子:阳离子的放电顺序 H+>Na+
4H+ + 4e— = 2H2↑离子的放电(得失电子能力)顺序:阴极:氧化性强的离子先得电子金属越不活泼的对应阳离子越容易得电子;H+(水) 金属原子(除Pt、Au外)>S2->X - (I->Br->Cl-)> OH-(水) >含氧酸根>F- 阳极:还原性强的金属原子或离子先失电子阴极:Ag+>Cu2+>H+(水)>Pb2+>……>Na+惰性电极包括:石墨、金、铂等,电极材料不参与得失电子;
若电极为铜或铁等较活泼的金属作阳极,则阳极材料先放电,失去电子后形成离子进入溶液。二、电解: 使直流电通过电解质溶液而在阴、阳两极引起氧化还原反应的过程,叫做电解。构成电解池的条件:是电能转变为化学能的装置!①直流电源;与电源负极相连的电极为阴极与电源正极相连的电极为阳极②阴、阳电极③电解质溶液或熔融电解质;注意:
1。电解质溶液或熔融电解质是导电的前提,有自由移动的离子。2。电解质导电的实质是阳离子在阴极得电子、阴离子在阳极(或较活泼的金属阳极) 失电子的过程,是化学变化过程,也是能量贮存过程。而金属导电只是物理变化。3。电解一般发生非自发进行的氧化还原反应。4。考虑电解产物的三个思考程序:一是存在什么离子、二是离子在通直流电后如何移动、三是到达电极后哪种离子先得或失电子。(2)电解原理:①通电前:CuCl2 = Cu2+ + 2Cl—
H2O H + + OH —
Cu2+ 、H +、Cl—、OH—为自由移动的离子;③通电后:Cu2+移向阴极得到电子
Cl—移向阳极失去电子;电极反应:阳极:2Cl— - 2e— = Cl2↑(氧化反应)阴极:Cu2+ + 2e— = Cu(还原反应)②通电时:Cu2+ 、H + →阴极Cl—、OH— →阳极电解熔融食盐通电前: NaCl = Na+ + Cl—通电时: Na+ → 阴极 Cl— → 阳极电极反应式:阴极:2Na+ + 2e— = 2Na
阳极:2Cl— — 2e— = Cl2↑ 电解饱和食盐水通电时: H + 、Na+ → 阴极 OH — 、Cl— → 阳极电极反应式:阴极:2H+ + 2e— = H2↑
阳极:2Cl— — 2e— = Cl2↑ 通电前: NaCl = Na+ + Cl—
H2O H + + OH —Cl2Cl2Cl—H2H+OH—低浓度盐水NaOH溶液精制饱和NaCl溶液H2O(含少量NaOH)阳离子交换膜
将电解槽隔成阴极室和阳极室,它只允许阳离子(Na+)通过,而阻止阴离子(Cl-、OH-)和气体通过。
可防止H2、Cl2混合爆炸,也可防止Cl2与NaOH反应。由于H+放电,使OH—增加只是Cl — 放电,
始终显中性例:写出用石墨做电极电解CuSO4溶液的电极反应式及总的电解方程式, 阴极:阳极:③、最后使得失数相等,两极半反应相加得电解化学方程式;>阴极:阳极:4OH- -4e - =2H2O+O2↑2 Cu2++4e - =2CuOH- SO4 2-H+ Cu2+H2O H+ + OH- CuSO4 = Cu2+ + SO4 2-①、首先分析、比较出阴阳极的放电离子:②、然后写电极反应式 :2H2SO4+2Cu+O2↑2CuSO4+2H2O<1.(2003上海)电解CuC12溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是( )
A.a为负极、b为正极
B. a为阳极、b为阴极
C.电解过程中,d电极质量增加
D.电解过程中,氯离子浓度不变
C2. (2000广东)用铂电极(惰性)电解下列溶液时,阴、阳极上的主要产物分别是H2和02的是( )
A.稀NaOH溶液 B.HCl溶液
C.酸性MgS04溶液 D.酸性AgN03溶液 AC粗铜纯铜二、铜的电解精炼:1、电解精炼铜的装置: e-? 纯铜作阴极,粗铜作阳极; e- e-单击电子流动2、电解精炼铜原理:①粗铜的溶解与纯铜的生成:阳极(粗铜):Cu -2e- = Cu2+
阴极(纯铜): Cu2+ + 2e- = Cu②比铜活泼的金属:Zn.Fe.Ni只溶解,不析出;③比铜不活泼的金属:Au.Pt.不溶解,而以单质沉积
形成阳极泥;④电解质溶液中CuSO4的浓度基本不变;铝电解槽烟罩银的精制(1)粗银做阳极
精银做阴极
(2)阳极:比银(包括银)活泼的金属失e,如:Ag-e= Ag+ Zn-2e=Zn2+
阴极:比银(包括银)不活泼的金属得e
Ag++e=Ag
(3)阳极上比银(包括银)不活泼的金属成为杂质,沉淀于阳极底部,成为阳极泥,电解质溶液中的AgNO3浓度降低。金属的防护金属腐蚀的快慢程度:
电解池的阳极>原电池的负极>化学腐蚀>原电池的正极>电解池的阳极
