物质的聚集状态[上学期]
图片预览



文档简介
第三框题 物质的聚集状态
学习目标
知识技能:
知道固、液、气态物质的一些特性,初步学会运用气体摩尔体积等概念进行简单计算。
过程方法:
从分析研究影响固体、液体、气体体积的大小主要因素过程中,培养问题意识,调动探究的主观欲望,体验归纳整理的过程,学习分析矛盾的主要方面和次要方面。
情感态度:
通过影响物质体积大小的因素和气体摩尔体积的学习,培养与人合作的团队精神,善于合作学习,共同提高。在晶体的学习中感觉化学世界的美丽、奇妙与和谐。
教材分析
本框题是第一框题的延续,从物质的状态上对物质进行分类,并重点对气体的性质学习和研究,使学生进一步体会分类的方法,学会从不同的角度考虑问题,增强思维的发散性品质。教学中对影响物质体积的因素分析要善于从宏观到微观,有利于学生理解问题,也使学生能从本质上理解宏观现象与微观本质的关系,体验化学科学学习的特点。教学中还要不断巩固物质的量、摩尔质量、微粒个数、物质的质量的概念,精选适量的习题,以强化和巩固概念,培养解题的能力。
教学准备
多媒体课件
教时:1课时
教学过程
情景设计:
水有三种状态,同样是水分子,可以组成水蒸气,可以组成液态的水,还可以组成固态的冰,它们的差别是水分子的聚集方式不同。
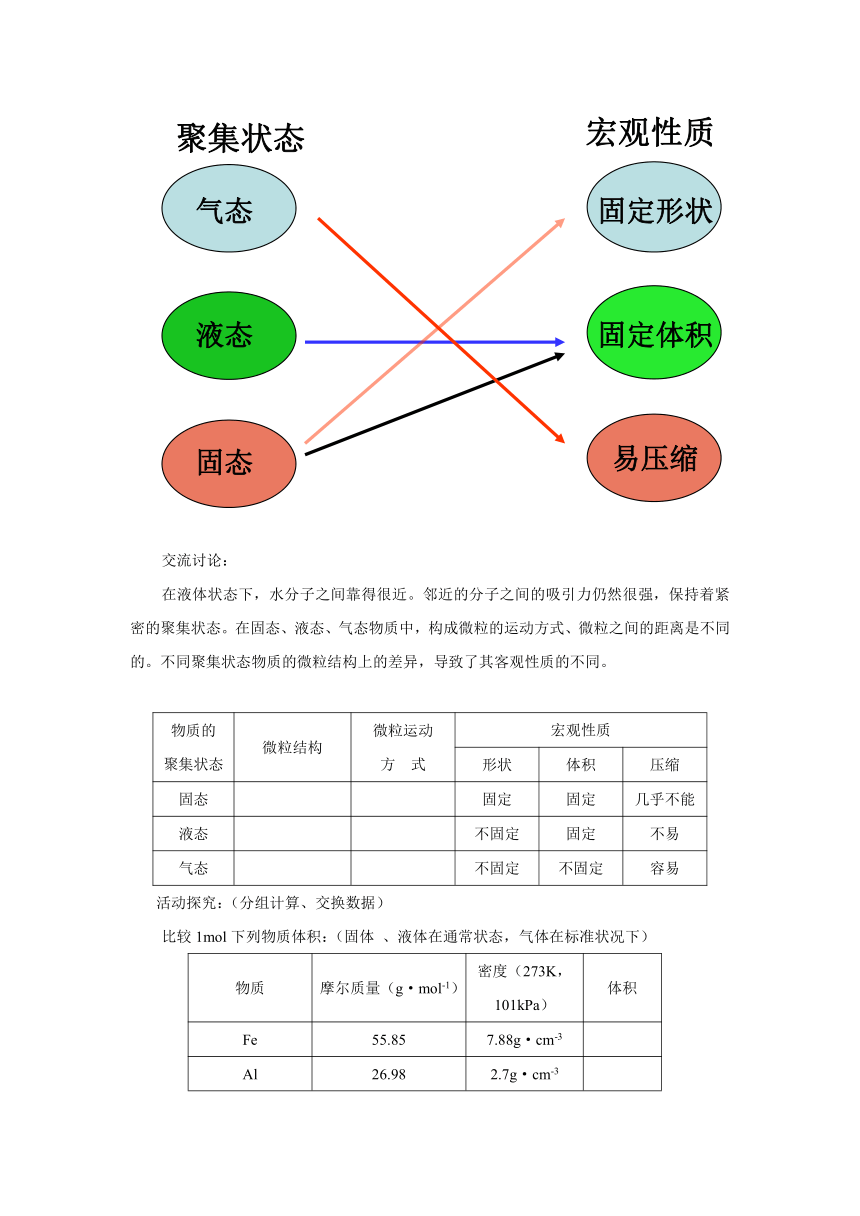
通常物质有三种聚集状态,联系生活的经验,将三种状态与它们物质的相关性质用短线联接起来:
交流讨论:
在液体状态下,水分子之间靠得很近。邻近的分子之间的吸引力仍然很强,保持着紧密的聚集状态。在固态、液态、气态物质中,构成微粒的运动方式、微粒之间的距离是不同的。不同聚集状态物质的微粒结构上的差异,导致了其客观性质的不同。
物质的聚集状态 微粒结构 微粒运动方 式 宏观性质
形状 体积 压缩
固态 固定 固定 几乎不能
液态 不固定 固定 不易
气态 不固定 不固定 容易
活动探究:(分组计算、交换数据)
比较1mol下列物质体积:(固体 、液体在通常状态,气体在标准状况下)
物质 摩尔质量(g·mol-1) 密度(273K,101kPa) 体积
Fe 55.85 7.88g·cm-3
Al 26.98 2.7g·cm-3
Pb 207.2 11.3g·cm-3
H2O 18.02 0.998g·cm-3
C2H5OH 46.07 0.789 g·cm-3
H2 2.016 0.0899g·L-1
O2 32.0 1.43g·L-1
CO2 44.01 1.997g·L-1
(1) 通过合作学习,计算出相关的数据。(分组计算)
观察上表,你能得出什么结论?
①相同条件下,相同物质的量的不同状态的物质所占体积大小不同,通常是 ;
②相同条件下,相同物质的量的固体或液体所占的体积 ;
③相同条件下,相同物质的量的气体所占的体积近似 。
(2) 通过通俗的宏观实例(如将100只乒乓球、网球、篮球在操场上用不同方法放置后所占空间大小的比较),提出假设:
影响物质体积的因素可能性有哪些?
①物质中所含的粒子数的多少;②粒子间的平均距离;③粒子本身的大小。
(3) 探究:决定固体、液体、气体的体积大小的主要因素。
固体和液体物质:①内部紧密堆积,体积主要由粒子大小决定。②内部紧密堆积,改变温度、压强对体积影响不大。③1mol不同固体、液体的体积不相等。
气态物质:①分子间的距离比分子本身的体积大得多(约相差10倍),体积体积主要由分子间的距离决定。②体积受温度、压强影响大。③同温同压下,同物质的量的气体体积基本相等。
整理归纳:
相同的温度和压强下,不同气体的分子间距离基本相同。含有相同物质的量的气体,在相同的条件下具有相同的体积。
单位物质的量的气体所占的体积叫做气体摩尔体积(Vm)。
在标准状况(0℃、101KPa)下,1mol任何气体所占的体积都约为22.4L,气体摩尔体积约为22.4L·mol-1,这是气体摩尔体积的特例。
问题解决:
[问题1] 判断下列叙述哪项正确……………………………( )
A. 标准状况下,1moL任何物质的体积约为22.4L
B.1mol气体的体积约为22.4L
C.1mol氖气和1mol氧气体积相同
D. 标准状况下,1mol氖气和氯气混合气体(任意体积比)的体积约为22.4L
分析:根据气体摩尔体积的定义,应注意对其有影响的两个重要条件:一是指气体体积,而非液体或固体的体积;二是在标准状况下,气体的摩尔体积的具体值为22.4L·moL-1,而在不同温度和压强下,气体摩尔体积并不相同。注意审题、细心是解好化学题目的关键。 答案:D
[问题2] 13.0g锌与足量的稀盐酸完全反应,最多可收集到多少体积(标准状况)的氢所?
指导学生阅读解题过程,分析化学方程式中量的关系。
Zn + 2HCl = ZnCl2 + H2 ↑
物质的量 1mol 2 mol 1 mol 1 mol
相关物质有关量的 1 mol 22.4L
不同的表示方法 65g 1 mol
体验课本的解题过程,你能有更好的解题方法吗?写出你的解题过程。
[问题3] 计算在标准状况下,至少需要多少体积的氢气与足量的氧气反应才能生成18g水。
[问题4] 总结:气体的体积(V)与气体的物质的量(n)、气体摩尔体积(Vm)之间的关系。
信息博览
1.有关气体摩尔体积的计算
气体的体积、物质的量、气体的质量、气体的微粒数目之间的关系。
2.气体摩尔体积的常见应用
标准状况下1mol气体为22.4L,即可导出其质量便是该气体的摩尔质量。据此可求出未知化学式的气体摩尔质量和相对分子质量,也可求出1L气体的质量即气体密度。反之也可由气体密度求摩尔质量。同温、同压下两气体的密度比叫气体的相对密度,可据此由气体的相对密度求气体的摩尔质量,如某气体对H2的相对密度为15,则其相对分子质量为15×2。常见的有:
(1)由标准状况下气体密度求相对分子质量:Mr=22.4d。
(2由相对密度求气体的相对分子质量:若为的相对密度则为:Mr= d对H2·2,若为对空气的相对密度则为:Mr= d对空气·29。
*(3)求混合气体的平均相对分子质量,即1mol混合气体时的质量数值。在已知各组成气体的体积分数时见①,若为质量分数见②:
①=a%×Ma+b%×Mb+······
②=1/(a%÷Ma+b%÷Mb+······)
(4)由同温、同压下气体反应时的体积比求分子数,进而推分子数。
(5)直接将气体摩尔体积代入有关化学方程式进行计算。
(6)气体反应物的体积比即分子数比可便于找出过量气体。
*3.阿伏加德罗定律 同温、同压下体积相同的任何气体都含有相同的分子数即阿伏加德罗定律。由此可见气体的体积比在同温、同压下必等于分子数比。由此可以导出同温、同压下不同气体间的关系:
(1)同温、同压下,气体的体积比等于物质的量比。VA/VB=nA/nB
(2 ) 同温、同压下,气体的压强比等于物质的量比。pA/pB=nA/nB
(3 ) 同温、同压下,气体的摩尔质量比等于密度比。MA/MB=dA/dB
(4 ) 同温、同压下,同体积的气体质量比等于摩尔质量的反比。mA/mB=MA/MB
(5) 同温、同压下,同质量气体的体积比等于摩尔质量的反比。VA/VB=MB/MA
此外在运用时要结合物理中的同物质的量的气体在同温时,其体积与压强成反比;气体体积与热力学温度在同压条件下成正比。
3.晶体和非晶体
实践巩固
1.下列说法正确的是……………………………( )
A.常温、常压下,11.2L氯气所含的原子数为NA
B. 常温、常压下,1mol氦气含有的核外电子数为4NA
C. 17g氨气所含的电子数目为10NA
D. 同温、同压下,相同体积的任何气体单质所含的原子数目相同
2.标准状况下,下列物质体积最大的是……………………………( )
A.2g H2 B. 20g SO2
C. 23gNa D. 160gBr2
3.在标准状况下 ,1LN2中含m个氮分子,则阿伏加德罗常数可表示为…………………( )
A. B.
C. 22.4m D. 22.4m/mol
4.在同温、同压下,A容器中盛有H2,B容器中盛有NH3,若使它们所含的原子总数相等,则两个容器的体积比是……………………………( )
A. 2:1 B. 1:2
C. 2:3 D. 1:3
5.下列各组物质,所含分子数一定相同的是……………………………( )
A.1g H2和8g O2 B. 0.1molHCl和22.4LHe
C. 150oC、1.01×105Pa时18LH2O和18LCO2
D. 28gCO和6.02×1023个CO分子
6.nmol O2与nmolCO相比较,下列叙述正确的是……………………………( )
A.在同温同压下体积相等
B.在同温同压下密度相等
C. 在标准状况下质量相等
D. 分子数相等
7.在标准状况下,将1g氦气,11g二氧化碳和4g氧气混合,该混合气体的体积约为…………………( )
A.28 L B. 11.2L
C. 16.8L D. 14. L 0
8.在标准状况下,某气体密度为1.25g· L -1,则该其气体的相对分子质量为…………………( )
A.12.5 B. 14
C. 28 D. 30
⒐由CO2、H2和CO组成的混合气体,在同温、同压下与N2的密度相同,则该混合气中CO2、H2和CO的体积比为…………………( )
A.29:8:13 B. 22:1:14
C. 13:8:29 D. 26:16:57
10.在标准状况下,ag气体X与bg气体Y的分子数相同,下列叙述正确的是……………………………( )
A. 标准状况下,等质量的X和Y体积之比为b:a
B. 同温同压下,气体X和气体Y的密度之比为b:a
C. 25oC时,1g气体X和1g气体Y的分子数之比为b:a
D. 同物质的量的气体X和Y的质量之比为b:a
11. 同温、同压下,某瓶充满O2时质量为116g,充满CO2时质量为122g,充满A时为114g,则A的相对分子质量为 。
12. 在标准状况下,11.2LCO和CO2混合气体质量为20.4g,求混合气体中CO和CO2的体积比和质量比。
宏观性质
聚集状态
气态
液态
固态
易压缩
固定体积
固定形状
学习目标
知识技能:
知道固、液、气态物质的一些特性,初步学会运用气体摩尔体积等概念进行简单计算。
过程方法:
从分析研究影响固体、液体、气体体积的大小主要因素过程中,培养问题意识,调动探究的主观欲望,体验归纳整理的过程,学习分析矛盾的主要方面和次要方面。
情感态度:
通过影响物质体积大小的因素和气体摩尔体积的学习,培养与人合作的团队精神,善于合作学习,共同提高。在晶体的学习中感觉化学世界的美丽、奇妙与和谐。
教材分析
本框题是第一框题的延续,从物质的状态上对物质进行分类,并重点对气体的性质学习和研究,使学生进一步体会分类的方法,学会从不同的角度考虑问题,增强思维的发散性品质。教学中对影响物质体积的因素分析要善于从宏观到微观,有利于学生理解问题,也使学生能从本质上理解宏观现象与微观本质的关系,体验化学科学学习的特点。教学中还要不断巩固物质的量、摩尔质量、微粒个数、物质的质量的概念,精选适量的习题,以强化和巩固概念,培养解题的能力。
教学准备
多媒体课件
教时:1课时
教学过程
情景设计:
水有三种状态,同样是水分子,可以组成水蒸气,可以组成液态的水,还可以组成固态的冰,它们的差别是水分子的聚集方式不同。
通常物质有三种聚集状态,联系生活的经验,将三种状态与它们物质的相关性质用短线联接起来:
交流讨论:
在液体状态下,水分子之间靠得很近。邻近的分子之间的吸引力仍然很强,保持着紧密的聚集状态。在固态、液态、气态物质中,构成微粒的运动方式、微粒之间的距离是不同的。不同聚集状态物质的微粒结构上的差异,导致了其客观性质的不同。
物质的聚集状态 微粒结构 微粒运动方 式 宏观性质
形状 体积 压缩
固态 固定 固定 几乎不能
液态 不固定 固定 不易
气态 不固定 不固定 容易
活动探究:(分组计算、交换数据)
比较1mol下列物质体积:(固体 、液体在通常状态,气体在标准状况下)
物质 摩尔质量(g·mol-1) 密度(273K,101kPa) 体积
Fe 55.85 7.88g·cm-3
Al 26.98 2.7g·cm-3
Pb 207.2 11.3g·cm-3
H2O 18.02 0.998g·cm-3
C2H5OH 46.07 0.789 g·cm-3
H2 2.016 0.0899g·L-1
O2 32.0 1.43g·L-1
CO2 44.01 1.997g·L-1
(1) 通过合作学习,计算出相关的数据。(分组计算)
观察上表,你能得出什么结论?
①相同条件下,相同物质的量的不同状态的物质所占体积大小不同,通常是 ;
②相同条件下,相同物质的量的固体或液体所占的体积 ;
③相同条件下,相同物质的量的气体所占的体积近似 。
(2) 通过通俗的宏观实例(如将100只乒乓球、网球、篮球在操场上用不同方法放置后所占空间大小的比较),提出假设:
影响物质体积的因素可能性有哪些?
①物质中所含的粒子数的多少;②粒子间的平均距离;③粒子本身的大小。
(3) 探究:决定固体、液体、气体的体积大小的主要因素。
固体和液体物质:①内部紧密堆积,体积主要由粒子大小决定。②内部紧密堆积,改变温度、压强对体积影响不大。③1mol不同固体、液体的体积不相等。
气态物质:①分子间的距离比分子本身的体积大得多(约相差10倍),体积体积主要由分子间的距离决定。②体积受温度、压强影响大。③同温同压下,同物质的量的气体体积基本相等。
整理归纳:
相同的温度和压强下,不同气体的分子间距离基本相同。含有相同物质的量的气体,在相同的条件下具有相同的体积。
单位物质的量的气体所占的体积叫做气体摩尔体积(Vm)。
在标准状况(0℃、101KPa)下,1mol任何气体所占的体积都约为22.4L,气体摩尔体积约为22.4L·mol-1,这是气体摩尔体积的特例。
问题解决:
[问题1] 判断下列叙述哪项正确……………………………( )
A. 标准状况下,1moL任何物质的体积约为22.4L
B.1mol气体的体积约为22.4L
C.1mol氖气和1mol氧气体积相同
D. 标准状况下,1mol氖气和氯气混合气体(任意体积比)的体积约为22.4L
分析:根据气体摩尔体积的定义,应注意对其有影响的两个重要条件:一是指气体体积,而非液体或固体的体积;二是在标准状况下,气体的摩尔体积的具体值为22.4L·moL-1,而在不同温度和压强下,气体摩尔体积并不相同。注意审题、细心是解好化学题目的关键。 答案:D
[问题2] 13.0g锌与足量的稀盐酸完全反应,最多可收集到多少体积(标准状况)的氢所?
指导学生阅读解题过程,分析化学方程式中量的关系。
Zn + 2HCl = ZnCl2 + H2 ↑
物质的量 1mol 2 mol 1 mol 1 mol
相关物质有关量的 1 mol 22.4L
不同的表示方法 65g 1 mol
体验课本的解题过程,你能有更好的解题方法吗?写出你的解题过程。
[问题3] 计算在标准状况下,至少需要多少体积的氢气与足量的氧气反应才能生成18g水。
[问题4] 总结:气体的体积(V)与气体的物质的量(n)、气体摩尔体积(Vm)之间的关系。
信息博览
1.有关气体摩尔体积的计算
气体的体积、物质的量、气体的质量、气体的微粒数目之间的关系。
2.气体摩尔体积的常见应用
标准状况下1mol气体为22.4L,即可导出其质量便是该气体的摩尔质量。据此可求出未知化学式的气体摩尔质量和相对分子质量,也可求出1L气体的质量即气体密度。反之也可由气体密度求摩尔质量。同温、同压下两气体的密度比叫气体的相对密度,可据此由气体的相对密度求气体的摩尔质量,如某气体对H2的相对密度为15,则其相对分子质量为15×2。常见的有:
(1)由标准状况下气体密度求相对分子质量:Mr=22.4d。
(2由相对密度求气体的相对分子质量:若为的相对密度则为:Mr= d对H2·2,若为对空气的相对密度则为:Mr= d对空气·29。
*(3)求混合气体的平均相对分子质量,即1mol混合气体时的质量数值。在已知各组成气体的体积分数时见①,若为质量分数见②:
①=a%×Ma+b%×Mb+······
②=1/(a%÷Ma+b%÷Mb+······)
(4)由同温、同压下气体反应时的体积比求分子数,进而推分子数。
(5)直接将气体摩尔体积代入有关化学方程式进行计算。
(6)气体反应物的体积比即分子数比可便于找出过量气体。
*3.阿伏加德罗定律 同温、同压下体积相同的任何气体都含有相同的分子数即阿伏加德罗定律。由此可见气体的体积比在同温、同压下必等于分子数比。由此可以导出同温、同压下不同气体间的关系:
(1)同温、同压下,气体的体积比等于物质的量比。VA/VB=nA/nB
(2 ) 同温、同压下,气体的压强比等于物质的量比。pA/pB=nA/nB
(3 ) 同温、同压下,气体的摩尔质量比等于密度比。MA/MB=dA/dB
(4 ) 同温、同压下,同体积的气体质量比等于摩尔质量的反比。mA/mB=MA/MB
(5) 同温、同压下,同质量气体的体积比等于摩尔质量的反比。VA/VB=MB/MA
此外在运用时要结合物理中的同物质的量的气体在同温时,其体积与压强成反比;气体体积与热力学温度在同压条件下成正比。
3.晶体和非晶体
实践巩固
1.下列说法正确的是……………………………( )
A.常温、常压下,11.2L氯气所含的原子数为NA
B. 常温、常压下,1mol氦气含有的核外电子数为4NA
C. 17g氨气所含的电子数目为10NA
D. 同温、同压下,相同体积的任何气体单质所含的原子数目相同
2.标准状况下,下列物质体积最大的是……………………………( )
A.2g H2 B. 20g SO2
C. 23gNa D. 160gBr2
3.在标准状况下 ,1LN2中含m个氮分子,则阿伏加德罗常数可表示为…………………( )
A. B.
C. 22.4m D. 22.4m/mol
4.在同温、同压下,A容器中盛有H2,B容器中盛有NH3,若使它们所含的原子总数相等,则两个容器的体积比是……………………………( )
A. 2:1 B. 1:2
C. 2:3 D. 1:3
5.下列各组物质,所含分子数一定相同的是……………………………( )
A.1g H2和8g O2 B. 0.1molHCl和22.4LHe
C. 150oC、1.01×105Pa时18LH2O和18LCO2
D. 28gCO和6.02×1023个CO分子
6.nmol O2与nmolCO相比较,下列叙述正确的是……………………………( )
A.在同温同压下体积相等
B.在同温同压下密度相等
C. 在标准状况下质量相等
D. 分子数相等
7.在标准状况下,将1g氦气,11g二氧化碳和4g氧气混合,该混合气体的体积约为…………………( )
A.28 L B. 11.2L
C. 16.8L D. 14. L 0
8.在标准状况下,某气体密度为1.25g· L -1,则该其气体的相对分子质量为…………………( )
A.12.5 B. 14
C. 28 D. 30
⒐由CO2、H2和CO组成的混合气体,在同温、同压下与N2的密度相同,则该混合气中CO2、H2和CO的体积比为…………………( )
A.29:8:13 B. 22:1:14
C. 13:8:29 D. 26:16:57
10.在标准状况下,ag气体X与bg气体Y的分子数相同,下列叙述正确的是……………………………( )
A. 标准状况下,等质量的X和Y体积之比为b:a
B. 同温同压下,气体X和气体Y的密度之比为b:a
C. 25oC时,1g气体X和1g气体Y的分子数之比为b:a
D. 同物质的量的气体X和Y的质量之比为b:a
11. 同温、同压下,某瓶充满O2时质量为116g,充满CO2时质量为122g,充满A时为114g,则A的相对分子质量为 。
12. 在标准状况下,11.2LCO和CO2混合气体质量为20.4g,求混合气体中CO和CO2的体积比和质量比。
宏观性质
聚集状态
气态
液态
固态
易压缩
固定体积
固定形状
