原子的构成[上学期]
图片预览


文档简介
课题:原子的构成
——三门中学 叶文洋
一、教学目标
(一)知识与技能
1、了解原子是由原子核和核外电子构成,绝大多数原子的原子核由质子与中子构成的。
2、能根据原子组成符号判断原子的构成。
3、知道同位素等概念。
(二)过程与方法
1、获取信息的能力。
2、独立思考,分析问题及解决问题的能力。
3、口头表达能力。
(三)情感、态度、价值观
1、与同伴合作与沟通的能力。
2、了解化学知识(同位素)在化学研究中的作用,感受化学知识的价值与魅力。
3、通过拓展视野栏目,培养学生的社会责任感,参与意识。
二、教学重难点
重点:①解决对符号×(×n-)识别,能准确判断原子(或离子)的组成。
②了解核素,并能说出元素、核素,同位素三者的关系。
难点:①对符号×(×n-)识别与判断。
②能分清质量数,相对质量和原子质量三者之间的区别与联系。
三、教学方法
教师通过创设问题情景,学生自主学习,自主讨论相结合。
四、教学思路
复习
今天,这节课,我们继续学习原子的结构知识,请大家阅读P29《你知道吗》
阅读
引题
原子是由原子核和核外电子构成的。绝大多数原子的原子核由质子和中子构成,这三种粒子的质量大小怎样,谁的质量最大?
计算
扩展到 带电荷
讨论
应用于
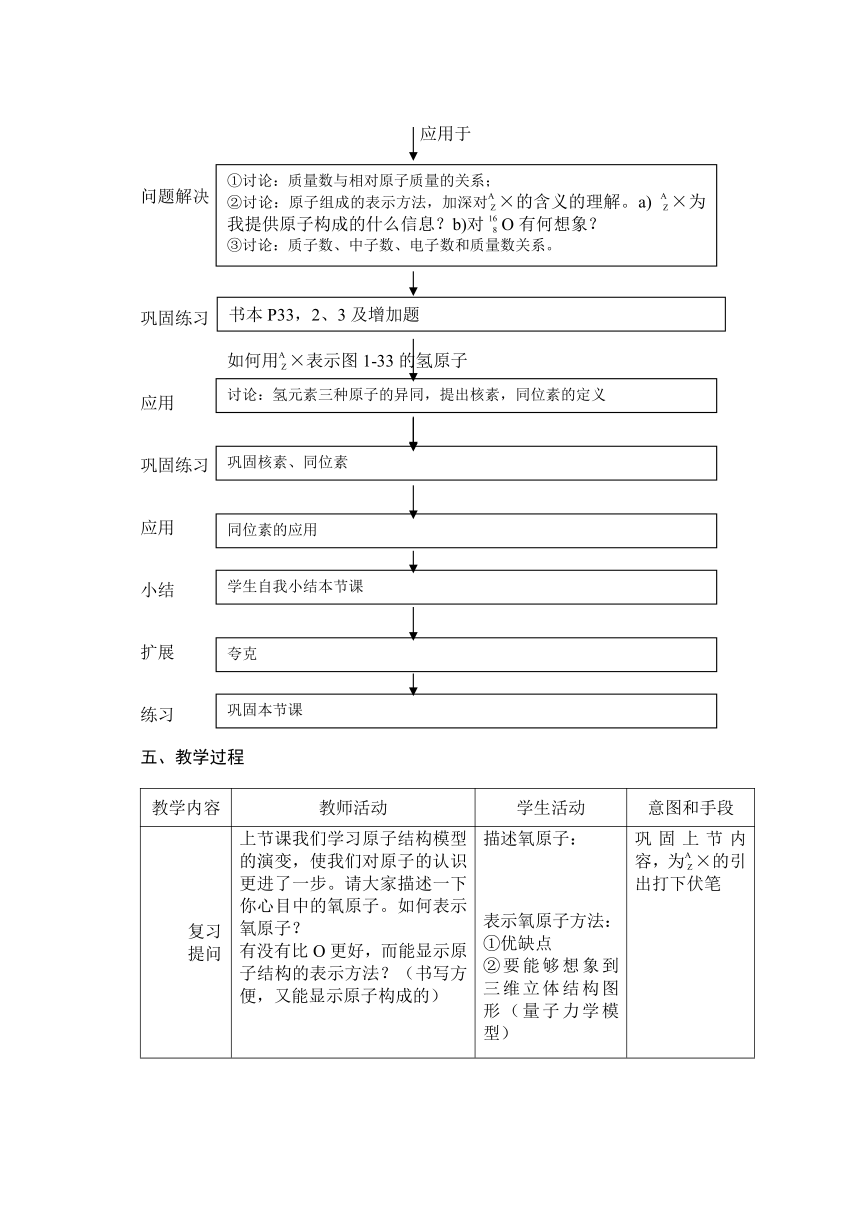
问题解决
巩固练习
如何用×表示图1-33的氢原子
应用
巩固练习
应用
小结
扩展
练习
五、教学过程
教学内容 教师活动 学生活动 意图和手段
复习提问 上节课我们学习原子结构模型的演变,使我们对原子的认识更进了一步。请大家描述一下你心目中的氧原子。如何表示氧原子?有没有比O更好,而能显示原子结构的表示方法?(书写方便,又能显示原子构成的) 描述氧原子:表示氧原子方法:①优缺点②要能够想象到三维立体结构图形(量子力学模型) 巩固上节内容,为×的引出打下伏笔
教学内容 教师活动 学生活动 意图和手段
导课 1、今天这节课我们继续学习原子的结构知识,请大家阅读P29的《你知道吗?》2、原子是否可以再分?它的构成怎么样?它是由哪些更小的微粒构成的?3、C—12原子指的是什么原子?4、有没明其他让人一目了然(一眼便知6个中子、6个质子)的表示方法。 阅读2、可以,它由原子核和核外电子构成。3、含有6个质子与6个中了的碳原子4、U—235(你能知道质子数与中子数吗?) 让学生参与学习活动,引出将要学习的新课题,为引出×埋下伏笔
质子、中子、和电子的质量,相对质量与电量 引导:原子是由原子核和核外电子构成的,绝大多数原子核由质子和中子构成,质子、中子和电子是构成原子的三种粒子,这三种粒子谁的质量最大?请大家看它们的质量。 回答: 的质量最大。1.0071.0085.8×10-4①三种粒子的质量都很小②质量:中子>质子>电子,中子与质子质量基本相等③电子的质量比中子、质子都要少很多。微粒质量的大小。 让学生自主学习,自主探究,体验交流讨论,发现规律得出结论的过程,培养学生积极思考与参与的意识。
质量(kg) 相对质量
质子 1.673×10-27 1.007
中子 1.675×10-27 1.008
电子 9.109×10-31 5.48×10-4
从以上的数据你会得出哪些结论?引导:因为质量大小,使用以上数据并不方便,要采用相对质量以那一个量为标准?(C—12质量的,即1.661×10-27kg)请大家求出。问:相对质量数值大小说明了什么?
教学内容 教师活动 学生活动 意图和手段
质子、中子和电子的质量相对质量和电量 请大家翻到书本P30与表1-7比较一下你的结果,从表中再看一下粒子的带电荷情况怎么样?你还有哪些认识? 中子不带电荷,质子带正电荷,电子带负电荷,质子和电子的带电量相等
追问:1、你认为原子的质量集中在原子核上还是原子核外?为什么?2、相对整个原子来说,原子核外某个电子质量能否忽略不计?3、椐报道,国外某研究所已发现了114号元素的原子,这种原子的核外共有114个电子,你认为在计算该原子的质量时能否把114个电子都忽略不计? 展开讨论 得出结论①核上: ②忽略③忽略
氢钠、氯、氖等原子都是显电中性,由此你能得出什么结论? 每种原子中核内的质子数跟核外的电子数相等。
根据刚才的研究,获得认识:原子的质量集中在原子核上,原子的质量大小由核中的质子数和中子数决定,由于原子显电中性,所以原子核内的质子数原子核外的电子数相等。请大家用以上结论去解问题,完成P30。“问题解决”。 学生讨论结果为:1、质量数(A)=质子数(Z)+中子数(N)2、质量数为A,质子数为Z的原子,表示为×
教学内容 教师活动 学生活动 意图和手段
质量数与× 追问:1、一种原子的质量数与它的相对原子质量什么关系?2、一个F与Na的质量比 为多少?约为多少?3、×为我们提供了该种原子的什么信息?4、O表示什么样的原子?与O的差别(还表示氧元素) ①质量数与相对原子质量近似相等②质量数大小的含义:表示原子的质量相对大小可以代替相对原子质量。19:23③哪一种元素质量数 相对原子质量质子数 电子数 核电荷数质量数 — 质子数=中子数④原子核内有10个中子和8个质子,核外有8个e-的氧原子(揭示了原子的构成,可以想象三维立体图) 对质量数的理解对×的理解
课堂练习:1、书本P33,2、32、科学家最近制造出核电荷数为112的新元素,其原子的质量数为277,关于该新元素的下列叙述正确的是 BD A、其原子核内中子数和质子数都是112。B、其原子核内中子数为165,核外电子数为112。C、其原子质量是12C原子质量的277倍。D、其原子质量与12C原子质量比为277:123、用×表示P31图1-33的三种氢原子,问所有的原子核中均有中子对吗? 学生做练习、回答:H H H又如H 巩固A=Z+N的关系
教学内容 教师活动 学生活动 意图和手段
核素、同位素与元素 追问:1、H H H三种原子属同一种元素吗?为什么?根据什么判同一元素?2、它们是同一种原子吗?为什么?(根据什么来判不同种原子)3、它们是什么关系?4、它们之间互种为同位素,那么单独可称为什么?5、什么叫核素?它与同位素、元素之间有什么关系,请用图来表示。6、请用核素、同位素、元素的概念描述H 7、下列的粒子中有几种核素 其中互为同位素的有 ,元素有 种。①C ②C ③N ④O⑤O ⑥O大多数原子有同位素,除了极少数如Na ,F。同位素间质子数相同,决定它们 1、同一种,因为它们的质子数相同,质子数决定了元素种类。2、不是同一种,因为它们的原子核不一样(中子数)称为H、D、T(质子数与中子数决定原子种类)3、同位素(互称)4、核素5、具有一定质子数和一定中子数的原子,同种核素,质子数相同,电子数也相同。6、H 是氢元素的一种核素,是H H 的同位素7、学生回答 引出核素的概念及它与同位素、元素之间的关系进一步巩固核素、同位素、的概念。
教学内容 教师活动 学生活动 意图和手段
同位素的应用 化学性质怎么样?中子数的不同决定了它们核的稳定性不同,许多同位素具有放射性,同位素的放射性使它们具有什么样的作用? 几乎相同阅读课本P32,且上网查资料;1、农业上辐射育种技术2、C考古断代3、Co 用于治疗肿瘤4、H H 制氢弹的材料 了解同位素的应用
请大家对本节课进行小结:原子由质子、中子、电子等基本粒子构成,那么它们还可以再分吗?请阅P31, 的发现。巩固练习1:1、关于H+,H-。H H H,五种微粒,下列说法正确的是 。A、是五种氢元素 B、是氢元素的五种同位素 C、是氢元素的五种不同微粒 D、它们的质子数均相同巩固练习2:现有×与×两种微粒,下列叙述不正确的是 。质子数一定相同,质量数和中子数一定不同 B、化学性质几乎相同 C、两种微粒一定都由质子、中子、电子构成,D、核电荷数、核外电子数一定相同 一、原子的构成及表示: 质子(Z个) 原子核原子 × 核外电子Z个质量数 ×质子数Z个元素符号 质量数≈原子的相对原子质量二、元素、核素、同位素的关系 培养学生对知识的整理能力
原子结构模型的演变,打开书本P28,描述一下你心目中氧原子,问除了书本P28的表示O原子外,有无其他方法。
①要求说出原子的构成。②C—12的含义。③表示含有6个质子6个中子的碳原子有没有其他的方法?
①三种粒子的质量都很小,故而使用不便,要采用相对质量,以那一种量为标准?②相对质量数值大小有何意义?(说明了什么?)
构成原子的三种粒子在质量大小,带电荷情况的差异归纳认识:a、三种微粒的质量都很少;b、质量:中子>质子>电子,中子与质子质量基本上相等;c、电子的质量大小;d、关于电荷
;;
①讨论:质量数与相对原子质量的关系;
②讨论:原子组成的表示方法,加深对eq \o(\s\up 6(A ),\s\do 2(Z))×的含义的理解。a) eq \o(\s\up 6(A ),\s\do 2(Z))×为我提供原子构成的什么信息?b)对eq \o(\s\up 6(16 ),\s\do 2(8))O有何想象?
③讨论:质子数、中子数、电子数和质量数关系。
书本P33,2、3及增加题
讨论:氢元素三种原子的异同,提出核素,同位素的定义
巩固核素、同位素
同位素的应用
学生自我小结本节课
夸克
巩固本节课
中子(A-Z)个
(除eq \o(\s\up 5(1 ),\s\do 1(1))H))
核素1
核素2
元 素
互称同位素
互称同位素
元 素
核素2
核素1
——三门中学 叶文洋
一、教学目标
(一)知识与技能
1、了解原子是由原子核和核外电子构成,绝大多数原子的原子核由质子与中子构成的。
2、能根据原子组成符号判断原子的构成。
3、知道同位素等概念。
(二)过程与方法
1、获取信息的能力。
2、独立思考,分析问题及解决问题的能力。
3、口头表达能力。
(三)情感、态度、价值观
1、与同伴合作与沟通的能力。
2、了解化学知识(同位素)在化学研究中的作用,感受化学知识的价值与魅力。
3、通过拓展视野栏目,培养学生的社会责任感,参与意识。
二、教学重难点
重点:①解决对符号×(×n-)识别,能准确判断原子(或离子)的组成。
②了解核素,并能说出元素、核素,同位素三者的关系。
难点:①对符号×(×n-)识别与判断。
②能分清质量数,相对质量和原子质量三者之间的区别与联系。
三、教学方法
教师通过创设问题情景,学生自主学习,自主讨论相结合。
四、教学思路
复习
今天,这节课,我们继续学习原子的结构知识,请大家阅读P29《你知道吗》
阅读
引题
原子是由原子核和核外电子构成的。绝大多数原子的原子核由质子和中子构成,这三种粒子的质量大小怎样,谁的质量最大?
计算
扩展到 带电荷
讨论
应用于
问题解决
巩固练习
如何用×表示图1-33的氢原子
应用
巩固练习
应用
小结
扩展
练习
五、教学过程
教学内容 教师活动 学生活动 意图和手段
复习提问 上节课我们学习原子结构模型的演变,使我们对原子的认识更进了一步。请大家描述一下你心目中的氧原子。如何表示氧原子?有没有比O更好,而能显示原子结构的表示方法?(书写方便,又能显示原子构成的) 描述氧原子:表示氧原子方法:①优缺点②要能够想象到三维立体结构图形(量子力学模型) 巩固上节内容,为×的引出打下伏笔
教学内容 教师活动 学生活动 意图和手段
导课 1、今天这节课我们继续学习原子的结构知识,请大家阅读P29的《你知道吗?》2、原子是否可以再分?它的构成怎么样?它是由哪些更小的微粒构成的?3、C—12原子指的是什么原子?4、有没明其他让人一目了然(一眼便知6个中子、6个质子)的表示方法。 阅读2、可以,它由原子核和核外电子构成。3、含有6个质子与6个中了的碳原子4、U—235(你能知道质子数与中子数吗?) 让学生参与学习活动,引出将要学习的新课题,为引出×埋下伏笔
质子、中子、和电子的质量,相对质量与电量 引导:原子是由原子核和核外电子构成的,绝大多数原子核由质子和中子构成,质子、中子和电子是构成原子的三种粒子,这三种粒子谁的质量最大?请大家看它们的质量。 回答: 的质量最大。1.0071.0085.8×10-4①三种粒子的质量都很小②质量:中子>质子>电子,中子与质子质量基本相等③电子的质量比中子、质子都要少很多。微粒质量的大小。 让学生自主学习,自主探究,体验交流讨论,发现规律得出结论的过程,培养学生积极思考与参与的意识。
质量(kg) 相对质量
质子 1.673×10-27 1.007
中子 1.675×10-27 1.008
电子 9.109×10-31 5.48×10-4
从以上的数据你会得出哪些结论?引导:因为质量大小,使用以上数据并不方便,要采用相对质量以那一个量为标准?(C—12质量的,即1.661×10-27kg)请大家求出。问:相对质量数值大小说明了什么?
教学内容 教师活动 学生活动 意图和手段
质子、中子和电子的质量相对质量和电量 请大家翻到书本P30与表1-7比较一下你的结果,从表中再看一下粒子的带电荷情况怎么样?你还有哪些认识? 中子不带电荷,质子带正电荷,电子带负电荷,质子和电子的带电量相等
追问:1、你认为原子的质量集中在原子核上还是原子核外?为什么?2、相对整个原子来说,原子核外某个电子质量能否忽略不计?3、椐报道,国外某研究所已发现了114号元素的原子,这种原子的核外共有114个电子,你认为在计算该原子的质量时能否把114个电子都忽略不计? 展开讨论 得出结论①核上: ②忽略③忽略
氢钠、氯、氖等原子都是显电中性,由此你能得出什么结论? 每种原子中核内的质子数跟核外的电子数相等。
根据刚才的研究,获得认识:原子的质量集中在原子核上,原子的质量大小由核中的质子数和中子数决定,由于原子显电中性,所以原子核内的质子数原子核外的电子数相等。请大家用以上结论去解问题,完成P30。“问题解决”。 学生讨论结果为:1、质量数(A)=质子数(Z)+中子数(N)2、质量数为A,质子数为Z的原子,表示为×
教学内容 教师活动 学生活动 意图和手段
质量数与× 追问:1、一种原子的质量数与它的相对原子质量什么关系?2、一个F与Na的质量比 为多少?约为多少?3、×为我们提供了该种原子的什么信息?4、O表示什么样的原子?与O的差别(还表示氧元素) ①质量数与相对原子质量近似相等②质量数大小的含义:表示原子的质量相对大小可以代替相对原子质量。19:23③哪一种元素质量数 相对原子质量质子数 电子数 核电荷数质量数 — 质子数=中子数④原子核内有10个中子和8个质子,核外有8个e-的氧原子(揭示了原子的构成,可以想象三维立体图) 对质量数的理解对×的理解
课堂练习:1、书本P33,2、32、科学家最近制造出核电荷数为112的新元素,其原子的质量数为277,关于该新元素的下列叙述正确的是 BD A、其原子核内中子数和质子数都是112。B、其原子核内中子数为165,核外电子数为112。C、其原子质量是12C原子质量的277倍。D、其原子质量与12C原子质量比为277:123、用×表示P31图1-33的三种氢原子,问所有的原子核中均有中子对吗? 学生做练习、回答:H H H又如H 巩固A=Z+N的关系
教学内容 教师活动 学生活动 意图和手段
核素、同位素与元素 追问:1、H H H三种原子属同一种元素吗?为什么?根据什么判同一元素?2、它们是同一种原子吗?为什么?(根据什么来判不同种原子)3、它们是什么关系?4、它们之间互种为同位素,那么单独可称为什么?5、什么叫核素?它与同位素、元素之间有什么关系,请用图来表示。6、请用核素、同位素、元素的概念描述H 7、下列的粒子中有几种核素 其中互为同位素的有 ,元素有 种。①C ②C ③N ④O⑤O ⑥O大多数原子有同位素,除了极少数如Na ,F。同位素间质子数相同,决定它们 1、同一种,因为它们的质子数相同,质子数决定了元素种类。2、不是同一种,因为它们的原子核不一样(中子数)称为H、D、T(质子数与中子数决定原子种类)3、同位素(互称)4、核素5、具有一定质子数和一定中子数的原子,同种核素,质子数相同,电子数也相同。6、H 是氢元素的一种核素,是H H 的同位素7、学生回答 引出核素的概念及它与同位素、元素之间的关系进一步巩固核素、同位素、的概念。
教学内容 教师活动 学生活动 意图和手段
同位素的应用 化学性质怎么样?中子数的不同决定了它们核的稳定性不同,许多同位素具有放射性,同位素的放射性使它们具有什么样的作用? 几乎相同阅读课本P32,且上网查资料;1、农业上辐射育种技术2、C考古断代3、Co 用于治疗肿瘤4、H H 制氢弹的材料 了解同位素的应用
请大家对本节课进行小结:原子由质子、中子、电子等基本粒子构成,那么它们还可以再分吗?请阅P31, 的发现。巩固练习1:1、关于H+,H-。H H H,五种微粒,下列说法正确的是 。A、是五种氢元素 B、是氢元素的五种同位素 C、是氢元素的五种不同微粒 D、它们的质子数均相同巩固练习2:现有×与×两种微粒,下列叙述不正确的是 。质子数一定相同,质量数和中子数一定不同 B、化学性质几乎相同 C、两种微粒一定都由质子、中子、电子构成,D、核电荷数、核外电子数一定相同 一、原子的构成及表示: 质子(Z个) 原子核原子 × 核外电子Z个质量数 ×质子数Z个元素符号 质量数≈原子的相对原子质量二、元素、核素、同位素的关系 培养学生对知识的整理能力
原子结构模型的演变,打开书本P28,描述一下你心目中氧原子,问除了书本P28的表示O原子外,有无其他方法。
①要求说出原子的构成。②C—12的含义。③表示含有6个质子6个中子的碳原子有没有其他的方法?
①三种粒子的质量都很小,故而使用不便,要采用相对质量,以那一种量为标准?②相对质量数值大小有何意义?(说明了什么?)
构成原子的三种粒子在质量大小,带电荷情况的差异归纳认识:a、三种微粒的质量都很少;b、质量:中子>质子>电子,中子与质子质量基本上相等;c、电子的质量大小;d、关于电荷
;;
①讨论:质量数与相对原子质量的关系;
②讨论:原子组成的表示方法,加深对eq \o(\s\up 6(A ),\s\do 2(Z))×的含义的理解。a) eq \o(\s\up 6(A ),\s\do 2(Z))×为我提供原子构成的什么信息?b)对eq \o(\s\up 6(16 ),\s\do 2(8))O有何想象?
③讨论:质子数、中子数、电子数和质量数关系。
书本P33,2、3及增加题
讨论:氢元素三种原子的异同,提出核素,同位素的定义
巩固核素、同位素
同位素的应用
学生自我小结本节课
夸克
巩固本节课
中子(A-Z)个
(除eq \o(\s\up 5(1 ),\s\do 1(1))H))
核素1
核素2
元 素
互称同位素
互称同位素
元 素
核素2
核素1
