江苏沭阳县2006—2007学年度第一学期期中高一年级化学调研测试(苏教)[上学期]
文档属性
| 名称 | 江苏沭阳县2006—2007学年度第一学期期中高一年级化学调研测试(苏教)[上学期] |

|
|
| 格式 | rar | ||
| 文件大小 | 338.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-11-28 00:00:00 | ||
图片预览


文档简介
沭阳县2006—2007学年度第一学期期中高一年级调研测试
化 学 【命题人:张 军】
题号
一
二
三
四
五
总分
合分人
得分
说明:1.本卷满分120分,考试时间100分钟。
2.可能用到的数据:相对原子质量 H 1 C 12 N 14 O 16
Cl 35.5 Na 23 Mg 24 Mn 55 漂白粉摩尔质量为254g/mol
第Ⅰ卷(选择题56分)
一、选择题(本题包括8小题,每小题3分,共24分,每小题只有一个正确
答案,请将选择的答案填到相应的答案栏中)
1.人们对于化学科学有各种各样的认识,其中错误的是
A.化学面对日益严重的环境问题显的无能为力,升学时考不考无关大局
B.化学是一门以实验为基础的自然科学,可以培养学生动手能力
C.化学是一门具有极强实用性的科学,应该予以重视
D.化学将在能源、资源的合理开发和安全应用方面大显身手
2.下列仪器常用于物质分离的是
① ② ③ ④ ⑤ ⑥
A.①③⑤ B.②③⑤ C.②④⑤ D.①②⑥
3.放射性同位素I原子核内中子数与质子数之差为
A.19 B.53 C.72 D.125
4.将下列各组物质区别开来的实验方案(见括号内的方法)不妥的是
A.丝绸与棉布(采用灼烧的闻其气味的方法)
B.(NH4)2SO4与NH4Cl(采用加碱加热闻其气味的方法)
C.NaCl与KCl(采用灼烧时观察焰色的方法)
D.K2CO3与KNO3(采用加酸观察有无气泡产生的方法)
5.摩尔(molar)是
A.国际单位制的一个基本物理量 B.表示物质质量的单位
C.计量微观粒子的物质的量的单位 D.表示6.02×1023个粒子的集体
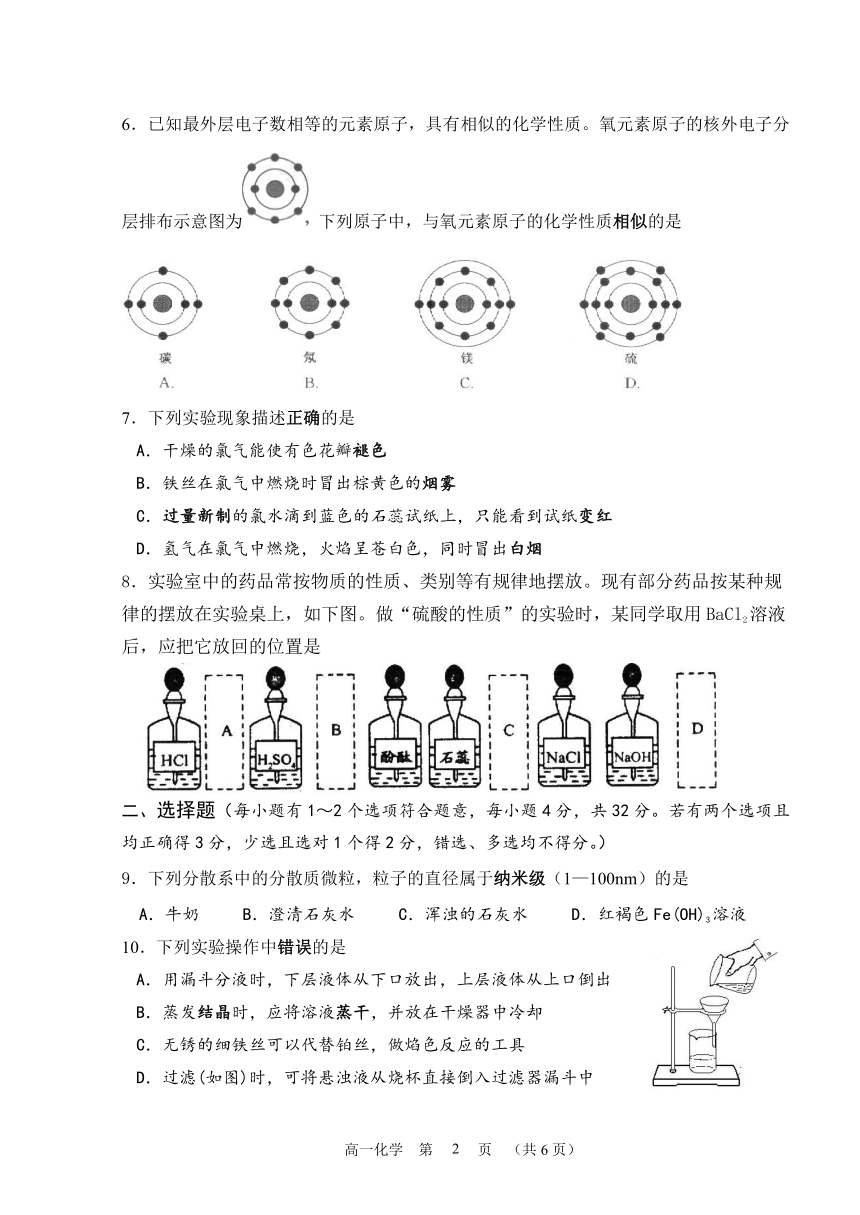
6.已知最外层电子数相等的元素原子,具有相似的化学性质。氧元素原子的核外电子分层排布示意图为 下列原子中,与氧元素原子的化学性质相似的是
7.下列实验现象描述正确的是
A.干燥的氯气能使有色花瓣褪色
B.铁丝在氯气中燃烧时冒出棕黄色的烟雾
C.过量新制的氯水滴到蓝色的石蕊试纸上,只能看到试纸变红
D.氢气在氯气中燃烧,火焰呈苍白色,同时冒出白烟
8.实验室中的药品常按物质的性质、类别等有规律地摆放。现有部分药品按某种规律的摆放在实验桌上,如下图。做“硫酸的性质”的实验时,某同学取用BaCl2溶液后,应把它放回的位置是
二、选择题(每小题有1~2个选项符合题意,每小题4分,共32分。若有两个选项且均正确得3分,少选且选对1个得2分,错选、多选均不得分。)
9.下列分散系中的分散质微粒,粒子的直径属于纳米级(1—100nm)的是
A.牛奶 B.澄清石灰水 C.浑浊的石灰水 D.红褐色Fe(OH)3溶液
10.下列实验操作中错误的是
A.用漏斗分液时,下层液体从下口放出,上层液体从上口倒出
B.蒸发结晶时,应将溶液蒸干,并放在干燥器中冷却
C.无锈的细铁丝可以代替铂丝,做焰色反应的工具
D.过滤(如图)时,可将悬浊液从烧杯直接倒入过滤器漏斗中
11.已知在等温、等容条件下,气体的物质的量与压强成正比。同温、同体积、同质量的CO2、N2、H2、O2的四种气体,按压强由大到小的顺序排列,正确的是
A.H2>O2>N2>CO2 B.CO2>O2>N2>H2
C.H2>N2>O2>CO2 D.CO2>H2>O2>N2
12.已知只有浓盐酸与MnO2在加热的条件下,才能反应,产生Cl2。稀盐酸与MnO2不反应。请问在课堂上做演示实验时,用下列两种方法制取Cl2:①用含HCl 146g的浓盐酸与足量的MnO2反应;②用87gMnO2与足量的浓盐酸反应,则所得Cl2 。
A.②比①多 B.①比②多
C.一样多 D.无法比较
13.同为1L的NaCl溶液(浓度为c1)和Na2CO3溶液(浓度为c2),若其中的c(Na+) 物质的量浓度相同,则它们的物质的量浓度c1和c2的关系是
A.c1=2c2 B.c1 >c2 C.2c1 =c2 D.c1 <c2
14.设NA为阿伏加德罗常数的值,下列有关其说法正确的是
A.常温、常压下,11.2 L 空气中,含有的分子数为0.5NA
B.常温、常压下,1 mol KCl晶体中含有NA个K原子
C.在室温和常压下,71 g Cl2含有2NA个Cl原子
D.在同温、同压下,相同体积的任何气体,所含分子数和原子数都相同
15.右边的标签,是同学们经常使用的一种修正液的包装说明。某同学在仔细阅读后,结合自己的生活经验和所学知识,得出了修正液的某些性质的推测,请你分析他的结论中不合理的是
A.修正液对纸张不具腐蚀性
B.修正液是一种胶体,均一、透明
C.修正液的溶剂易燃,严禁接触明火
D.修正液中不仅含有易挥发的物质、也含有毒的物质
16.下列离子方程式中,正确的是
A.稀硫酸与氢氧化钡液反应:Ba2++OH-+H++SO42-= BaSO4↓+H2O
B.铁与稀H2SO4反应:2Fe+6H+ = 2Fe3++3H2↑
C.在氯化镁溶液中加入澄清石灰水:Mg2++Ca(OH)2 = Mg(OH)2↓+Ca2+
D.碳酸钙与盐酸反应:CaCO3+2H+ = Ca2++CO2↑+H2O
得 分
评卷人
第Ⅰ卷(选择题答题卡56分)
一、选择题(本题每小题3分,共24分,每小题只有一个正确答案)
题号
1
2
3
4
5
6
7
8
答案
二、选择题(本题每小题4分,共32分,每小题只有一个或两个正确答案)
题号
9
10
11
12
13
14
15
16
答案
第Ⅱ卷(非选择题64分)
三、实验题(本项共2大题,共19分)
17.(本题共2小题,共7′)
⑴ 配制500mL 2.5mol/L浓度的NaOH溶液时,需要的玻璃仪器,除了烧杯、玻璃棒外,还必须有的是 、 。
⑵ 现有一瓶A和B的混合液,已知它们的性质如下表。
物质
熔点/oC
沸点/oC
密度/g·cm-3
溶解性
A
-11.5
198
1.11
A、B互溶,且均易溶于水
物质
熔点/oC
沸点/oC
密度/g·cm-3
溶解性
A
-11.5
198
1.11
A、B互溶,且均易溶于水
B
17.9
290
1.26
据此分析,将A和B相互分离的常用方法是: 。
物质
熔点/oC
沸点/oC
密度/g·cm-3
溶解性
A
-11.5
198
1.11
A、B互溶,且均易溶于水
B
17.9
290
1.26
18.(共12′)如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题。
⑴ 图中有两处明显的错误是① ;
② 。
⑵ A仪器的名称是 ,B仪器
的名称是 。
⑶ 实验时A中除加入少量自来水外,还需要加
入少量的 ,其作用是
。
四、填空题(本项共3大题,共31分)
19.(共11′)下列三组物质中,均有一种物质的类别与其它三种不同
A.MgO、Na2O、CO2、CuO B.HCl、H2O、H2SO4、HNO3
C.NaOH、Na2CO3、KOH、Cu(OH)2
⑴ 三种物质依次是(填化学式):A ;B ;C 。
⑵ 这三种物质相互作用可生成一种新物质,该反应 氧化还原反应(填“是”或“不是”)。
⑶ 写出这种新物质与足量盐酸反应的离子方程式:
________________________________________________________________________
20.(共8′)氯水在和下列物质反应时,分别是氯水中的哪种微粒起主要作用?
⑴ 氯水能使无水硫酸铜变蓝 。(写出起作用的微粒的化学式,下同)
⑵ 氯水中加碳酸钠产生气体 。
⑶ 氯水在光照的条件下产生气体 。
⑷ 氯水中加入镁粉,溶液的淡黄绿色会褪去 。
21.(共12′)从海水中可提取各种化工产品,下图是工业上对海水的一种综合利用的流程图:
⑴ 在实验室对海水进行过滤,所需要玻璃仪器为烧杯、漏斗和 ,补填的玻璃仪器在过滤时,起到了 的作用。
⑵ 若粗盐中仅含有Ca2+、Mg2+两种杂质离子。精制提纯时,备用的除杂试剂有:
(A.盐酸 B.Na2CO3溶液 C.NaOH溶液) 请你正确排列加入的顺序:
( )、( )、( )(填编号)
⑶ 用右图电解食盐水,石墨电极上产生的气体为 ;在铁棒周围的溶液里滴加紫色石蕊,溶液变 色。
⑷ 在盛有Mg(OH)2固体的烧杯中,加入足量盐酸,待固体全部溶解后,要从溶液中获取MgCl2·6H2O晶体,需要进行的实验操作依次为 (填编号)。
A.蒸馏 B.蒸发 C.冷却结晶 D.晶体灼烧
五、计算题(本题共14分)
22.(共14′)写出下列变化(石灰石→生石灰→消石灰→漂白粉)的有关反应化学方程式,并计算如果要制取508g漂白粉,一共需要含杂质20%的石灰石多少克?
(提示:本题建立总的关系式解答,较为方便。注意答题不能答到框外)
化学方程式:⑴
⑵
⑶
有关计算:
沭阳县2006~2007学年度第一学期期中考试
高一化学试卷参考答案(新课标·苏教版)
第Ⅰ卷 (选择题答题卡56分)
一、选择题(本题每小题3分,共24分,每小题只有一个正确答案)
题号
1
2
3
4
5
6
7
8
答案
A
B
A
B
C
D
A
C
二、选择题(本题每小题4分,共32分,每小题只有一个或两个正确答案)
题号
9
10
11
12
13
14
15
16
答案
D
BD
C
A
AB
C
B
D
第Ⅱ卷(非选择题64分)
三、实验题(本题共2大题,共19分)
17.(共7′) ⑴500mL容量瓶(2′)、胶头滴管(2′); ⑵蒸馏(3′)
18. (共12′) ⑴①温度计水银球插入太深(2′);②冷却水进出口标反了(2′);
⑵蒸馏烧瓶(2′),冷凝管(2′); ⑶沸石(或碎瓷片)(2′),防止液体暴沸(2′)
四、填空题(本题共3大题,共31分)
19.(共11′) ⑴A:CO2(2′); B:H2O(2′); C:Na2CO3(2′)。
⑵ 不是 (2′)
⑶ HCO3- + H+ = H2O + CO2↑(3′)
20.(共8′)⑴H2O(2′);⑵HCl(2′);⑶HClO(2′);⑷Cl2(2′)
21.(共12′)⑴玻璃棒,(2′), 引流(2′); ⑵CBA或BCA(2′)
⑶Cl2(2′), 蓝(2′); ⑷B、C(2′)
五、计算题(本题共14分)
22.:① CaCO3 CaO+CO2(
②CaO+H2O ==Ca(OH)2 化学方程式每个2′,共6′
③2Cl2+2Ca (OH)2 ==CaCl2+Ca(ClO)2+2H2O
解:设需要含杂质20%的石灰石x g 解:设 1′
2CaCO3 ~{Ca(ClO)2+CaCl2} 关 系 式2′
比 例 式 2′
X=500g 计算结果2′
答案:500g。 答 案1′
化 学 【命题人:张 军】
题号
一
二
三
四
五
总分
合分人
得分
说明:1.本卷满分120分,考试时间100分钟。
2.可能用到的数据:相对原子质量 H 1 C 12 N 14 O 16
Cl 35.5 Na 23 Mg 24 Mn 55 漂白粉摩尔质量为254g/mol
第Ⅰ卷(选择题56分)
一、选择题(本题包括8小题,每小题3分,共24分,每小题只有一个正确
答案,请将选择的答案填到相应的答案栏中)
1.人们对于化学科学有各种各样的认识,其中错误的是
A.化学面对日益严重的环境问题显的无能为力,升学时考不考无关大局
B.化学是一门以实验为基础的自然科学,可以培养学生动手能力
C.化学是一门具有极强实用性的科学,应该予以重视
D.化学将在能源、资源的合理开发和安全应用方面大显身手
2.下列仪器常用于物质分离的是
① ② ③ ④ ⑤ ⑥
A.①③⑤ B.②③⑤ C.②④⑤ D.①②⑥
3.放射性同位素I原子核内中子数与质子数之差为
A.19 B.53 C.72 D.125
4.将下列各组物质区别开来的实验方案(见括号内的方法)不妥的是
A.丝绸与棉布(采用灼烧的闻其气味的方法)
B.(NH4)2SO4与NH4Cl(采用加碱加热闻其气味的方法)
C.NaCl与KCl(采用灼烧时观察焰色的方法)
D.K2CO3与KNO3(采用加酸观察有无气泡产生的方法)
5.摩尔(molar)是
A.国际单位制的一个基本物理量 B.表示物质质量的单位
C.计量微观粒子的物质的量的单位 D.表示6.02×1023个粒子的集体
6.已知最外层电子数相等的元素原子,具有相似的化学性质。氧元素原子的核外电子分层排布示意图为 下列原子中,与氧元素原子的化学性质相似的是
7.下列实验现象描述正确的是
A.干燥的氯气能使有色花瓣褪色
B.铁丝在氯气中燃烧时冒出棕黄色的烟雾
C.过量新制的氯水滴到蓝色的石蕊试纸上,只能看到试纸变红
D.氢气在氯气中燃烧,火焰呈苍白色,同时冒出白烟
8.实验室中的药品常按物质的性质、类别等有规律地摆放。现有部分药品按某种规律的摆放在实验桌上,如下图。做“硫酸的性质”的实验时,某同学取用BaCl2溶液后,应把它放回的位置是
二、选择题(每小题有1~2个选项符合题意,每小题4分,共32分。若有两个选项且均正确得3分,少选且选对1个得2分,错选、多选均不得分。)
9.下列分散系中的分散质微粒,粒子的直径属于纳米级(1—100nm)的是
A.牛奶 B.澄清石灰水 C.浑浊的石灰水 D.红褐色Fe(OH)3溶液
10.下列实验操作中错误的是
A.用漏斗分液时,下层液体从下口放出,上层液体从上口倒出
B.蒸发结晶时,应将溶液蒸干,并放在干燥器中冷却
C.无锈的细铁丝可以代替铂丝,做焰色反应的工具
D.过滤(如图)时,可将悬浊液从烧杯直接倒入过滤器漏斗中
11.已知在等温、等容条件下,气体的物质的量与压强成正比。同温、同体积、同质量的CO2、N2、H2、O2的四种气体,按压强由大到小的顺序排列,正确的是
A.H2>O2>N2>CO2 B.CO2>O2>N2>H2
C.H2>N2>O2>CO2 D.CO2>H2>O2>N2
12.已知只有浓盐酸与MnO2在加热的条件下,才能反应,产生Cl2。稀盐酸与MnO2不反应。请问在课堂上做演示实验时,用下列两种方法制取Cl2:①用含HCl 146g的浓盐酸与足量的MnO2反应;②用87gMnO2与足量的浓盐酸反应,则所得Cl2 。
A.②比①多 B.①比②多
C.一样多 D.无法比较
13.同为1L的NaCl溶液(浓度为c1)和Na2CO3溶液(浓度为c2),若其中的c(Na+) 物质的量浓度相同,则它们的物质的量浓度c1和c2的关系是
A.c1=2c2 B.c1 >c2 C.2c1 =c2 D.c1 <c2
14.设NA为阿伏加德罗常数的值,下列有关其说法正确的是
A.常温、常压下,11.2 L 空气中,含有的分子数为0.5NA
B.常温、常压下,1 mol KCl晶体中含有NA个K原子
C.在室温和常压下,71 g Cl2含有2NA个Cl原子
D.在同温、同压下,相同体积的任何气体,所含分子数和原子数都相同
15.右边的标签,是同学们经常使用的一种修正液的包装说明。某同学在仔细阅读后,结合自己的生活经验和所学知识,得出了修正液的某些性质的推测,请你分析他的结论中不合理的是
A.修正液对纸张不具腐蚀性
B.修正液是一种胶体,均一、透明
C.修正液的溶剂易燃,严禁接触明火
D.修正液中不仅含有易挥发的物质、也含有毒的物质
16.下列离子方程式中,正确的是
A.稀硫酸与氢氧化钡液反应:Ba2++OH-+H++SO42-= BaSO4↓+H2O
B.铁与稀H2SO4反应:2Fe+6H+ = 2Fe3++3H2↑
C.在氯化镁溶液中加入澄清石灰水:Mg2++Ca(OH)2 = Mg(OH)2↓+Ca2+
D.碳酸钙与盐酸反应:CaCO3+2H+ = Ca2++CO2↑+H2O
得 分
评卷人
第Ⅰ卷(选择题答题卡56分)
一、选择题(本题每小题3分,共24分,每小题只有一个正确答案)
题号
1
2
3
4
5
6
7
8
答案
二、选择题(本题每小题4分,共32分,每小题只有一个或两个正确答案)
题号
9
10
11
12
13
14
15
16
答案
第Ⅱ卷(非选择题64分)
三、实验题(本项共2大题,共19分)
17.(本题共2小题,共7′)
⑴ 配制500mL 2.5mol/L浓度的NaOH溶液时,需要的玻璃仪器,除了烧杯、玻璃棒外,还必须有的是 、 。
⑵ 现有一瓶A和B的混合液,已知它们的性质如下表。
物质
熔点/oC
沸点/oC
密度/g·cm-3
溶解性
A
-11.5
198
1.11
A、B互溶,且均易溶于水
物质
熔点/oC
沸点/oC
密度/g·cm-3
溶解性
A
-11.5
198
1.11
A、B互溶,且均易溶于水
B
17.9
290
1.26
据此分析,将A和B相互分离的常用方法是: 。
物质
熔点/oC
沸点/oC
密度/g·cm-3
溶解性
A
-11.5
198
1.11
A、B互溶,且均易溶于水
B
17.9
290
1.26
18.(共12′)如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题。
⑴ 图中有两处明显的错误是① ;
② 。
⑵ A仪器的名称是 ,B仪器
的名称是 。
⑶ 实验时A中除加入少量自来水外,还需要加
入少量的 ,其作用是
。
四、填空题(本项共3大题,共31分)
19.(共11′)下列三组物质中,均有一种物质的类别与其它三种不同
A.MgO、Na2O、CO2、CuO B.HCl、H2O、H2SO4、HNO3
C.NaOH、Na2CO3、KOH、Cu(OH)2
⑴ 三种物质依次是(填化学式):A ;B ;C 。
⑵ 这三种物质相互作用可生成一种新物质,该反应 氧化还原反应(填“是”或“不是”)。
⑶ 写出这种新物质与足量盐酸反应的离子方程式:
________________________________________________________________________
20.(共8′)氯水在和下列物质反应时,分别是氯水中的哪种微粒起主要作用?
⑴ 氯水能使无水硫酸铜变蓝 。(写出起作用的微粒的化学式,下同)
⑵ 氯水中加碳酸钠产生气体 。
⑶ 氯水在光照的条件下产生气体 。
⑷ 氯水中加入镁粉,溶液的淡黄绿色会褪去 。
21.(共12′)从海水中可提取各种化工产品,下图是工业上对海水的一种综合利用的流程图:
⑴ 在实验室对海水进行过滤,所需要玻璃仪器为烧杯、漏斗和 ,补填的玻璃仪器在过滤时,起到了 的作用。
⑵ 若粗盐中仅含有Ca2+、Mg2+两种杂质离子。精制提纯时,备用的除杂试剂有:
(A.盐酸 B.Na2CO3溶液 C.NaOH溶液) 请你正确排列加入的顺序:
( )、( )、( )(填编号)
⑶ 用右图电解食盐水,石墨电极上产生的气体为 ;在铁棒周围的溶液里滴加紫色石蕊,溶液变 色。
⑷ 在盛有Mg(OH)2固体的烧杯中,加入足量盐酸,待固体全部溶解后,要从溶液中获取MgCl2·6H2O晶体,需要进行的实验操作依次为 (填编号)。
A.蒸馏 B.蒸发 C.冷却结晶 D.晶体灼烧
五、计算题(本题共14分)
22.(共14′)写出下列变化(石灰石→生石灰→消石灰→漂白粉)的有关反应化学方程式,并计算如果要制取508g漂白粉,一共需要含杂质20%的石灰石多少克?
(提示:本题建立总的关系式解答,较为方便。注意答题不能答到框外)
化学方程式:⑴
⑵
⑶
有关计算:
沭阳县2006~2007学年度第一学期期中考试
高一化学试卷参考答案(新课标·苏教版)
第Ⅰ卷 (选择题答题卡56分)
一、选择题(本题每小题3分,共24分,每小题只有一个正确答案)
题号
1
2
3
4
5
6
7
8
答案
A
B
A
B
C
D
A
C
二、选择题(本题每小题4分,共32分,每小题只有一个或两个正确答案)
题号
9
10
11
12
13
14
15
16
答案
D
BD
C
A
AB
C
B
D
第Ⅱ卷(非选择题64分)
三、实验题(本题共2大题,共19分)
17.(共7′) ⑴500mL容量瓶(2′)、胶头滴管(2′); ⑵蒸馏(3′)
18. (共12′) ⑴①温度计水银球插入太深(2′);②冷却水进出口标反了(2′);
⑵蒸馏烧瓶(2′),冷凝管(2′); ⑶沸石(或碎瓷片)(2′),防止液体暴沸(2′)
四、填空题(本题共3大题,共31分)
19.(共11′) ⑴A:CO2(2′); B:H2O(2′); C:Na2CO3(2′)。
⑵ 不是 (2′)
⑶ HCO3- + H+ = H2O + CO2↑(3′)
20.(共8′)⑴H2O(2′);⑵HCl(2′);⑶HClO(2′);⑷Cl2(2′)
21.(共12′)⑴玻璃棒,(2′), 引流(2′); ⑵CBA或BCA(2′)
⑶Cl2(2′), 蓝(2′); ⑷B、C(2′)
五、计算题(本题共14分)
22.:① CaCO3 CaO+CO2(
②CaO+H2O ==Ca(OH)2 化学方程式每个2′,共6′
③2Cl2+2Ca (OH)2 ==CaCl2+Ca(ClO)2+2H2O
解:设需要含杂质20%的石灰石x g 解:设 1′
2CaCO3 ~{Ca(ClO)2+CaCl2} 关 系 式2′
比 例 式 2′
X=500g 计算结果2′
答案:500g。 答 案1′
同课章节目录
